Introduction
Materials and Methods
포장 실험 및 실험 설계
시료 채취 및 분석
통계분석
Results and Discussion
토양 온도와 수분 변화
벼 바이오매스
토양효소 활성 변화
Conclusions
Introduction
토양 효소는 유기물 분해와 질소와 인과 같은 양분의 무기화 등 토양 물질순환에 매우 중요하다 (Sinsabaugh and Shah, 2012). 자연상태의 토양과 달리 인위적으로 관리되는 농경지 토양에서 효소 활성도는 영농관리 요인에 영향을 받는다 (Jian et al., 2016; Uwituze et al., 2022). 특히, 유기물과 비료 투입은 기질과 양분 유효도 변화를 통해 토양 효소활성에 영향을 준다 (Jian et al., 2016; Wei et al., 2019). 일반적으로 무기질 비료에 비해 유기질 비료 투입에 의해 미생물의 탄소 기질이 증가하여 미생물과 함께 효소 활성도 높아진다 (García-Ruiz et al., 2009; Moeskops et al., 2010). 또한, 토양 효소 활성은 탄소, 질소, 인과 같은 주요 원소의 화학양론에 의해서도 영향을 받는데, 예를 들면 과잉의 질소가 투입되면 질소 무기화 효소 활성이 낮아지고, 상대적으로 탄소와 인 무기화 효소 활성이 높아질 수 있다 (Jian et al., 2016). 또한, 키틴과 같이 질소를 함유한 기질을 투입하면 이를 가수분해하기 위해 질소 무기화 효소 활성이 증가하지만 (Zeglin et al., 2013), 무기태 형태인 NH4NO3를 투입하면 반대로 미생물에 필요한 질소와 인의 비율 유지를 위해 인 가용화 효소 활성이 증가한다 (He et al., 2023).
토양 온도 (Allison et al., 2010; Qi et al., 2016; Wei et al., 2019)와 수분함량 (Davison and Janssens, 2006; Steinweg et al., 2012; A’Bear et al., 2014)등 환경요인도 미생물과 효소 활성에 영향을 준다. 토양 효소 활성은 열역학적 관점에서 일반적으로 온도에 비례하지만 (Stone et al., 2012; Nottingham et al., 2016; Razavi et al., 2017), 그 민감도는 온도 범위, 기질 유효도, 수분 스트레스 등 다양한 요인에 영향을 받는다 (Davidson et al., 2006; Qi et al., 2016). 특히, 기질 유효도가 낮을 경우에는 이와 같은 온도에 따른 효소 활성 증가가 나타나지 않을 수 있다 (Berry and Raison, 1981; Davidson et al., 2006; Razavi et al., 2015). 수분함량은 기질 공급 속도를 통해서 효소 활성에 영향을 주는데, 예를 들면 수분포화 상태의 논은 밭에 비해 뿌리 삼출물을 통한 기질 공급이 용이하고 혐기적 조건에서 미생물의 생존 기간이 길어 미생물 생체량이 상대적으로 많으며 (Wei et al., 2022), 그 결과 효소 활성도도 높은 것으로 보고된다 (Ali et al., 2021). 따라서, 토양 온도의 영향도 독립적으로 발현되기 보다는 토양 수분함량과 같은 다른 요인과 동반하여 효소활성에 영향을 주는데, 일반적으로 수분불포화 조건에서는 온도상승에 의해 토양 수분함량이 감소하여 효소 활성이 감소하는 것으로 보고된다 (Steinweg et al., 2012; Zuccarini et al., 2020).
이와 같이 토양 효소 활성은 기질 공급은 물론 온도와 수분 등 매우 다양한 요인에 의해 영향을 받지만, 기존의 연구는 대부분 특정 요인 (수분, 온도, 유기물, 양분 등)을 통제하여 수행되어 시비와 온도 처리가 상이한 조건에서 벼 생육 과정 중 토양 효소 활성 변화에 대한 연구가 부족하다. 상이한 환경과 양분 조건은 작물 생장에도 영향을 주어, 작물과 미생물의 양분 경쟁과 작물 뿌리를 통한 삼출물 공급 등을 통해 미생물과 효소 활성에 간접적으로도 영향을 줄 수 있다 (Shen et al., 2023). 특히, 벼 (Oryza sativa L.)는 온도 상승에 의해 바이오매스 축적 양상이 달라지고, 고온스트레스에 의해 이삭 형성이 저하되어 광합성 산물의 지하 이동이 많아진다 (Kim et al., 2011). 이와 같은 온도상승 조건에서는 온도의 직접적인 영향과 함께 벼 생장에 대한 영향을 통해서도 효소 활성이 달라질 가능성도 있지만 관련 연구는 부족하다. 연구 목적에 따라 다양한 종류의 효소 활성이 조사되지만, 가장 널리 이용되는 효소는 탄소가 풍부한 셀룰로스 가수분해 효소인 β-1,4-glucosidase (BG) (Deng and Tabatabai, 1994), 질소를 함유한 키틴올리고당과 같은 키틴을 분해하는 β-1,4-N-acetylglucosaminidase (NAG) (Wen and Kellum, 2012), 인을 가용화하는 acid phosphatase (AP) (Bull et al., 2002)이다. 본 연구는 상이한 온도조건에서 시비조건 (무시비, 화학비료, 유기질 비료)에 따른 논 토양 효소 활성 변화를 조사하기 위해 수행하였다. 일반적으로 화학비료보다는 유기질 비료 투입에 의해 효소 활성이 증가하는 것으로 보고되고 있고 온도 상승에 따른 효소 활성 증가 연구 결과를 반영하여, 본 연구에서는 온도 상승 조건에서 유기질 비료 시용에 의해 토양 효소 활성이 더욱 증가할 것으로 가설을 설정하였다.
Materials and Methods
포장 실험 및 실험 설계
본 연구는 광주광역시 용봉동에 위치한 전남대학교 모의온도상승온실 (temperature gradient field chamber, TGC)에서 2022년 5월부터 9월까지 벼 재배 실험을 통해 수행하였다. TGC (2.0 m 폭, 24.0 m 길이, 2.4 m 높이)의 기온은 TGC 내에 설치된 공기 관로를 통해 온풍을 공급하여 챔버 입구부터 내부까지 기온이 상승하도록 구동되었다. 벼는 포트 (지름 30 cm, 깊이 38 cm)에서 재배하였고, 정상온도 (ambient temperature, AT)와 상승온도 (elevated temperature, ET) 차이를 3°C를 설정하고, 해당 지점에 벼 포트를 설치하였다. 이와 같은 온도 차이는 대표농도경로 (representative concentration pathways) 6.0 시나리오 (2.8°C 온도상승) (Cubasch et al., 2013)와 공통사회경제경로 (shared Socio-economic pathway 2-4.5) 시나리오와 유사하다. 벼 재배기간 동안, 각 온도 영역의 일평균 기온은 AT에서 27. 3°C, ET에서 30.3°C였다 (Fig. 1a). 포트 토양은 TGC 옆의 논 포장에서 채취하여 사용하였다 (Table 1).
무처리 (no input, NI)와 관행 화학비료 (chemical fertilizer, CF), 그리고 농업부산물 (유박)로 가공된 유기질 비료 및 가축 분뇨 퇴비 (organic fertilizer and manure compost, OC) (Table 1) 처리구를 두고 실험을 수행하였다. CF 처리구에는 CO(NH2)2, KH2PO4, KCl로 N-P2O5-K2O를 9.0-4.5-5.7 g m -2 투입하였으며, OC 처리구에는 시중에 판매하는 유박을 화학비료 시비구의 질소 시비량과 동일하게 포트 당 10.6 g (건조기준) 투입하였고, 퇴비는 돈분 (30%) - 우분 (10%) - 계분 (10%) 비율의 시중 판매제품을 구매하여 우리나라 관행 추천 시비량인 1.5 kg m-2 수준으로 포트 당 106 g (건조기준) 투입하였다. 유기질 비료와 퇴비 시비에 의해 인산과 가리는 각각 39.0 g m-2와 26.2 g m-2 공급되었다. 화학비료, 유기질 비료 및 퇴비는 모내기 1주일 전에 표층 5 cm와 혼합하였다.
모내기 전 각 포트에 토양 수분/온도 센서 (EC5, Decagon Devices, Inc., Pullman, WA, USA)를 수직으로 설치하여 재배기간 동안 토양 수분 및 온도 데이터를 30분 간격으로 측정하여, 데이터로거 (CR1000, Campbell Scientific, Logan, USA)로 수집하였다. 30일생 벼 유묘 (품종 새청무) 3포기를 2022년 5월 30일에 포트 토양 중앙에 모내기 후 (days after transplanting, DAT), 매일 관개수를 공급하여 담수위를 3 - 5 cm로 유지하였고, 중간낙수는 DAT 41 - 48일에 8일간 실시하였다. 농가에서는 일반적으로 벼 수확기 농기계 작업을 위해서 수확 전 최소 20일 전에 물떼기를 시작하지만, 본 연구에서는 벼 뿌리의 수분 흡수가 제한되는 포트 실험 조건을 고려하여 벼의 수확 전 수분 스트레스를 방지하기 위해 수확 5일 전 (DAT 116)부터 물공급을 중단하였고, 9월 28일 (DAT 121)에 수확하였다.
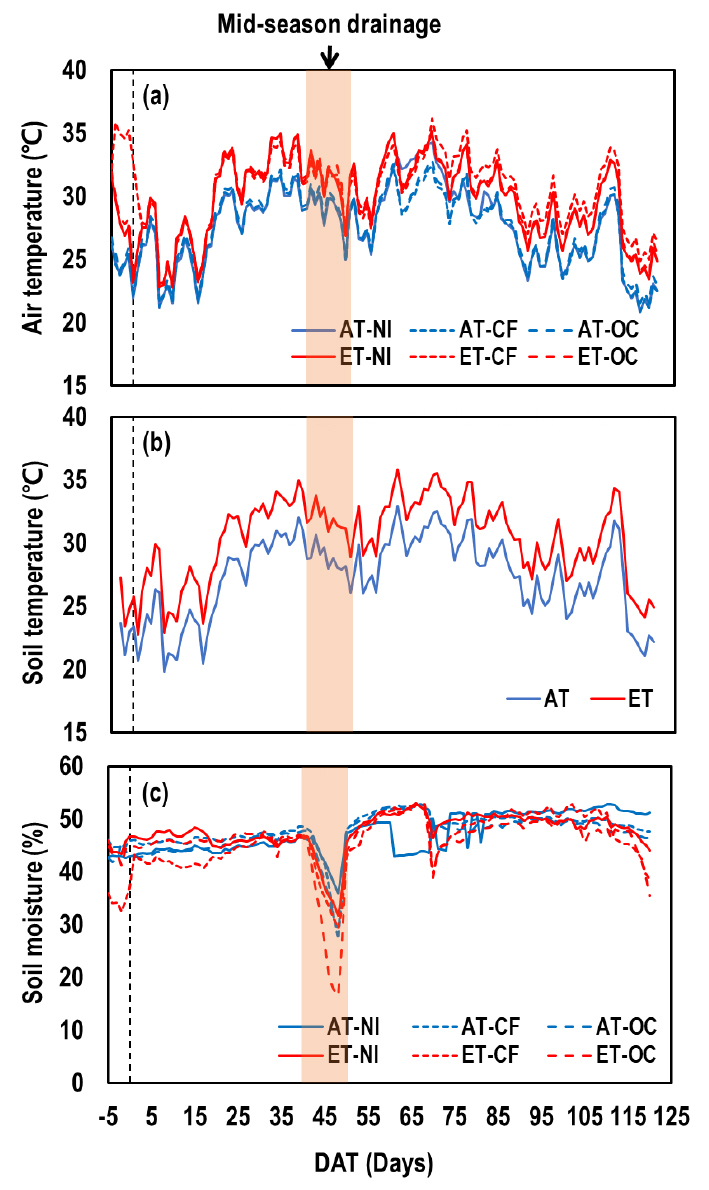
Fig. 1.
Changes in temperature and moisture of soils fertilized with no input (NI), chemical fertilizer (CF), and organic fertilizer and livestock manure compost (OC) under ambient (AT) and elevated (ET) air temperature during rice growing period including days after transplanting (DAT): (a) temporal changes in air temperature, (b) soil temperature, and (c) soil moisture.
Table 1.
Selected chemical properties of the soils packed in the pots, and organic fertilizer and livestock manure compost used in rice cultivation experiments.
| Variable1 | Soil | Organic fertilizer | Livestock manure compost |
| Texture | Silt loam | NA3 | NA |
| pH(1:5) | 5.8 (0.02) | ND | ND |
| Total C (g C kg-1) | 12.2 (0.3) | 332.5 (0.7) | 222.4 (0.1) |
| Total N (g N kg-1) | 1.2 (0.03) | 60.3 (0.2) | 22.5 (0.0) |
| Total P (g P kg-1) | 0.8 (0.02) | 5.4 (0.1) | 10.8 (0.4) |
| Total K (g K kg-1) | ND2 | 13.1 (0.5) | 13.2 (0.5) |
| C/N | 10.1 (0.2) | 5.5 (0.3) | 10.0 (0.05) |
1pH was measured at a 1:5 ratio of sample-to-water; total C and N concentration with a combustion method (Nelson and Sommers, 1996) using an elemental analyzer (FLAHEA-1112, Thermo, USA); total P concentration with an ascorbic acid colorimetric method (Kuo, 1996) after digestion with HNO3-HClO4; and total K concentrations were analyzed with an atomic absorption spectrometer (Analyst 800, Perkin Elmer, Waltham, USA) after digestion with HNO3-HClO4.
시료 채취 및 분석
효소 분석을 위한 토양 시료는 벼 생장 중 중간낙수 실시 기간 (2022년 7월 14일, DAT 45)과 벼 수확 후 (2022년 9월 28일, DAT 121)에 채취하였으며, 분석 전까지 냉동 보관하였다. 시비・온도 처리별 토양 시료는 Sinsabaugh et al. (2003)의 분석법에 따라 각 효소 활성도를 분석하였다. 250 mL HDPE 병에 담긴 1 g의 습윤 토양 시료에 125 mL sodium acetate buffer (50 mmol L-1)를 투입하여 실온상태에서 교반기를 사용해 30분동안 혼합했다. 균질화시킨 토양 현탁액을 준비한 뒤, 96웰 마이크로 플레이트에 옮겨 담고 토양 현탁액의 균질화를 유지하기 위해 약 2분동안 교반하였다.
이후 BG, NAG, 그리고 AP 활성도를 분석하기 위해, 토양 현탁액 200 µL과 각각의 기질발현 물질 50 µL (200 µmol L-1)을 검정 96웰 플레이트에 피펫팅하여 옮겨 담고 각 효소마다 3, 3, 2시간동안 20°C 암흑에서 항온 배양하였다. 항온 배양 후, 20 μL (0.5 mol L-1) sodium hydroxide solution을 투입하여 효소 반응을 중지한 후 다기능 마이크로 플레이트 리더 장치 (SpectraMax iD3, Molecular Devices, USA)를 이용하여 360 nm와 460 nm 파장에서 형광 정량하여 분석하였다.
Ec : Emission coefficient (fluor nmol-1) = Fstandard / 0.5
Qc : Quench coefficient = Fquench / Fstandard
Fassay : Mean fluorescence of soil assay wells
Fsubstrate : Mean fluorescence of substrate background wells
Fsoil : Mean fluorescence of soil background wells
Fbuffer : Mean fluorescence of buffer background wells
Fquench : Mean fluorescence of soil standard quench wells
Fstandard : Mean fluorescence of soil standard wells
V : Volume of extraction (125 mL)
T : Time of incubation in hr = T2 - T1
W : Fresh weight of soil (g)
M : Moisture content of soil per dry weight (g g-1)
식물체 시료는 2022년 9월 28일 (DAT 121)에 지표로부터 5 cm 상부에서 전장가위로 벼를 수확하였고, 60°C에 오븐 건조 후에 벼 지상부 건물중 시료의 무게를 측정하여 기록하였다.
통계분석
상이한 시비조건에서 온도 처리에 대한 토양 효소 활성도 차이를 분석하기 위해 IBM SPSS Statistics 27 (IBM Corp., Armonk, New York, USA) 프로그램을 이용하여 유의확률 95% 수준으로 통계분석을 실시하였다. 시비-온도-시기 세 가지 요인에 대한 유의성은 삼원 분산분석 (ANOVA)로 검증하였으며, 통계량이 유의할 시 사후분석 (duncan’s multiple range test)을 통해 처리구별 차이에 대한 유의성을 검증하였다.
Results and Discussion
토양 온도와 수분 변화
재배기간 중 상이한 시비조건에서 토양 온도는 기온과 비슷한 양상이었고 (Fig. 1), 평균 토양 온도는 AT와 ET 각각 27.6°C와 30.1°C였다. 논 토양의 수분은 벼 생육기간 중 중간낙수 기간을 제외하고 포화상태였다. 재배기간 동안 평균 토양 수분함량은 AT에서 47.3 ± 0.2% (v/v), ET에서 46.3 ± 0.3%였다. 중간낙수 기간의 토양 수분함량은 감소하였는데, 해당 기간의 평균 토양 수분함량은 AT와 ET가 각각 40.4 ± 1.3%, 35.1 ± 1.8%로 ET의 수분함량이 AT에 비해 낮았다 (P < 0.001, Fig. 1c). 이는 기온 상승에 의해 증발산량이 증가하여 토양 수분 함량이 감소하였음을 보여준다 (Wang et al., 2014). 특히, OC 처리에서 온도상승에 의해 벼 바이오매스가 증가하여, 벼의 증발산량이 많아지고, 그 결과 중간낙수 기간 중 토양 수분함량이 더욱 낮아진 것으로 판단된다. 또한, 벼 수확기 물떼기 기간 동안의 평균 수분함량은 AT에서 48.5 ± 0.5%, ET에서 42.0 ± 1.0%로 중간낙수기에 비해 높았는데, 이는 중각낙수기 (8일)와 비교하여 수확기 (5일)의 물떼기 기간이 짧고 기온도 낮아 증발산에 의한 수분 감소량이 상대적으로 낮았기 때문이다.
벼 바이오매스
벼 지상부 총 바이오매스는 화학비료와 유기질 비료 및 퇴비 등 시비에 의해 증가하였고 (P < 0.001, Fig. 2), 온도상승에 의해 모든 시비 처리구에서 벼 바이오매스가 14 - 79% (평균 28%) 증가하였다 (P < 0.001, Fig. 2). 이는 온도 상승에 의해 벼의 분얼수가 증가하여 최종 지상부 바이오매스가 증가하기 때문이다 (Kim et al., 2011; Choi et al., 2013; Nam et al., 2013). 기온 상승 조건에서 시비 처리에 따른 벼 바이오매스 증가에 대한 연구는 많지 않은데, AT에서는 NI 대비 CF와 OC 처리에 의해 각각 93%와 102% 증가하였지만, ET에서는 CF와 OC에서의 증가율이 각각 26%와 29% (P = 0.004)로 상대적으로 낮았다. 이는 기온 상승 조건에서는 시비 효과보다는 기온 상승에 의한 벼 생장 증진 효과가 더 크다는 것을 의미한다.
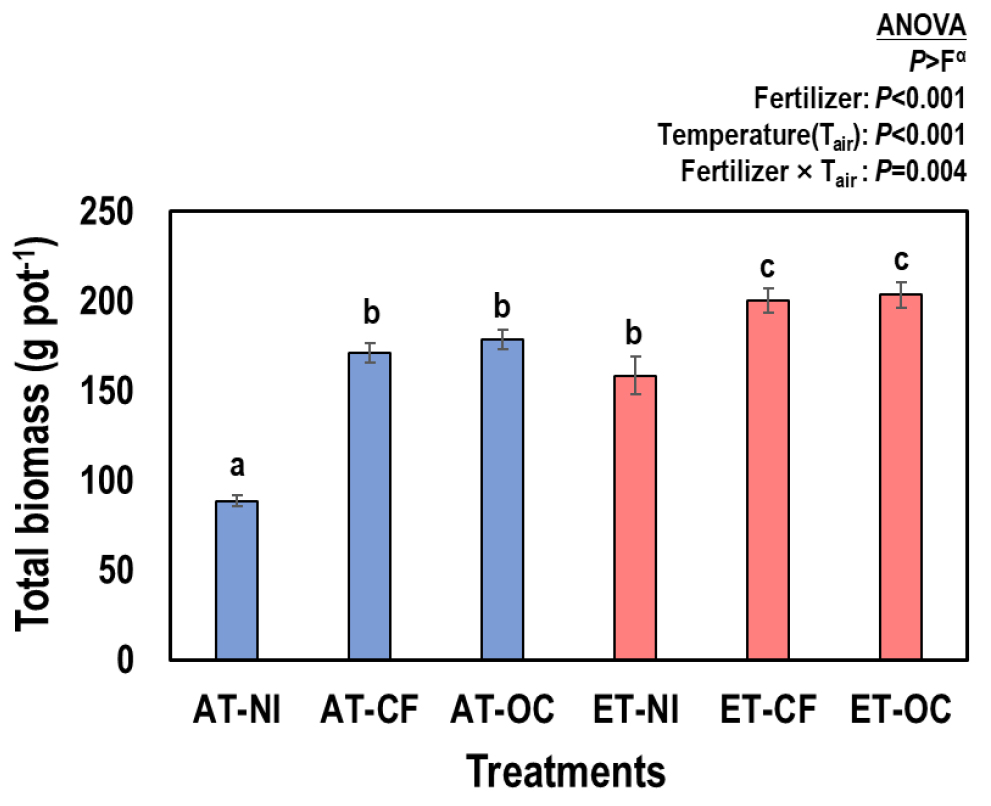
Fig. 2.
Total above-ground biomass of rice as affected by different fertilization with no input (NI), chemical fertilizer (CF), and organic fertilizer and livestock manure compost (OC) under ambient (AT) and elevated air temperature (ET). Values are the means of triplicate, and standard errors are depicted with the vertical bars. Different letters indicate that the values are statistically different at α = 0.05.
벼 지상부 바이오매스 증가는 뿌리 바이오매스 증가와 직접적으로 연관되기 때문에 AT에 비해 ET의 벼 뿌리 바이오매스가 더 많은 것으로 추정된다 (Kim et al., 2011; Nam et al., 2013). 본 연구와 동일한 조건에서 화학비료를 시비한 후 수행한 Kim et al. (2011)의 연구에 의하면, 벼 뿌리 바이오매스는 지상부 바이오매스와 선형관계가 있었다. 또한 기온 상승에 의해 영화 불임률이 증가하여 광합성 산물의 지하부 이동도 같이 증가하기 때문에 ET에서 미생물 기질 공급량이 증가하여 효소 활성도 높아질 것으로 예상되었다.
토양효소 활성 변화
토양 효소의 활성도는 시비, 온도, 생육시기에 의해 영향을 받았는데, 그 정도는 효소 종류에 따라 상이하였다 (Table 2). 연구 가설과 달리, 시비 영향은 NAG에서만 나타났는데 (P = 0.040), 정상 온도 조건에서 OC 처리구에서 다른 처리구에 비해 증가하였다 (Fig. 3). 이와 같은 연구 결과는 벼 생장에 차이가 없다면, 관행 화학비료 시비보다는 유기물 투입 조건에서 대부분의 토양 효소 활성이 높아진다는 연구 결과와 상이하다 (Liang et al., 2003). 하지만, 본 연구 결과는 유기물 투입에 의해서 탄소 유효도가 증가하여 부족한 질소를 가용화하기 위해 NAG 효소 활성이 높아짐을 보여준다 (Zeglin et al., 2013). Moeskops et al. (2010)의 연구에서도 유기물 투입에 의해 화학비료 시비 처리구에 비해 NAG 활성이 1.7 - 4.9배 증가하였다. 반면, García-Ruiz et al. (2009)의 연구에 의하면 분뇨와 같은 유기물 투입에 의해 화학비료 시비구 보다 BG와 AP 활성도 증가하였기 때문에 시비 처리에 의한 토양 효소 활성 변화에 대한 추가 연구가 필요한 것으로 판단된다. 본 연구는 시비뿐만 아니라 온도도 상이한 조건에서 실험을 수행하였기 때문에 온도 변화에 의한 효소 활성 변화에 의해 시비처리의 영향이 일부 상쇄되었을 수도 있다.
Table 2.
The P-values (>F) of β-1,4-glucosidase (BG), β-1,4-N-acetylglucosaminidase (NAG), and acid phosphatase (AP) activities of soils collected in the middle season drainage and after the rice harvest as affected by different fertilization under ambient and elevated air temperature (Tair).
한편, 온도 영향은 BG (P < 0.001)와 NAG (P = 0.002)에서 나타났는데, 온도 상승에 의해 이들 효소 활성이 낮아졌다 (Fig. 3). 이 결과는 열역학적 관점에서 일반적으로 보고되고 있는 온도와 효소 활성의 정 (+)의 상관관계와 상반된 결과이다 (Stone et al., 2012; Nottingham et al., 2016; Razavi et al., 2017). 하지만, 이와 같은 온도 상승의 효소 활성에 대한 영향은 앞에서도 언급한 바와 같이 기질 유효도와 수분 스트레스 등 다양한 요인에 영향을 받는다 (Davidson et al., 2006; Qi et al., 2016). 특히, 온도 상승에 의해 증발산량이 증가하고, 그 결과 토양 수분 함량이 감소하면 기질의 확산 속도가 감소하여 효소 활성이 낮아질 수 있다 (Ge et al., 2017). 이와 같은 이유로 다수의 연구에서 기질의 유효도가 낮을 경우에 온도 상승에 의한 효소 활성 증가가 나타나지 않는다고 보고되고 있다 (Berry and Raison, 1981; Davidson et al., 2006; Razavi et al., 2015). 한편, 인 가용화와 관련된 AP 효소 활성은 온도에 영향을 받지 않았는데 (Table 2), 인 가용화 효소는 다른 효소와 달리 토양 pH와 토성 등의 요인에 의해 매우 가변적인 것으로 보고되고 있다 (Shackle et al., 2000; Saha et al., 2008; Sinsabaugh, 2010).
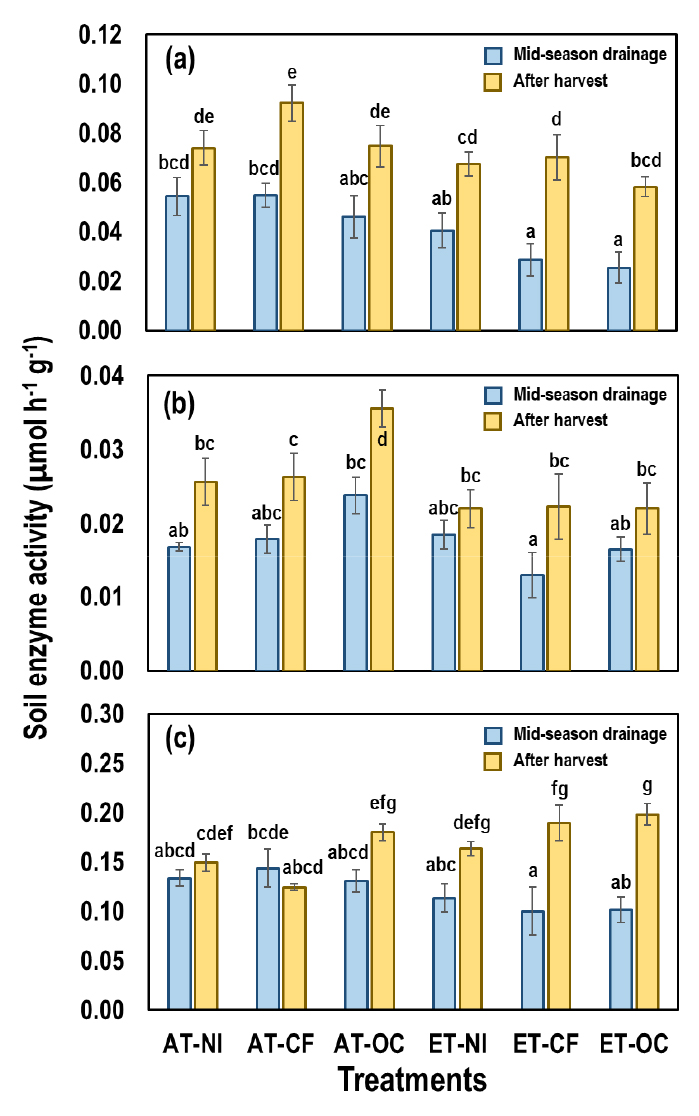
Fig. 3.
Changes in the enzyme activities of soils, at the middle season drainage and after the harvest, fertilized with no input (NI), chemical fertilizer (CF), and organic fertilizer and livestock manure compost (OC) under ambient (AT) and elevated (ET) air temperature: (a) β-1,4-glucosidase, (b) β-1,4-N-acetylglucosaminidase, and (c) acid phosphatase. Values are the means of triplicate, and standard errors are depicted with the vertical bars. Different letters indicate that the values are statistically different at α=0.05.
시비와 온도와 달리, 생육시기에 따른 효소 활성 차이는 모든 효소에서 일관되게 나타났다. 즉, 상이한 시비와 온도 조건에서 중간낙수기에 비해 벼 수확기의 BG, NAG, AP 효소 활성이 각각 36 - 129%, 19 - 52%, 12 - 95% 높았다 (P < 0.001). 이는 벼 생육 후반기 바이오매스 증가와 직접 관련된 것으로 판단된다. 즉, 벼 생장이 증가할수록 총 바이오매스 (지상부, 지하부)가 증가하며 뿌리 삼출물 등 기질공급량이 증가하여 (Kim et al., 2011) 미생물과 효소 활성에 유리하다 (Nannipieri et al., 1983; Liang et al., 2003). 식물 광합성 산물의 약 20% 정도가 뿌리를 통해 토양으로 방출되는 것으로 보고된다 (Hinsinger et al., 2006; Badri and Vivanco, 2009; Fischer et al., 2010). 또한, 벼 생장 초기에는 뿌리를 통해 주로 유기산이 방출되지만, 생육 후반기에는 미생물 대사 효율이 더 높은 당류가 방출되어 효소 활성에 더 유리하다 (Aulakh et al., 2001). 한편, 토양 효소는 미생물은 물론 식물 뿌리에 의해서도 방출되기 때문에 벼 바이오매스 증가는 기질 공급을 통한 미생물 생장 촉진 (Kuzyakov and Domanski, 2000)과 뿌리를 통한 효소 직접 방출 (Asmar et al., 1994)을 통해 토양 효소 활성을 증가시킬 수 있다 (Ge et al., 2017).
한편, 벼 수확기 (9월 말)와 중간낙수기 (7월 중순)의 토양 수분 함량 차이도 효소 활성에 영향을 줄 수 있다. 즉, 상대적으로 기온이 높은 (Fig. 1a) 중간 낙수기에는 증발산량이 많아서 수분함량이 빠른 속도로 낮아졌고 (Fig. 1c), 그 결과 토양 용액을 통한 기질의 확산 속도가 느려져서 효소 활성이 낮아진 것으로 판단된다 (Allison and Treseder, 2008). 이에 반해 벼 수확기는 상대적으로 기온이 낮아 (Fig. 1a) 중간낙수기에 비해 토양 수분함량이 높았고 (Fig. 1c), 그 결과 효소 활성이 상대적으로 높은 것으로 해석된다 (Steinweg et al., 2012; Zuccarini et al., 2020).
한편, AP 활성 변화는 온도와 시기의 상호작용 (P < 0.001)에 의해 영향을 받았는데, 중간낙수 기간의 AP 활성은 AT에 비해 ET에서 낮아서 BG와 NAG와 유사한 경향이었지만, 벼 수확기에서는 반대로 ET에서 증가하였다. AP 활성은 온도 상승과 그에 동반되는 토양 수분 함량 감소에 의해 매우 복합적으로 영향을 받는 것으로 알려져 있어 본 연구 결과를 명확하게 해석하기에는 어려움이 있다 (Sardans et al., 2006).
Conclusions
토양 효소 활성은 시비, 온도, 그리고 벼 생육 시기에 따라 다양하게 반응하였는데, 본 연구에서는 벼 생육 시기에 따른 효소 활성 변화가 가장 일관되게 나타났다. 시비 처리에 상관없이 온도 상승에 의해 BG와 NAG 활성이 감소하여 유기질 비료와 퇴비 처리에 의한 효소 활성 증가가 상쇄된 것으로 판단된다. 이와 같은 온도 상승에 의한 효소 활성 감소는 기존의 이론과 상반되는데, 벼 재배 기간 동안 토양 효소 활성을 조사한 본 연구에서는 기존 연구와 달리 온도 상승의 단독 효과보다는 온도 상승에 따른 토양 수분 함량 감소와 그에 수반되는 기질의 확산 감소가 토양 효소 활성에 더 크게 영향을 주는 것으로 나타났다. 이와 같은 토양 수분의 영향은 중간낙수기보다 벼 수확기에서의 효소 활성 증가에 의해서도 확인되었다. 따라서, 온난화 조건에서 효소 활성을 통한 토양 양분 공급을 위해서는 시비 관리 보다는 토양 수분 관리가 더 중요한 것으로 나타났다.





