Introduction
Materials and Methods
토양에서 PGPR 분리
분리 세균의 항진균활성
선발 균주 동정
분리 세균의 생장 촉진 특성 평가
Results and Discussion
분리 세균 항진균활성 PGPR
선발 균주 동정 결과
질소고정능
인산 가용화
Siderophore
IAA
포장검정
Conclusions
Introduction
토양 속에 존재하는 미생물은 생태계 내에서 중요한 역할을 하며, 유용 미생물은 농업 생산성과 환경 지속 가능성에 큰 영향을 미친다 (Hayat et al., 2010). 이러한 미생물 자원의 발굴 및 활용은 식물 성장 촉진, 병원균 억제, 토양 건강 증진 등 다양한 이점을 제공할 수 있으며, 특히 지속 가능한 농업을 위해 중요한 역할을 한다. 따라서 미생물 자원의 발굴과 그 활용 방안에 대한 연구는 앞으로의 농업 기술 발전에 있어 필수적이다.
최근 환경 문제의 심각성이 대두되면서 친환경 농업 기술 개발이 시급한 과제로 떠오르고 있다. 소비자들은 농산물의 안전성에 대한 관심이 높아지고 있으며, 이를 충족시키기 위해 화학비료와 농약 사용을 줄이고 천연 자원을 활용한 농업 방법이 강조되고 있다. 또한, 농업 분야에서 탄소 감축의 필요성이 커짐에 따라 온실가스 배출을 줄이기 위한 노력이 활발히 이루어지고 있다. 이에 따라 화학비료와 농약 사용을 절감하고 지속 가능한 농업을 구현할 수 있는 대안으로 유용 미생물을 활용한 친환경 농업 기술이 주목받고 있다.
식물 생육 촉진 근권 세균 (plant growth-promoting rhizobacteria, PGPR)은 식물 뿌리 주변에서 공생하며, 식물 생장과 발달에 중요한 역할을 하는 미생물이다 (Bhattacharyya and Jha, 2012). PGPR은 질소고정, 인산 가용화, 식물 호르몬 생산 (Glick, 1995), 항생물질 분비, 그리고 환경 스트레스 저항성 (Mendes et al., 2013) 향상과 같은 다양한 기능을 통해 식물의 생산성을 높이고, 화학 비료 및 농약 사용을 줄일 수 있다 (Vessey, 2003). 이에 따라 PGPR은 지속 가능한 농업을 위한 중요한 자원으로 주목받고 있다.
PGPR은 농업에서 중요한 자원으로, 다양한 기작을 통해 식물의 생장과 발달을 촉진한다. 질소고정, 인산 가용화, 호르몬 생산, 항생물질 분비, 그리고 스트레스 저항성 향상과 같은 기능을 통해 PGPR은 화학 비료 및 농약 사용을 줄이고, 지속 가능한 농업 실현에 기여할 수 있다.
본 연구의 목적은 1) 토양에서 질소고정, 인산 가용화, IAA, 항균 활성 등의 기능성 검정을 통해 PGPR을 분리하고, 2) 분리된 미생물을 선발 및 동정하고 3) 효과검정하는 데 있다. 이러한 연구는 농업 환경에서 활용 가능한 유익한 미생물 자원을 발굴하고, 이를 통해 토양 질과 작물 생산성 향상에 기여할 것이라고 사료된다.
Materials and Methods
토양에서 PGPR 분리
PGPR 분리를 위해 전라남도 강진군에 위치하는 배 농가 등 25곳의 토양시료를 15 cm 깊이에서 채취하여 토양 시료 1 g을 멸균 식염수 9 ml에 단계희석하여 105까지 희석하였다. 희석한 용액 100 µl를 Luria-Bertani (LB, Difco, USA) 한천 배지에 분주하여 도말 후 30°C에서 24시간 배양하고, 색과 형태가 다른 세균을 1차 순수 분리하여 50% glycerol에 현탁 하여 -70°C에 보존한 후 본 연구에 사용하였다.
분리 세균의 항진균활성
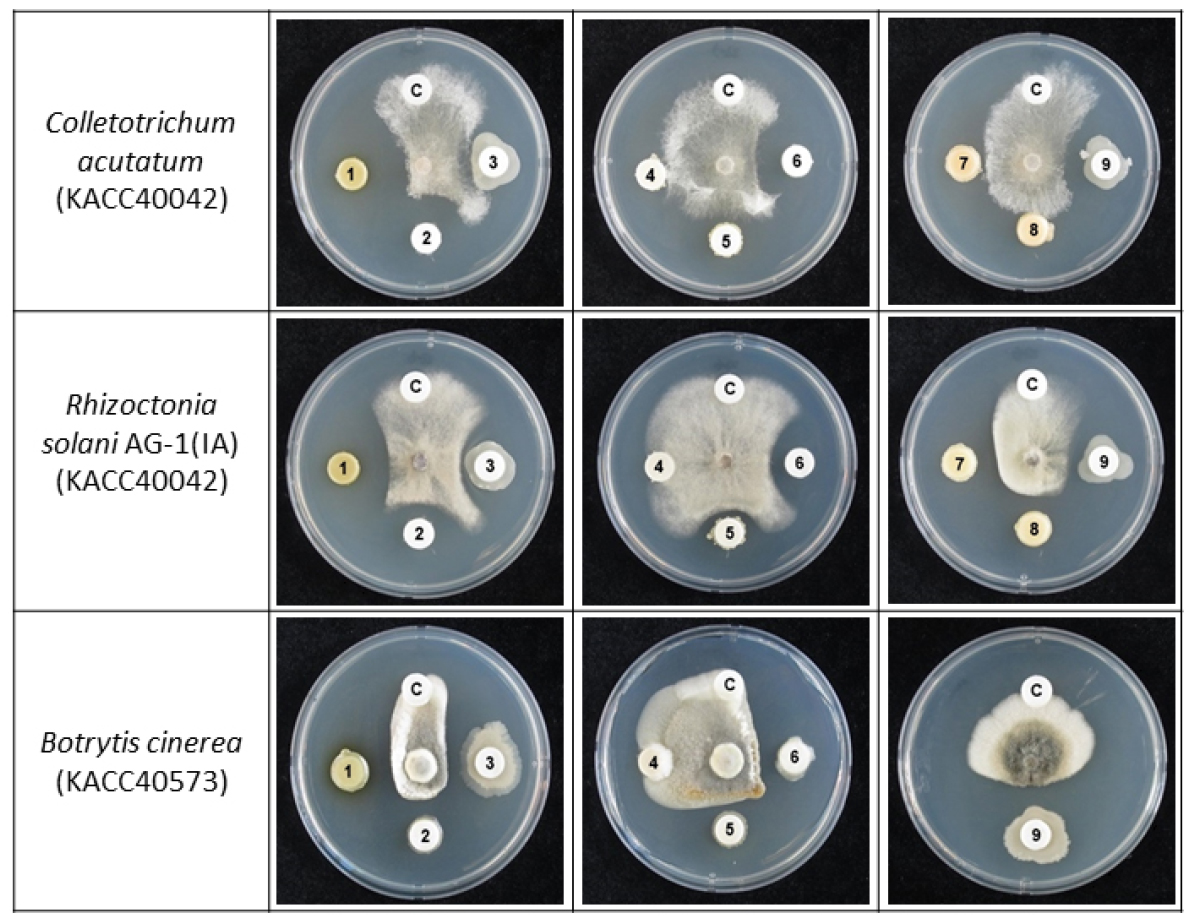
분리한 세균의 항진균활성을 조사하기 위해 벼 잎집무늬마름병을 일으키는 Rhizoctonia solani AG-1 (KACC40101), 장미 잿빛곰팡이병을 일으키는 Botrytis cinerea (KACC40573), 고추 탄저병을 일으키는 Colletotrichum acutatum (KACC40042), 고추 역병을 일으키는 Phytophthora capsici (KACC40483), 곰팡이 4종을 국립농업과학원 씨앗은행 (KACC)에서 분양 받아 사용하였다. 항균 활성 시험을 위해 paper disc법을 이용하여 생장 억제율을 조사하였다. PDA (potato dextrose agar) 중앙에 R. solani AG-1, B. cinerea, C. acutatum, P. capsici 균사 절편을 직경 0.5 mm borer를 이용해 잘라 접종하고 이로부터 2.5 cm 떨어진 곳에 멸균된 paper disc (advantec, 10 mm, lot.71010691)를 올려놓고 분리한 균주를 TSB에 28°C로 48시간동안 배양하여 생균수를 106 cfu/ml 농도로 조정하여 65 µl 접종하였다. 25°C에서 3일간 배양한 후 disc 주위의 균사 생장 억제 정도 (inhibition zone)를 조사하여 균사 생장 억제율을 조사 후 2차로 균주를 선발하여 벼 잎집무늬마름병, 장미 잿빛곰팡이병원균, 고추 탄저병균에 대한 항진균활성을 재조사하였다.
T : test species growth of mycelium, C : control growth of mycelium
선발 균주 동정
항진균 및 생장 촉진 활성이 있는 균주를 선발 후 동정하기 위하여 16S rRNA 유전자 염기서열을 분석하였다. 27F (5’-AGAGTT TGATCCTGGCTCAG-3’)와 1492R (5’-GGTTACCTTGTTACGACT T-3’) primer set을 사용하여 PCR 증폭을 진행하였고, 증폭된 산물의 염기서열 정보는 솔젠트㈜ (Korea)에 의뢰하여 확보하였다. 1차 선발한 9개 균주의 정보를 파악하기 위하여 확보한 염기서열을 NCBI (https://www.ncbi.nlm.nih.gov/)에서 BLASTN 프로그램 (ver.2.12.0+)을 이용하여 16S ribosomal RNA sequences (bacteria and archaea) 데이터베이스에서 등록된 염기서열과 비교하였다.
분리 세균의 생장 촉진 특성 평가
질소고정능
분리한 세균의 질소고정능을 조사하기 위해 질소원이 결핍된 NFB (nitrogen free bromothymol blue) 배지에 미리 배양한 균주의 단일 균총을 따서 배지의 2/3 되는 깊이에 접종하여 30°C에서 7일간 배양 후 배지가 푸른색으로 변한 경우를 양성으로 판정하였다. 변색 정도에 따라 -, +, ++, +++, +++로 구분하여 조사하였다.
인산 가용화
Pikovskaya (1948) 방법에 따라 분리한 균주의 인산가용화를 조사하였다. 준비한 Pikovskaya 배지에 분리한 균주를 접종하고 30°C에서 7일간 배양 후, 콜로니 주위에 생성된 투명환의 형성 여부를 관찰하여 TCP 가용화 능력을 Nguyen et al. (1992)에 따라 계산하였다.
Siderophore 생성능
분리한 세균의 Siderophore 생성 유무를 조사하기 위해 chrome azurol S (CAS) blue agar plate assay 방법 (Schwyn and Neilands, 1987)을 응용하였다. CAS 평판 배지에 분리한 균주를 접종하여 30°C에서 7일간 배양 후 콜로니 주변에 orange halo zone 형성 유무를 조사하였다.
IAA 생성능
Gordon and Weber (1951)의 방법을 응용하여 분리한 세균의 IAA 생성여부를 확인하였다. DF minimal salts media에 균총을 접종한 후 암 조건이 되도록 호일로 싼 후 30°C에서 7일간 150 rpm으로 진탕 배양한다. 배양 후 배양액을 15 ml falcon tube에 담아 8,000 rpm에서 15분간 원심분리 후 상등액 2 ml를 10 mM orthophosphoric acid 100 µl, Salkovasky reagent 4 ml를 넣고 실온에서 25분간 반응시킨 후 색상이 분홍색으로 발현되면 UV-vis spectrophotometer (Lambda25, Perkin Elmer corporation, USA)를 이용하여 530 nm에서 흡광도를 측정하였다. 농도 별 IAA 표준 용액으로 standard curve를 산출한 다음 배양 결과 얻어진 OD 값을 산출 식에 대입하여 auxin 생성량을 측정하였다.
포장검정 IAA
생성량이 가장 높은 AB22-1 균주의 식물 생장 촉진 효과를 확인하기 위해 온실에서 포장 검정을 실험을 실시하였다. 상추 (청치마)는 비가림하우스에 20 cm 간격으로 정식하였고, 정식 전 유묘 상태일 때, 정식기, 정식 2주 후에 AB22-1 105 - 107 cfu/ml 농도의 배양액을 각 1회씩 관주 처리하였다. 10월 23일에 일시 수확하여 농업과학기술 연구조사분석기준 (NIAST, 2018)에 따라 생육 특성을 조사하였다. 처리 별 평균값 차이에 의한 유의성 검정은 xlstat 프로그램 (version 2023.2.1413)을 이용하여 ANOVA 분석을 실시하였으며 Duncan’s Multiple Range Test (DMRT) 방법으로 95% (p < 0.05) 신뢰수준에서 통계적 검정을 수행하였다.
Results and Discussion
분리 세균 항진균활성 PGPR
분리를 위해 채취한 토양을 단계 희석하여 LB 한천 배지에 배양한 결과 색과 형태가 전혀 다른 26종의 세균을 1차 순수 분리하였다. 1차로 선발된 26개의 균주를 이용하여 벼 잎집무늬마름병원균, 장미 잿빛곰팡이병원균, 고추 탄저병균, 고추 역병균에 대한 항균효과를 확인하였고, 그 결과 28개의 균주 중 9개의 균주가 3개 이상의 병원성 곰팡이에 대하여 항진균활성이 있음을 확인하였다 (data not shown). 항진균 활성이 있는 9개의 균주를 대상으로 벼 잎집무늬마름병원균, 장미 잿빛곰팡이병원균, 고추 탄저병균 곰팡이 3종에 대하여 항진균활성을 재조사한 결과, CH22-3과 AB22-1 균주의 항진균활성이 가장 뛰어난 것을 확인하였다 (Table 1, Fig. 1).
Table 1.
Inhibition rate of mycelial growth of plant pathogenic fungi by isolated bacteria.
선발 균주 동정 결과
식물병원성곰팡이에 항진균활성 효과가 있는 9개의 균주를 일차 분리 선발하여, 16S rRNA 유전자 염기서열 분석과 NCBI Genbank System을 이용하여 염기서열을 확인한 결과, 분리균은 Bacillus, Burkholderia, Paenibacillus, Pseudomonas 등으로 동정 되었다 (Table 2). Pseudomonas corrugata는 식물 병 억제 능력이 있어 생물학적 방제제로서 보고된 바 있으나 (Guo et al., 2007; Sang and Kim, 2014; Strano et al., 2017), 주로 토마토 줄기 속 썩음병을 유발하는 병원균으로 알려져 있어 PS22-3과 PS22-6 균주는 기능성 검정에서 제외하였다.
Table 2.
Bacterial identification results.
질소고정능
질소는 식물의 성장과 생산성에 중요한 역할을 하나 대기 중 질소의 78%가 식물이 직접적으로 사용할 수 없는 N2로 존재하는데 질소고정 미생물은 공기 중 질소를 NH3로 변환하여 식물이 이용할 수 있게 한다고 알려져 있고 (Bhattacharyya and Jha, 2012; Glick, 1995), Bashan and De-Bashan (2010)의 연구에 따르면, 질소고정 미생물은 비료의 사용을 최대 30%까지 줄이면서도 수확량을 유지할 수 있는 중요한 농업적 자원이라고 보고된 바 있다. 따라서 항진균활성이 있는 9개의 균주 중 유해세균을 제외한 7개의 균주를 대상으로 질소고정능력을 조사한 결과, 모든 균주가 질소고정능력을 보였고 그 중 CH22-3과 CH22-6, PH22-6, PH22-9, AB22-1 5개 균주가 높은 활성을 나타내었다 (Fig. 2).
인산 가용화
토양에 존재하는 대부분의 인산은 식물이 바로 이용할 수 없는 형태로 존재하며, 이는 작물 생육에 필요한 인산의 공급을 제한하는 주요 요인 중 하나이다. 이러한 문제를 해결하기 위해 인산 가용화 미생물 (phosphate-sulubilizing microorganisms, PSM)이 주목받고 있는데 Vessey (2003)에 따르면, PSM은 식물에 이용 가능한 형태로 인산을 변환하여 토양의 인산 가용성을 높이는 데 중요한 역할을 하는 것으로 알려져 있다. 또한 Bashan and De-Bashan (2010)은 PSM이 질소 고정 세균과 함께 사용될 때 작물의 생장과 수확량을 크게 향상시킬 수 있음을 보고하였으며, 이러한 연구 결과는 농업에서 인산 가용화 미생물의 활용이 토양 비옥도와 작물 생산성에 긍정적인 영향을 미칠 수 있음을 시사한다. 분리한 균주의 인산 가용화능을 평가하기 위해 불용성 인산인 Ca3(PO4)2이 첨가된 배지에 선발한 7개의 균주를 접종하여 배양한 결과, 불용성 인산으로 인해 불투명한 배지에 투명환을 형성하는 균주들을 확인할 수 있었다. 투명환의 뚜렷함과 직경을 기준으로 살펴볼 때, 7개의 균주 중, 4개의 균주가 투명환이 나타났고 CH22-3 균주의 TCP (%)가 135.6%로 가장 높았다 (Table 3).
Table 3.
Solubilization of insoluble phosphate by isolated bacteria.
| Strain | TCP (%) |
| CH22-3 | 135.6 |
| CH22-4 | 129.9 |
| CH22-6 | 100.0 |
| PH22-6 | 124.3 |
| PH22-9 | 117.5 |
| PS22-1 | 100.0 |
| AB22-1 | 100.0 |
Siderophore
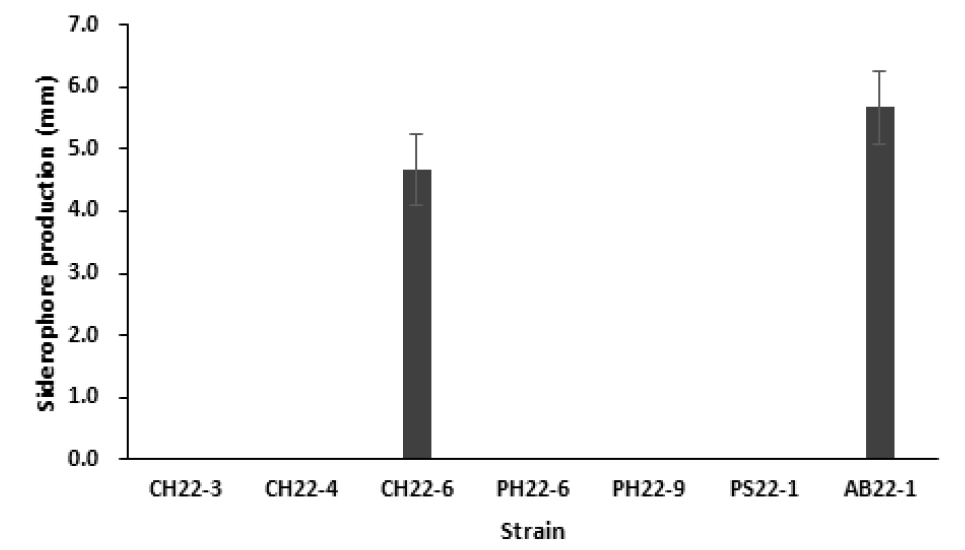
선발한 균주를 CAS 평판 배지에 접종하여 CAS-HDTMA에 결합된 Fe 이온이 siderophore에 의해 제거되면서 발생하는 배지의 색 변화를 통해 siderophore 생성능을 확인한 결과, CH22-6과 AB22-1 2개 균주가 siderophore를 생성하였다 (Fig. 3).
IAA
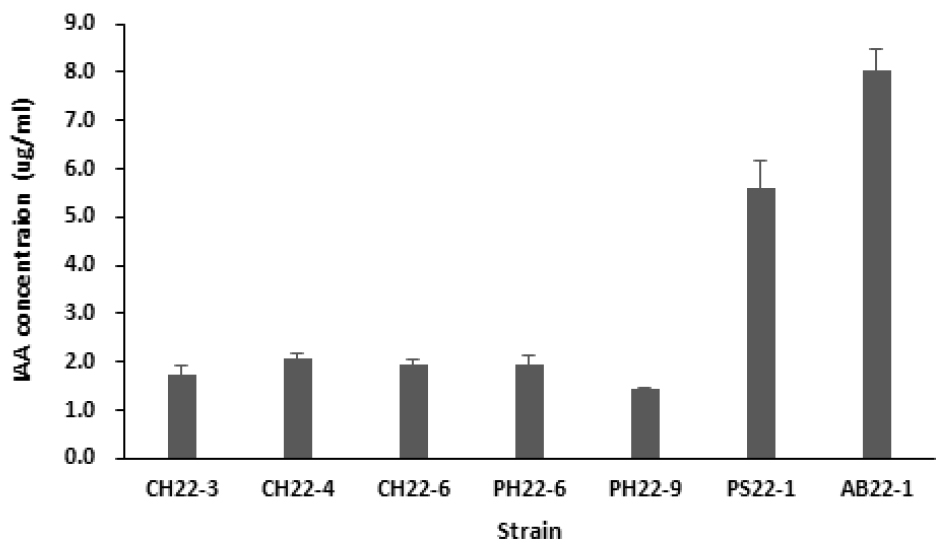
옥신 (Indole-3-acetic acid, IAA)은 식물 생장과 발달을 조절하는 필수적인 호르몬으로 특히 뿌리 생장, 세포 분열, 그리고 조직 분화에 관여한다. Spaepen et al. (2007)에 따르면, 식물생장촉진미생물은 IAA를 분비하여 뿌리의 세포 분열과 신장을 유도함으로써 식물의 뿌리 체계를 확장시키며, 특히 Pseudomonas와 Azospirillum과 같은 PGPR은 IAA를 생성하여 식물과 상호작용하며 이는 식물의 생장과 수확량을 높이는 데 중요한 기여를 했다고 보고되었다 (Glick, 1995). 선발한 균주의 IAA 생성량을 조사한 결과, AB22-1 균주의 IAA 생성량이 8.04 µg ‧ ml-1로 가장 우수하였다 (Fig. 4).
포장검정
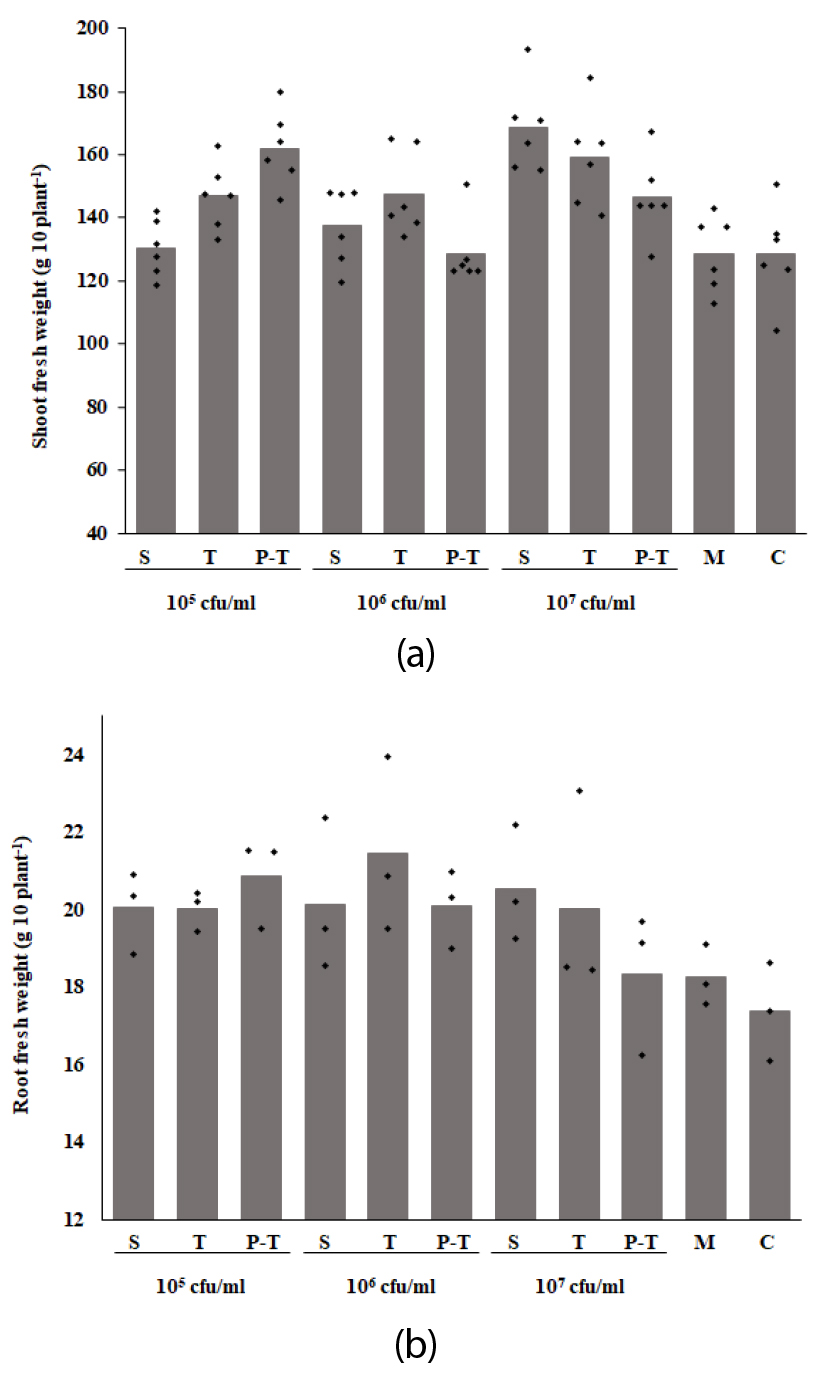
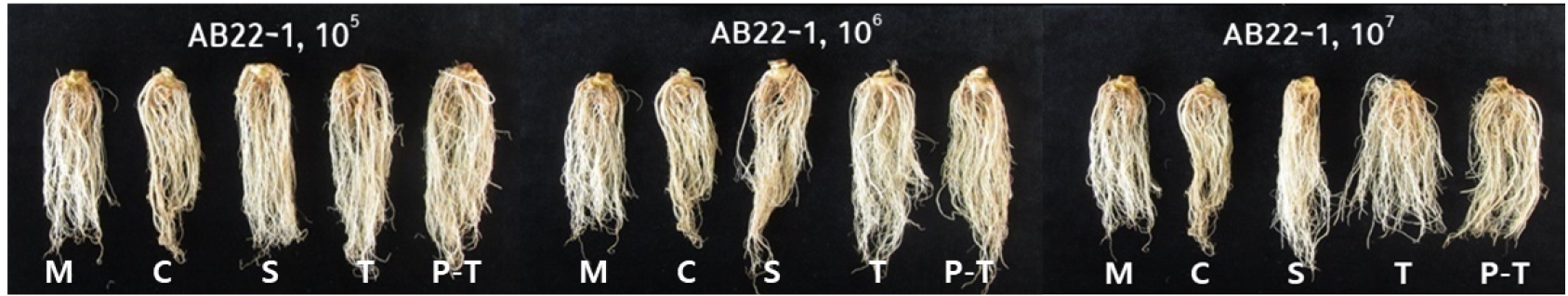
AB22-1의 식물 생장 촉진 효과를 검정하기 위해 상추 정식 전후로 AB22-1 배양액 (1×105 - 1×107 cfu/ml)을 각 1회씩 처리하고, 한달 후 생육특성을 조사한 결과, 무처리와 배지 처리 군에 비해 AB22-1배양액 모든 처리농도에서 엽장, 엽폭, 엽수, 생체중 및 엽색도가 증대되었다 (Table 4). 특히, 1×105 cfu/ml 농도로 정식 후에 처리 또는 1×107 cfu/ml 농도로 육묘기에 처리했을 때 지상부 생체중이 162.0 g 10 plant-1, 168.4 g 10 plant-1로 무처리 대비 26 - 31% 증가하였다 (Table 4, Fig. 5A). 지하부 생체중 또한 무처리 대비 18 - 20% 증가하였다 (Fig. 5B, Fig. 6) AB22-1 균주는 조사한 식물 생육 촉진 활성 중 Siderophore, IAA 생성, 질소고정효과가 높았는데 이러한 활성들이 상추의 생육을 촉진하는데 도움을 준 것으로 사료된다. Choi et al. (2022)에 의하면 B. amyloliquefaciens ISP-5 균주 배양액을 125배, 250배로 상추에 처리하여 생육특성을 조사한 결과, 무처리 대비 생체중이 16.3 - 24.2% 증대되었는데 AB22-1 균주는 105 cfu/ml 더 낮은 농도로 26% 정도 생체중을 증대시켰다. 또한 질소고정, 불용성 칼슘 및 인산 가용화 IAA 생성능을 가진 WS-10 균주를 처리했을 때 토양의 화학성과 담배 뿌리, 줄기, 엽의 건물 함량이 유의미하게 증가하였다고 보고하였다 (Ahmed et al., 2022).
Table 4.
Growth characteristics of lettuce treated with B. amyloliquefaciens AB22-1.
| Treatment |
Leaf length (cm) |
Leaf width (cm) |
Number of leaves (per plant) |
Fresh weight (per 10 plant) |
Chlorophll (SPAD) | |||
| Shoot | Root | |||||||
|
AB22-1 culture | 105 | Seedling | 21.8 bcd1 | 17.0 bc | 12.8 ab | 130.3 c | 20.0 a | 32.0 a |
| Transplanting | 22.4 abcd | 18.0 ab | 12.3 ab | 146.8 abc | 20.0 a | 31.5 a | ||
| Post-transplanting | 23.3 ab | 18.4 ab | 13.5 ab | 162.0 a | 20.9 a | 31.1 a | ||
| 106 | Seedling | 21.9 bcd | 18.1 ab | 12.7 ab | 137.3 bc | 20.1 a | 33.2 a | |
| Transplanting | 22.1 abcd | 17.9 ab | 13.7 a | 147.5 abc | 21.4 a | 30.6 a | ||
| Post-transplanting | 21.0 d | 17.9 ab | 12.5 ab | 128.6 c | 20.1 a | 33.6 a | ||
| 107 | Seedling | 23.6 ab | 18.0 ab | 13.8 a | 168.4 a | 20.5 a | 31.7 a | |
| Transplanting | 23.8 a | 18.7 a | 14.0 a | 159.0 ab | 20.0 a | 30.6 a | ||
| Post-transplanting | 23.3 ab | 17.3 abc | 13.0 ab | 146.3 abc | 18.4 a | 30.8 a | ||
| Media (LB broth) | 22.9 abc | 17.8 ab | 11.5 b | 128.6 c | 18.2 a | 28.8 a | ||
| control | 21.3 cd | 16.0 c | 12.0 ab | 128.5 c | 17.4 a | 29.8 a | ||
본 연구결과에서도 B. amyloliquefaciens AB22-1 배양액을 처리했을 때 상추의 생육이 크게 촉진된 것을 확인하였고, 이러한 결과는 AB22-1의 농업분야에서 생물 비료로서의 가능성을 보여주며 차후 화학비료와 비교하여 추가적인 연구가 필요할 것으로 판단된다.
Conclusions
농업환경 분야에서 활용 가능한 유용한 미생물 자원을 발굴하기 위해 토양으로부터 색과 형태가 다른 미생물을 분리한 결과 26종의 세균이 분리가 되었다. 분리된 세균의 식물 병원성 곰팡이 3종에 대한 항진균활성을 검증한 결과, CH22-3 (Burkholderia ambifaria), CH22-4 (Paenibacillus polymyxa), PH22-6 (Pseudomonas poae), PH22-9 (Burkholderia stabilis), PS22-1 (Paenibacillus polymyxa), AB22-1 (Bacillus amyloliquefaciens) 7개의 균주가 항진균활성을 보였고, 그 중에서도 CH22-3, AB22-1 2개 균주가 가장 강한 항진균활성을 보였다. 식물 생육 촉진 활성을 검증하기 위해 항진균활성을 보인 7개의 균주를 대상으로 질소고정, 인산 가용화, IAA 생성, siderophore 생성능을 조사하였다. 조사 결과 7개 모든 균주가 질소고정능력을 가지고 있었고, 인산가용화능은 CH22-3 균주가 135.6%로 가장 높았다. IAA 는 AB22-1 균주가 8.0 µg ml-1, PS22-1 균주가 5.6 µg ml-1 생산하였고, siderophore는 CH22-6과 AB22-1 균주가 halo zone이 4.7, 5.7 mm로 가장 많이 생성되었다. 질소고정, IAA, Siderophore 생성능이 가장 높았던 AB22-1 균주 배양액 (1×105 - 1×107 cfu/ml)을 상추에 처리하여 생육 특성을 조사한 결과, 무처리군과 비교하여 모든 처리농도에서 엽장, 엽폭, 엽수, 생체중 및 엽색도가 증대되었다. 특히, 1×105 cfu/ml 농도로 정식 후 처리 및 1×107 cfu/ml 농도로 육묘기 처리에서 무처리 대비 지상부 생체중이 26 - 31%, 지하부 생체중이 18 - 20% 증가하였다. 이러한 결과는 AB22-1의 생물 비료로서의 가능성을 보여주며 추후 화학비료와 비교하여 추가적인 연구가 필요할 것으로 판단된다.