Introduction
Materials and Methods
포트실험 및 개량제 처리
토양화학성 및 중금속 농도 분석
토양용액 분석
토양의 효소 활성 분석
벼의 비소 농도 분석 및 생육 조사
통계 분석
Results and Discussion
개량제 처리에 따른 토양용액과 벼의 비소 농도 및 벼 생육
개량제 처리 후 논토양의 효소 활성 변화
Conclusions
Introduction
생물체에서 생성되는 효소는 생화학 반응을 촉진하므로 토양 내 양분 순환에 기여하고 토양미생물 생태에서 중요한 역할을 한다 (Tejada et al., 2013; Majumder et al., 2022). 토양 효소의 활성은 토양 건강 (soil health)의 생물학적 지표로 광범위하게 사용되며 (Dick, 1997) 토양 생태계의 기능에 중요한 역할을 하므로 토양 오염의 지표로서 적합하다 (Ros et al., 2006; Tejada, 2009). Renella et al. (2005)은 기질 합성의 저하, 토양미생물의 세포 외 효소 방출, 또는 세포 외 효소의 저해 결과 금속으로 오염된 토양의 생물학적 특성이 감소할 수 있다고 하였으며, 중금속에 의한 토양 오염은 토양 효소의 활성과 토양미생물의 다양성에 부정적인 영향을 미친다 (Hinojosa et al., 2005). 또한, 중금속으로 오염된 토양에서는 영양분의 분해 및 무기화와 관련된 효소들 (phosphatase, arylsulfatase, β-glucosidase, urease 및 dehydrogenase)의 활성 저해가 일어난다 (Hinojosa et al., 2004). 반면에 토양의 생태 기능이 양호할수록 토양 효소의 활성은 증가한다 (Tyler, 1974).
비소 농도가 높은 담수 토양에 인산염을 처리하면 5가 무기비소 (AsO43-)가 치환되어 벼의 비소 농도가 증가한다 (Talukder et al., 2012; Mukhopadhyay et al., 2015). 또한, 인산염과 5가 무기비소가 식물 흡수에 대해 서로 경쟁할 경우 인산염 처리에 의해 식물체의 비소 농도는 감소하며 (Abedin et al., 2002; Tu and Ma, 2003), 결정질의 철 및 알루미늄 산화물이 풍부한 토양에 비소가 고정되거나 벼 뿌리에 형성된 철 피막 (iron plaque)에 비소가 격리되면 인산염과 5가 무기비소 간 흡수 경쟁이 일어나지 않기도 한다 (Lee et al., 2016). 비소로 오염된 토양에 칼슘과 인을 동시에 처리하면 Ca-phosphate-arsenate 미네랄을 형성할 수 있으며, 이 경우 비소의 이동성 감소를 유발한다 (Neupane and Donahoe, 2013). 따라서, 과인산석회 (calcium superphosphate)와 같이 칼슘과 인이 결합된 비료의 시용은 Ca-phosphate-arsenate 미네랄을 형성함으로써 인산으로 인한 비소의 유효도 증가를 상쇄함과 동시에 인산과 비소가 식물 흡수에 대해 서로 경쟁하게 한다 (Lee et al., 2016).
비소로 오염된 논토양에서 비소 안정화제로서의 황의 효과에 대한 연구 결과로는 황 처리 시 비소가 근권에 격리, 또는 비소의 지하부에서 지상부로의 이행 감소 (Hu et al., 2007; Fan et al., 2013; Dixit et al., 2015)를 통해 현미의 비소 농도는 낮아지게 되며, 과량의 황 처리 시 벼의 항산화 효소의 활성 증가로 비소의 독성은 감소한다 (Dixit et al., 2015). 황산나트륨 (Na2SO4)을 논토양에 처리하는 경우에도 공극수의 무기비소 농도와 비소의 벼 뿌리에서 지상부로의 이행이 감소하며 (Tang et al., 2020) 담수 환원 조건에서 황산염 환원 미생물에 의해 황화철 (FeS)이 생성되면 비소는 황화철과 침전하여 부동화 한다 (Burton et al., 2014).
인산질 비료 등 토양개량제를 이용한 중금속 오염 토양의 안정화에 관한 연구, 석회, 인산, red mud, 산화마그네슘을 이용한 사격장 토양의 안정화 과정에서 지렁이, 식물 및 토양미생물 활성에 미치는 생태독성에 관한 연구 (Sanderson et al., 2014), 석유계 총 탄화수소 (TPH)로 오염된 토양에서 토양 세척 및 경작에 따른 토양효소 활성의 변화 (Kim et al., 2022), 고추 재배 시 헤어리베치의 토양 혼입이 토양효소 활성에 미치는 영향 연구 (Yi et al., 2020) 등이 수행되었으나, 개량제를 이용한 비소 및 중금속 오염 토양의 안정화에 관한 연구에 비해 개량제 처리 후 토양 효소의 활성 변화에 관한 연구는 미미한 실정이다. 본 연구는 비소로 오염된 논토양에 개량제로 황 및 과인산석회를 처리할 경우 비소의 유효도 변화 및 토양 효소의 활성 변화로부터 개량제 처리의 효과를 간접적으로 파악하고 비소의 독성 변화를 평가하기 위한 생물학적 지표로서의 가능성을 검토하고자 수행하였다.
Materials and Methods
포트실험 및 개량제 처리
시험에 사용한 토양은 충남지역 폐금속 광산 인근의 논에서 채취하여 그늘에서 풍건 후 2 mm 체로 걸러 자갈을 제거하였다. 개량제로 황 및 과인산석회를 포트에 충진할 건조토양 400 g의 0.75%에 해당하는 양 (3 g)을 각 처리구별로 3반복으로 혼합 후 토양수분보유능 (water holding capacity, WHC)의 100%로 포화 조건이 되도록 1차 증류수를 가하고 1개월간 배양하였다.
비소 농도가 높은 토양에 인산 처리 시 벼의 비소 흡수를 줄이지 못하거나 추천 시용량의 10배량을 처리해도 오히려 비소의 독성이 가중될 수 있으므로 인산과 비소의 흡수 경쟁을 유발하려면 더 많은 양의 인산이 필요할 수 있다 (Lee et al., 2016). 본 연구에서는 인산 처리의 뚜렷한 효과를 보기 위해 논 10a의 표토 무게를 100 ton으로 가정하고 추천 시용량의 15배량에 해당하는 과인산석회의 혼합 비율로 0.75%를 산정하였다.
논 10a의 표토 무게를 100 ton으로 가정 시 황의 추천 시용량은 건조토양 400 g 기준으로 0.04 g (100 mg kg-1)에 해당한다. 토양에 30 - 120 mg kg-1의 농도로 황을 처리 시 벼의 비소 농도는 황의 처리량이 증가할수록 유의하게 감소하며 (Hu et al., 2007) 본 연구에서 황 처리의 목적은 비소 오염 토양의 개량인 점과 포트실험 조건임을 감안하여 황의 혼합 비율로 과인산석회와 동일한 0.75%를 산정하였다.
배양이 완료된 토양은 500 mL 용량의 플라스틱 소형 포트에 충진하고 토양 높이의 중앙부에 토양용액 채취기 (Rhizon Sampler, Rhizosphere, The Netherlands)를 설치하였다. 토양표면에서 2 cm 높이로 담수 후 파종 후 3주 간 육묘한 벼를 포트 당 1주 3본씩 이앙하고 시험이 종료되는 3개월 간 담수 상태를 유지하였다.
토양화학성 및 중금속 농도 분석
토양시료는 토양화학분석법 (NIAS, 2010)에 따라 pH (1:5), 전기전도도, 유기물 함량, 유효인산 및 총 질소 함량을 분석하였다. 토양의 중금속 총 함량은 토양오염공정시험기준 (MOE, 2010)에 따라 전처리 후 ICP-MS (7700, Agilent Technologies, Tokyo, Japan)로 분석하였다. 중금속 분석의 신뢰도를 검정하기 위해 토양 인증표준물질 (BAM U112a, Berlin, Germany)로 분석 정확도를 검정하였으며 정확도 80 - 120% 조건에서 분석을 수행하였다. 토양 중 가용성 비소의 분석 전처리는 100 mL 삼각플라스크에 토양 5 g을 칭량하여 1 N HCl을 25 mL을 넣고 30°C에서 30분 동안 진탕한 후 No. 5B 여과지 (Advantec, Japan)로 여과하고 그 여액을 분석시료로 사용하였다. 비소를 제외한 다른 중금속은 0.1 N HCl을 사용하여 1시간 동안 진탕한 후 동일한 방법으로 전처리 하였으며 (MOE, 1999), 기기분석에는 ICP-AES (PQ9000, Analytik Jena, Germany)를 이용하였다. 공시토양의 화학성 및 중금속 농도는 Table 1 및 Table 2와 같다.
Table 1.
Chemical properties of soil used in this study.
|
pH (1:5) |
EC† (dS m-1) |
Total C (%) | Exch. cations (cmolc kg-1) |
Total N (%) |
Avail. P2O5 (mg kg-1) | |||
| K | Ca | Mg | Na | |||||
| 7.04 | 0.95 | 0.9 | 0.08 | 8.1 | 1.4 | 0.1 | 0.08 | 255 |
Table 2.
Heavy metal(loid) concentration of soil used in this study.
토양용액 분석
Rhizon sampler에 20 mL 주사기를 연결하여 벼의 생육기간 중 최대분얼기, 유수형성기 및 등숙기 총 3회에 걸쳐 토양용액을 채취 후 비소의 농도를 분석하였으며 분석에는 ICP-AES (PQ9000, Analytik Jena, Germany)를 이용하였다.
토양의 효소 활성 분석
토양효소 분석용 시료는 1차로 벼 이앙 후 64일차 (유수형성기)에 채취하였고 2차 시료는 이앙 후 99일 (등숙기)에 1차와 5주 간격을 두고 채취하였으며 채취한 시료는 분석 전까지 냉장 보관하였다.
Dehydrogenase의 활성도는 Casida Jr et al. (1964)의 분석법을 참고하여 측정하였다. 토양 시료 20.0 g에 CaCO3를 0.2 g 혼합하여 그 중 6.0 g을 centrifuge tube에 넣은 후 3% 2,3,5-Triphyenyl tetrazolum chloride 1.0 mL와 초순수 2.5 mL를 첨가하여 혼합 후 밀봉하고 배양기를 이용하여 37°C에서 24시간 배양하였다. 10.0 mL의 Methanol을 혼합하여 여과한 후 UV/Vis Spectrophotometer (Uvmini -1240, Shimadzu, Kyoto, Japan)를 이용하여 485 nm 파장에서 비색 정량하였다.
β-glucosidase의 활성도는 Eivazi and Tabatabai (1988)의 분석법을 참고하여 측정하였다. 토양 시료 0.5 g을 centrifuge tube에 넣고 Toluene 0.1 mL, citric phosphate buffer (pH 4.9) 1.5 mL, 초순수 0.9 mL 및 50 mM p-nitrophenyl-nitrophenyl-D-glucopyranoside (PNG) 0.6 mL를 첨가한 뒤 교반하였다. 그 후 배양기를 이용하여 30°C에서 1시간 배양 후 Ethanol 8.0 mL를 넣고 교반 후 여과하였다. 이 여과액에 2 M Trishydroxymethyl aminomethane를 2.0 mL를 첨가하여 교반 후 400 nm 파장에서 비색 정량하여 β-glucosidase 활성도를 측정하였다.
Phosphatase의 활성도는 Frankenberger Jr and Johanson (1982)의 분석법을 참고하여 토양시료 0.5 g을 centrifuge tube에 넣고 0.1 mL의 Toluene, 0.6 mL의 0.5 M Trishydroxymethyl aminomethane buffer (pH 6.5), 1.8 mL의 초순수 및 0.6 mL의 50 mM sodium-p-nitrophenyl phosphate를 첨가하여 교반 후 30°C에서 1시간 배양하였다. 이후 8.0 mL의 Ethanol을 넣고 15초 교반 후에 여과하였고, 이 여과액에 2.0 mL의 2 M Trishydroxymethyl aminomethane을 넣고 교반 후 400 nm 파장에서 비색 정량하여 측정하였다.
Urease의 활성도는 Kandeler and Gerber (1988)의 분석법을 참고하였다. 토양 5.0 g을 100 mL 삼각 플라스크에 넣고 79.9 mM Urea 2.5 mL를 첨가하여 배양기를 이용하여 37°C에서 2시간 배양하였다. 이후 2.5 mL의 초순수와 30.0 mL의 KCl을 첨가한 후 30분간 교반한 후 여과하였고, 여과액 1.0 mL에 4.0 mL의 초순수를 첨가하여 희석한 뒤 0.3 M NaOH, sodium salicylate solution 및 초순수를 혼합하여 조제한 시약 5.0 mL와 39.1 mM dichlorisocyanurate sloution 2.0 mL를 넣은 후 30분 교반하고 690 nm 파장에서 비색 정량하였다.
Arylsulfatase의 활성도는 Tabatabai and Bremner (1970)의 분석법을 참고하였다. Centrifuge tube에 토양 1.0 g을 넣고 toluene 0.25 mL, 0.5 M acetate buffer (pH 5.8) 4.0 mL, p-nitrophenyl sulfate 1.0 mL 용액을 첨가하여 혼합한 후 밀봉하여 37°C에서 1시간 동안 배양하였다. 배양 후 0.5 M CaCl2 1.0 mL와 0.5 M NaOH 4.0 mL를 첨가하여 교반 후 여과하였고, 여과액을 400 nm 파장에서 비색 정량하였다.
벼의 비소 농도 분석 및 생육 조사
개량제 처리와 그에 따른 토양 효소의 활성 변화가 벼의 비소 농도와 생육에 미치는 영향을 조사하기 위하여 생육기에 초장과 경수를 측정하였고, 수확 후에는 벼 줄기와 잎의 비소 농도 및 생중을 조사하였다.
통계 분석
비소 오염 토양에 대한 개량제 처리가 토양 효소의 활성 변화, 토양 중 비소의 용해도, 벼 생육 및 현미의 비소 농도에 미치는 영향을 분석하기 위하여 통계 패키지 SAS (ver. 7.1)를 이용하여 상관분석 및 분산분석을 수행하였다.
Results and Discussion
개량제 처리에 따른 토양용액과 벼의 비소 농도 및 벼 생육
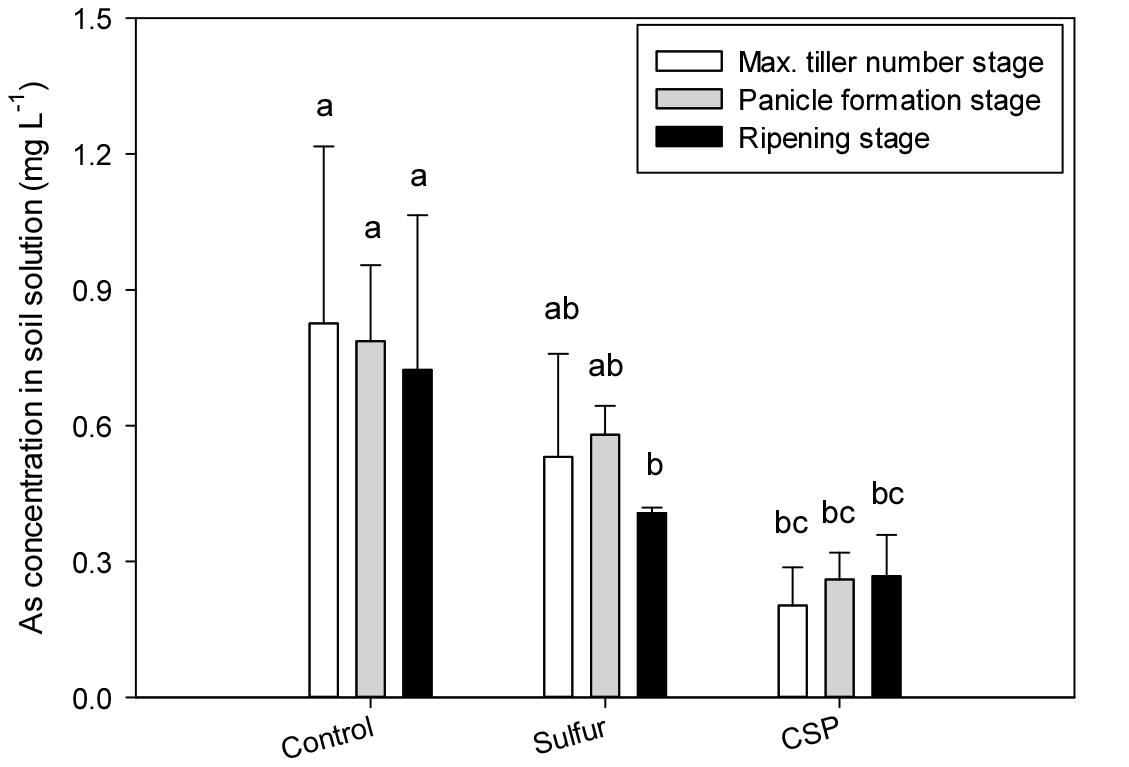
벼 생육 시기에 따른 토양용액 중 비소의 평균 농도는 황 처리구에서 0.41 - 0.58 mg L-1, 과인산석회 (calcium superphosphate, CSP) 처리구에서 0.20 - 0.27 mg L-1로 대조구의 0.72 - 0.83 mg L-1에 비해 낮은 값을 보였으며 (Fig. 1) 황 처리 시 등숙기에서, 과인산석회 처리의 경우 조사한 모든 시기에서 비소의 농도가 대조구에 비해 유의하게 낮은 것으로 볼 때 황 및 과인산석회 처리에 의해 토양 중 비소의 안정화가 일어난 것으로 판단되었다.
황 처리구의 토양용액 중 비소 농도 감소는 담수 환원 조건에서 근권 토양에 풍부한 황산염 환원 미생물 (Saalfield and Bostick, 2009; Burton et al., 2014; Xu et al., 2019; Tang et al., 2020)이 황화물 (FeS)을 생성하고 이 황화물이 비소와 침전하여 부동화 (Burton et al., 2014) 하였기 때문으로 생각된다. 논토양의 적정 토양화학성 범위인 pH 5.5 - 6.5, 치환성 칼슘 5.0 - 6.0 cmolc kg-1, 유효인산 80 - 120 mg kg-1 (NIAS, 2013)과 비교할 때 공시토양의 화학성은 pH 7.04, 치환성 칼슘 8.1 cmolc kg-1, 유효인산 255 mg kg-1으로 적정 범위보다 상대적으로 높았다 (Table 1). 따라서, 과인산석회 처리구의 토양용액 중 비소의 농도 감소는 이와 같은 토양조건의 영향으로 과인산석회 처리에 의한 Ca-phosphate-arsenate 미네랄의 형성 (Neupane and Donahoe, 2013; Lee et al., 2016)이 촉진되어 비소의 용출이 억제된 결과로 보인다.
개량제 처리에 따른 벼의 비소 평균 농도는 7.1 - 8.5 mg kg-1으로 처리구 사이에 유의한 차이는 나타나지 않았으나 토양용액 중 비소 농도가 전체 생육기간 중 가장 낮았던 과석 처리구에서 7.1 mg kg-1으로 가장 낮았다 (Table 3). 벼 생육은 과인산석회 처리에서 평균 초장 65.5 cm로 대조구의 59.3 cm에 비해 유의하게 높았고, 생중의 경우 황 처리구는 7.3 g, 과인산석회 처리구는 10.6 g으로 대조구의 6.1 g에 비해 유의하게 높았으며 전반적으로 과인산석회 처리구의 생육이 가장 양호한 것으로 나타났다 (Table 3).
Table 3.
Effect of amendments on As uptake by rice plant and the growth parameters of rice plant.
개량제 처리 후 논토양의 효소 활성 변화
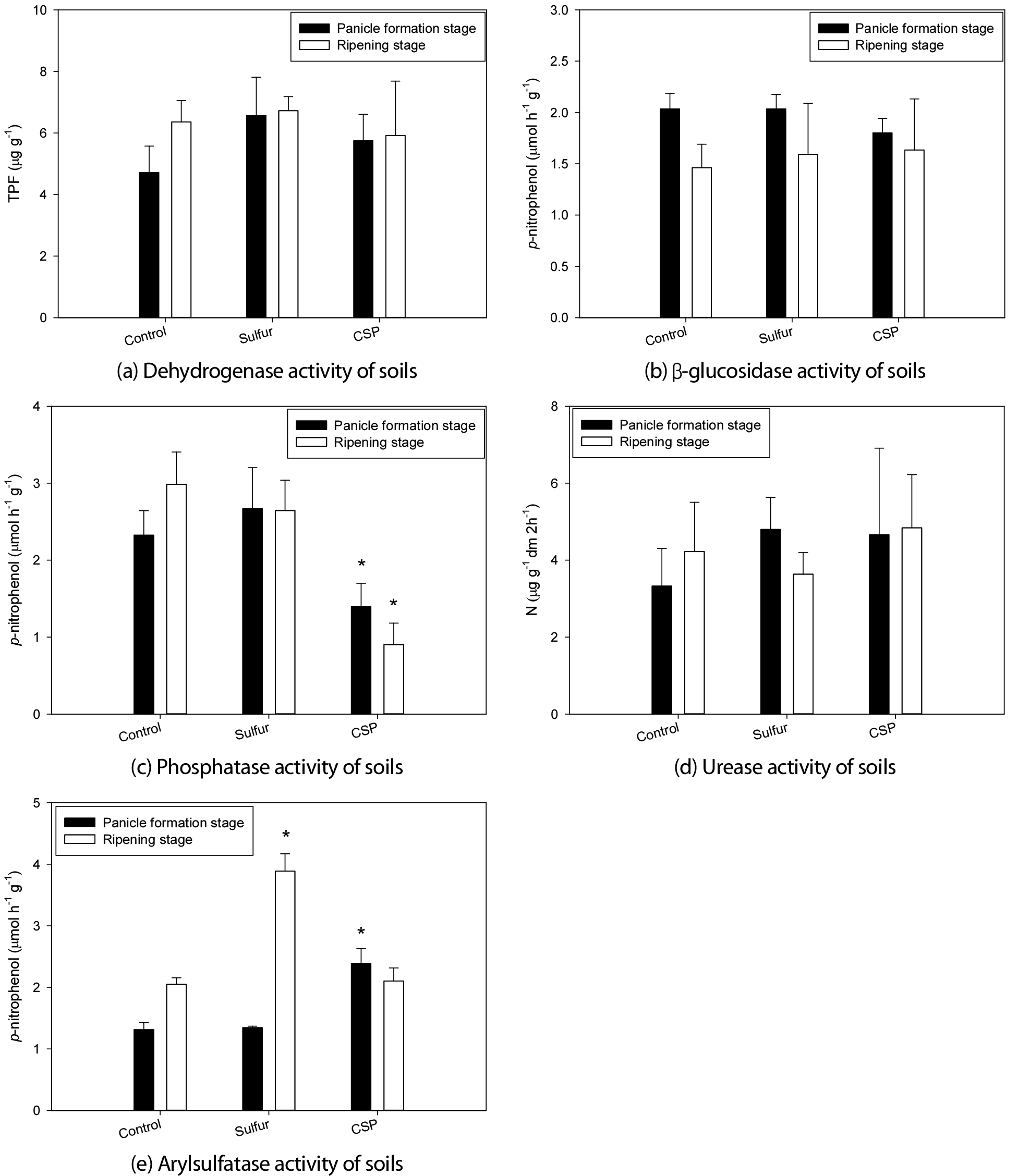
개량제 처리 후 벼의 생육 시기에 따른 dehydrogenase (DHA), urease, aryl-sulfatase (ASF), β-glucosidase 및 phosphatase (PHA) 5가지 토양 효소의 활성을 분석한 결과 일부 효소에서 활성의 변화가 나타났다. DHA의 활성도를 나타내는 1,3,5-Triphenyl tetrazolium formazan (TPF)의 농도는 유수형성기와 등숙기에 대조구에서 평균 4.7 - 6.4 µg g-1이었고 개량제 처리구에서 5.7 - 6.7 µg g-1로 유수형성기에 대조구에 비해 높은 경향이었으나 유의한 차이는 나타나지 않았다 (Fig. 2a).
β-glucosidase의 활성도를 나타내는 p-nitrophenol의 농도는 대조구 및 개량제 처리구에서 유수형성기에 1.8 - 2.0 µmol h-1 g-1, 등숙기에는 1.5 - 1.7 µmol h-1 g-1으로 등숙기에 활성도가 다소 감소하였으며 처리구 사이에 유의한 차이는 나타나지 않았다 (Fig. 2b). 비소는 담수 상태와 같은 환원 환경에서 arsenate (As5+)에서 arsenite (As3+)로 전환되면 독성이 증가한다 (Cox, 1995). Majumder et al. (2022)은 토양의 비소 농도가 10.6 mg kg-1인 논에서 수행한 연구 결과 β-glucosidase, urease, phosphatase 및 arylsulfatase 중 β-glucosidase의 활성이 혐기 조건에 비해 호기 조건에서 30 - 34% 증가하여 다른 효소들의 호기 조건에서의 증가율 12 - 29%보다 상대적으로 높다고 하였으며, 이는 혐기 조건에서 유기물 공급에 따른 미생물의 유기물 산화 및 산소 소모로 인한 산화환원전위 감소로 비소의 용해도가 증가한 결과로 보았다. 본 연구의 경우는 호기 대사에 비해 낮은 혐기 대사 효율 (Pulford and Tabatabai, 1988), 효소 활성과 토양 수분 사이의 부의 상관 (Hueso et al., 2011)을 고려할 때 유기물의 영향보다는 벼 이앙 후 등숙기까지 담수 상태를 유지하여 혐기 조건이 형성된 결과 등숙기의 β-glucosidase 활성이 유수형성기와 비교하여 감소한 것으로 판단된다.
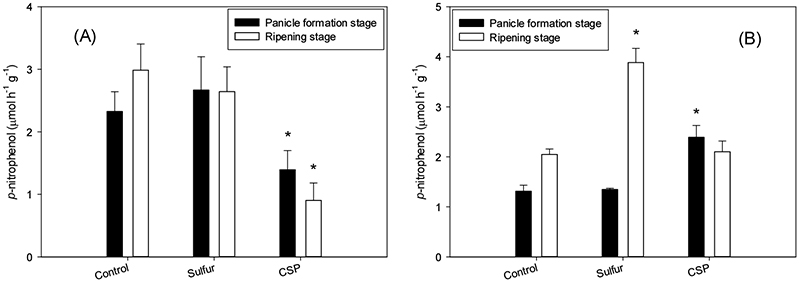
PHA의 활성도를 나타내는 p-nitrophenol의 농도는 유수형성기에 대조구 및 황 처리구의 평균 2.3 - 2.7 µmol h-1 g-1에 비해 과인산석회 처리구는 1.4 µmol h-1 g-1으로 대조구에 비해 유의하게 낮았다. 등숙기에도 PHA의 활성도는 대조구 및 황 처리구의 2.6 - 3.0 µmol h-1 g-1에 비해 과인산석회 처리구는 0.9 µmol h-1 g-1으로 대조구에 비해 유의하게 낮은 특징을 나타내었다 (Fig. 2c).
토양 내 대부분의 박테리아는 비소의 독성에 민감하며 비소의 노출은 토양 미생물 활성에 부정적인 영향을 미친다 (Lorenz et al., 2006). Majumder et al. (2022)은 PHA의 활성도는 토양 중 유효태 비소의 농도와 뚜렷한 음의 상관관계를 보이며, 이와 같은 PHA의 민감도는 인산과 arsenate (As5+)의 구조적 유사성 (Juma and Tabatabai, 1977)으로 인한 PHA 활성의 경쟁적 저해와 관련이 있다고 하였다. 본 연구에서 과인산석회 처리구의 토양용액 중 비소의 농도가 대조구에 비해 유의하게 낮았음을 고려할 때 (Fig. 1) PHA의 활성이 오히려 감소한 것은 과량의 인산에 의한 경쟁적 활성 저해의 결과로 추측되나, 인산의 처리량에 따른 PHA의 활성 변화 등 추가적인 연구가 필요할 것으로 생각된다.
Urease의 활성도는 벼의 유수형성기에 대조구에서 평균 3.3 µg N g-1 dm 2h-1, 개량제 처리구는 4.7 - 4.8 µg N g-1 dm 2h-1로 개량제 처리구에서 높은 경향이었으나 유의한 차이는 없었다. 등숙기에는 대조구는 평균 4.2 µg N g-1 dm 2h-1, 개량제 처리구는 3.6 - 4.8 µg N g-1 dm 2h-1으로 유슈형성기와 마찬가지로 처리구 사이에 유의한 차이는 나타나지 않았다 (Fig. 2d).
ASF의 활성도는 유수형성기에 대조구와 황 처리구의 1.3 µmol h-1 g-1에 비해 과인산석회 처리구는 2.4 µmol h-1 g-1으로 유의하게 높아 (Fig. 2e) 과인산석회 처리 시 나타난 PHA의 낮은 활성 (Fig. 2c)과는 대조적인 결과를 나타내었다. 또한, 황 처리구의 경우 유수형성기에는 대조구와 같은 수준이었으나, 등숙기에는 활성도가 3.9 µmol h-1 g-1으로 유수형성기의 1.3 µmol h-1 g-1과 비교하여 3배 증가하였다. 따라서, 대조구 및 과인산석회 처리구의 활성도 2.0 - 2.1 µmol h-1 g-1 보다 유의하게 높은 값을 나타내어 같은 시기 다른 효소들의 활성과 대조적인 결과를 나타내었다 (Fig. 2). 이와 같은 결과는 개량제의 영향과 함께 중금속에 저해 받는 정도는 효소에 따라 다양하며 (Hinojosa et al., 2004) ASF의 활성은 중금속에 민감한 반면, PHA 및 urease 등의 활성은 중금속에 덜 민감 (Bardgett et al., 1994; Yeates et al., 1994)하기 때문으로 판단된다.
ASF의 경우 본 실험조건에서 PHA와는 대조적으로 개량제 처리 후 비소의 유효도가 감소한 황 및 과인산석회 처리에서 유의한 활성 증가가 관찰되어 개량제 처리에 따른 비소 오염 논토양의 독성 변화를 평가하기 위한 지표로서의 활용 가능성이 있을 것으로 판단되었다. 또한, 토양 효소 활성의 변화는 토양의 물리화학성과 상관관계가 있고 (Xian et al., 2015; Cenini et al., 2016) 중금속 오염이 토양 효소의 활성에 미치는 부지 특이적인 영향 (Karaca et al., 2010; Hagmann et al., 2015)을 고려할 때 토양 화학성의 변화 등 다른 지표와 결합한 복합적인 평가와 관련된 추가적인 연구가 필요할 것으로 생각된다.
Conclusions
비소로 오염된 논토양에 토양개량제 (황 및 과인산석회) 처리 후 5가지 토양 효소 (dehydrogenase, urease, aryl-sulfatase, β-glucosidase 및 phosphatase)의 활성 변화를 분석한 결과 phosphatase는 비소의 유효도가 가장 낮고 벼의 생육이 가장 양호한 과인산석회 처리에서 유의한 활성 감소를 보였다. Dehydrogenase, urease 및 β-glucosidase는 대조구와 뚜렷한 활성의 차이를 나타내지 않았다. 반면, aryl-sulfatase의 경우 비소의 유효도 감소가 확인된 황 및 과인산석회 처리 모두에서 유의한 활성 증가를 보였으며 개량제 처리에 따른 논토양 중 비소의 독성 변화를 벼 생육 기간 내에 확인할 수 있는 지표로서의 활용 가능성이 있을 것으로 판단된다.