Introduction
Materials and Methods
공시재료
영양배지
이론적 메탄생산퍼텐셜 시험 (theoretical methane potential, Bth)
생화학적 메탄퍼텐셜 시험 (biochemical methane potential assay, BMP assay)
분석모델 (analytical model)
시험분석 (analysis)
Results and Discussion
공시접종액과 기질의 성상특성
섬유소 성상특성
메탄퍼텐셜 및 유기물 분해 반응속도 해석
Conclusions
Introduction
세계 에너지의 대부분은 석유 화학 자원, 석탄 및 천연가스에서 제공되며, 이러한 모든 에너지 자원은 유한하다는 특성을 가지고 있고, 이런 화석연료에 의해 방출되는 온실 가스는 기상기후 현상의 원인이 되고 있다. 국내에 공급되는 1차 에너지 중 석탄 28.2, 석유 38.5%로 화석연료에 크게 의존하고 있으며 화석연료로부터 발생되는 문제들을 해결할 대체에너지로 신재생에너지가 관심을 받고 있는 상황이다. 2017년 기준 OECD 국가의 신재생에너지 공급현황은 총 539,348,000 TOE로 이 중, 우리나라의 공급현황은 5,912,000 TOE로 주요 국가에 비해 낮은 편에 속한다. 이러한 이유로 정부는 “재생에너지 3020 이행계획 (MOTIE, 2017)”, “제 9차 전력수급 기본계획 (MOTIE, 2020)”을 통해 2030년까지 신재생에너지 발전비중을 20%로 증가시켜 화석연료를 대체하고 화석연료에서 기인하는 환경문제를 저감하는 정책을 추진하고 있다. 신재생에너지 중 바이오매스를 원료로 이용하여 에너지화 시키는 바이오가스는 보관과 이동이 용이하며, 주성분인 메탄가스는 직접연소, 열분해에 비해 특별한 외부에너지가 필요하지 않다는 장점이 있다. 바이오가스를 생산하는 혐기소화 공정은 고농도의 유기물을 처리하는 동시에 신재생에너지를 생산하는 생물학적 전환 기술이다. 최근 탄소 고정 능력이 높으며, 척박한 토양에서도 높은 생산성을 보이는 섬유질작물인 케나프 (Hibiscus cannabinus, L. family Malvaceae)가 바이오에너지 작물로 관심을 받고 있다. 케나프는 다양한 기상조건에서 자랄 수 있는 초본 일년생 식물로, 적당한 조건에서 3개월 이내에 3 m 이상 자라는 특성을 보이고 있다 (Seller and Reichert, 1999). 케나프는 토양에 포함된 질소와 인을 흡수하고 체내에 상당히 빠른 속도로 이산화탄소의 축적이 이루어지는 특성으로 인류의 역사와 함께 꾸준히 이용되어 왔다 (Amaducci et al., 2000). 케나프는 가공 중 저밀도, 비 마모성, 높은 기계적 특성 및 생분해성을 나타내고 있고 최근에는 산림파괴 방지를 위해 펄프 및 제지 산업, 부직포, 밧줄, 직물 등 대체 원료로 많이 사용 되어왔다 (Kawai et al., 2000). 이처럼 케나프의 이용이 확대되고 있으나 케나프를 이용한 바이오가스화에 대한 연구는 미미한 상황이다. 케나프와 같은 섬유질 작물의 에너지 전환을 위해서는 혐기소화시 낮은 분해율과 긴 지체성장기로 인해 혐기소화 과정에서 율속단계에 해당하는 가수분해단계가 길어지는 특징이 있다. 이러한 이유로 원료를 그대로 혐기소화조에 투입 할 경우 소화조 용적의 증가와 같은 문제점이 발생할 수 있다. 이에 혐기미생물의 효율을 향상시키기 위해 혐기미생물이 이용할 수 있는 영양배지를 첨가하여 가수분해 반응을 촉진하여 메탄전환 효율을 향상시키기 위한 연구도 진행 된 바 있다.
따라서 본 연구에서는 케나프를 원료로 하여 이론적 메탄생산퍼텐셜과 BMP분석법을 통하여 생물화학적 메탄생산 퍼텐셜을 분석하였다 (VDI 4630, 2006). 분석한 생화학적 메탄퍼텐셜 결과를 바탕으로 Modified gompertz model과 Parallel first order kinetics model을 이용하여 케나프의 유기물 분해 반응속도를 산출하였다. 또한, 섬유질 함량이 높아 분해율이 낮은 케나프의 바이오에너지 전환효율을 향상시키기 위하여 접종액에 영양배지를 첨가하였을 때 혐기미생물의 메탄전환 효율을 비교 ‧ 분석하였다.
Materials and Methods
공시재료
본 연구에서 사용된 기질 (substrate, S)인 케나프는 이스라엘 품종으로 풍건파쇄하여 사용하였으며, 접종액 (inoculum, I)은 돈분과 음폐수의 비율을 7:3으로 38°C 중온혐기소화 처리를 하고 있는 20 ton day-1 규모의 혐기소화조 (경기도 이천 설성면, 한경대학교 바이오가스연구센터 운영)에서 채취하였다. 채취한 접종액은 2 mm의 체로 거르고 잔여 유기물과 잔여 가스를 제거하기 위해 38°C의 혐기 열풍배양기에서 14일간 배양하였다.
영양배지
본 연구에서는 섬유질 함량이 높아 분해율이 낮은 케나프의 바이오에너지 전환효율을 향상시키기 위하여 혐기미생물이 이용하도록 첨가한 영양배지의 조성은 Table 3과 같으며 (Shelton and Tiedije, 1984), 제조한 배지는 영양배지 처리구에 30 mL씩 첨가하였다. 혐기소화를 효율을 높이기 위해 사용되어 왔던 성장배지 (growth media)는 각 성분의 농도가 필요한 양에 따라 달라지는 다량 영양소와 미량 영양소로 구성되며, 미량금속 원소가 부족하면 혐기성 분해 과정에서 바이오가스 생산이 낮아지고 공정불안을 야기할 수 있다. 이런 공정상의 이유로 여러 연구자들이 다양한 영양배지를 연구하고 사용하여 왔으나 이런 영양배지의 다양성으로 인해 각 연구자간의 연구결과의 비교가 어렵다는 결과를 초래 하였고 이것에 대해 꾸준히 지적되어 왔다 (Fang and Liu, 2002; Bourriaud et al., 2005). 따라서 본 연구의 영양배지는 국내 및 해외에서 주로 쓰였던 영양배지 조성을 선택하였다.
이론적 메탄생산퍼텐셜 시험 (theoretical methane potential, Bth)
이론적 메탄퍼텐셜은 원소분석 결과를 바탕으로 Boyle (1976)의 유기물 분해 반응식 (Eq. 1)을 이용하여 산출하였으며 완성된 유기물 분해 반응식을 바탕으로 이론적 메탄퍼텐셜 식 (Eq. 2)을 이용하여 이론적 메탄퍼텐셜을 산출하였다.
생화학적 메탄퍼텐셜 시험 (biochemical methane potential assay, BMP assay)
채취한 접종액은 38°C에서 중온 혐기배양을 시켜 잔여 유기물과 잔여 가스를 제거하였고, 기질인 케나프는 분쇄하여 이용하였다. 투입 기질과 접종액의 휘발성 고형물 함량의 비율 (S/I ratio)이 0.3과 0.5가 되도록 조절하여 3회 반복으로 160 mL Serum bottle에서 회분식으로 진행하였으며, 접종액을 80 mL 분주한 상태에서 S/I의 비율이 0.3과 0.5일 때, 구해진 기질의 양을 넣었고, 접종액 자체에서 발생하는 메탄과 이산화탄소의 양을 보정하기 위해 접종액만 분주한 Serum bottle를 바탕시험으로 진행했다. 또한, 미생물 영양배지를 첨가하였을 때의 메탄생산 반응을 비교해 보기 위해서 접종액을 50 mL 분주한 상태에서 미생물 영양배지 30 mL를 첨가 하였고, S/I의 비율이 0.3, 0.5일 때, 구해진 기질의 양을 넣었다. 혐기성 상태를 유지하기 위해 고무마개로 밀폐시켜 38°C의 배양기에서 90일간 배양하면서 가스발생량이 많은 기간 동안 1일 1회 수기로 교반하면서 동일한 시간에 가스발생량과 가스농도를 측정하였고, 이후 측정주기를 늘려갔다.
회분식 혐기반응기의 바이오가스 발생량 측정은 수주차식 가스량 측정기를 사용하였으며 발생한 바이오가스는 Eq. 3과 같이 수분과 온도를 보정하여 표준상태 (0°C, 1기압)에서의 건조상태 가스 부피로 환산하여 누적 메탄생산곡선을 산출하였다. Vdry gas는 표준상태 (0°C, 1기압)에서의 건조 가스의 부피, T는 반응기의 운전온도, Vwet gas at T°C는 반응기 운전온도 (38°C)에서의 습윤 가스의 부피, P는 가스의 부피측정 당시의 대기압, PT는 T°C에서의 포화수증기압 (mmHg)이며, 본 연구에서는 P를 760 mmHg로 간주하고 PT는 38°C에서의 포화수증기압으로 계산하였다 (Oh and Yoon, 2016).
분석모델 (analytical model)
생화학적 메탄생산퍼텐셜 산출을 위한 분석모델로 Modified gompertz model과 Parallel first order kinetics model을 이용하여 SigmaPlot으로 해석하였다 (Lay et al., 1998).
회분식 반응기를 통한 케나프의 유기물 분해 반응 속도 (modified gompertz model)
Modified gompertz model (Eq. 4)에서 M은 누적 메탄생산량 (mL), t는 혐기배양기간 (days), P는 최종메탄생산량 (mL), e는 exp (1), Rm은 최대메탄생산속도 (ml day-1), λ는 지체성장시간 (lag growth phase time, days)을 나타낸다.
회분식 반응기를 통한 케나프의 유기물 분해 반응속도 (parallel first orde kinetics model)
Parallel first order kinetics model (Eq. 14) 모델로 유기물의 분해특성을 분석하였으며, 이 모델은 서로 다른 반응속도를 가지는 두 가지 종류의 유기물에 대하여 각각 1차 반응식을 조합하여 해석하는 반응속도식이다 (Oh and Yoon, 2016). 여기서 Bt는 시간 t에서의 메탄생산량 (mL), Bu는 최종메탄생산량 (ultimate methane production, ml), fe는 병렬 1차 반응 분배계수 (g g-1), k1과 k2는 병렬 1차 반응속도 상수 (kinetic constant)이다. Eq. 15에서의 상수 k1, k2, fe는 반응식을 이용하여 BMP assay에서 얻은 누적메탄생산곡선에 최적화하여 구하였다.
상이한 유기물의 분해 속도로 유기물의 구성을 유추하기 위해 혐기소화 과정에서 분해되는 기질 (substrate) 중의 유기물 ()을 Eq. 5와 같이 혐기소화 과정에서 메탄으로 전환되는 생분해성 (biodegradable) 유기물 ()과 전환되지 않는 난분해성 (non-biodegradable) 유기물 ()로 정의하였으며, 또 생분해성 유기물 ()은 Eq. 6과 같이 혐기소화과정에서 초기에 쉽게 분해되는 이분해성 (easily biodegradable) 유기물 ()과 분해저항성이 있어 혐기소화 후기에 천천히 분해되는 분해저항성 (persistent) 유기물 ()로 구분하여 정의하였다 (Oh and Yoon, 2016).
: 총 휘발성고형물 (volatile solid, VS)의 함량 (g)
: 분해성 (biodegradable) VS의 함량 (g)
: 난분해성 (non-biodegradable) VS의 함량 (g)
: 최종 메탄퍼텐셜 (Nm3-CH4 kg-1-VSadded)
: 이론적 메탄퍼텐셜 (Nm3-CH4 kg-1-VSadded)
: 이분해성 (easily biodegradable) VS의 함량 (g)
: 분해저항성 (persistent) VS의 함량 (g)
: 이분해성 (easily biodegradable) 유기물 계수 (, g g-1)
이때, 이분해성 유기물 계수를 이용하면 이분해성 유기물과 분해저항성 유기물은 각각 Eq. 7과 Eq. 8 같이 표현할 수 있다.
여기서, 1차 반응속도식 (first order kinetics)을 이용하여 이분해성 유기물과 분해저항성 유기물의 분해속도를 표현하면 Eq. 9와 Eq. 10과 같으며, 총유기물 ()의 분해반응속도는 Eq. 11과 같이 이분해성 유기물과 분해저항성 유기물의 병렬 1차 반응속도식 (parallel first order kinetics)으로 표현할 수 있다. 여기서 Eq. 7과 Eq. 8을 Eq. 11에 대입하면, Eq. 12와 같다 (Oh and Yoon, 2016).
: 의 혐기적 분해 1차 반응속도상수 (first order kinetic constant)
: 시간 (day)
과 : 초기반응시간 (0)과 시간에서의 반응물의 양 (g)
: 의 혐기적 분해 1차 반응속도상수 (first order kinetic constant)
: 시간 (day)
과 : 초기반응시간 (0)과 시간에서의 반응물의 양 (g)
시간 t에서의 분해유기물의 양은 Eq. 13과 같이 표현할 수 있으며, 일 때, , 가 되고, Eq. 14를 도출할 수 있다. 여기서 Eq. 13과 Eq. 14를 Eq. 11에 대입하여 풀면 Eq. 15와 같이 이분해성 유기물 계수 ()와 최종메탄생산량 ()으로 표현되는 병렬 1차 반응속도식을 구할 수 있으며, 누적메탄생산곡선의 수학적 분석을 통해 이분해성 유기물 ()과 분해저항성 유기물 ()의 함량을 구할 수 있다 (Oh and Yoon, 2016).
: 메탄생산상수 (methane yield constant, g mL-1)
: 시간 에서의 메탄생산량 (mL)
: 최대메탄생산량 (ultimate methane production, mL)
시험분석 (analysis)
바이오가스의 가스성분분석은 TCD (thermal conductivity detector)가 장착된 Gas chromatography (Clarus 680, PerkinElmer, USA)를 이용하였다. 컬럼은 HayesepQ packed column (3 mm × 3 m, 80 - 100 mesh size)을 이용하였으며, 고순도 아르곤 (Ar) 가스를 이동상으로 사용하여 flow 30 mL min-1의 운전 상태에서 주입부 (injector) 온도 150°C, 컬럼부 (column oven) 90°C, 검출부 (detector) 150°C에서 분석하였다 (Sorensen et al., 1991). 시료의 원소분석은 원소분석기 (EA2000, Thermo Finnigan, CA)를 사용하였다. 산성세제 불용성 섬유 (acid detergent fiber, ADF), 중성세제 불용성 섬유 (neutral detergent fiber, NDF), 산성세제 불용성 리그닌 (acid detergent lignin, ADL)의 함량은 Van Soest and Robertson (1985)에 따라 분석하였다. 총 고형물 (total solid, TS), 휘발성 고형물 (volatile solid, VS), 화학적 산소 요구량 (chemical oxygen demand, COD), 총 킬달 질소 (total Kjeldahl nitrogen, TKN), 암모니아성 질소 (ammonium nitrogen, NH4+-N), 알칼리도 (alkalinity), 등은 표준분석법 (APHA, 1998)에 따라 3회 반복으로 수행하였다.
Results and Discussion
공시접종액과 기질의 성상특성
본 연구에서 사용된 기질 (substrate, S)인 케나프의 이화학적 성상분석 결과는 Table 1과 같았다. 총고형물 (TS)과 휘발성고형물 (VS) 함량은 각각 917,511 mg kg-1, 814,589 mg kg-1로 일반적인 사료작물로 널리 이용되는 옥수수 줄기의 고형물 함량과 유사한 수치를 보였으며 (Xu et al., 2019) 전질소 (TKN)함량은 5,283 mg kg-1, 암모니아성질소 (NH4+-N)는 99 mg kg-1이었다.
Table 1.
Composition of nutrient medium.
2주간 38°C에서 혐기배양 후 접종액의 이화학적 성상 분석결과는 Table 2와 같이 pH 8.28, 총고형물 52,350 mg L-1, 휘발성고형물 25,900 mg L-1, 화학적산소요구량 24,383 mg L-1, 전질소 1,354 mg L-1, 암모니아성질소는 330 mg L-1로 나타났다. 특히 암모니아성 질소는 함량이 낮아 혐기소화시 독성이 우려되는 범위인 1,500 - 3,000 mg L-1보다 낮아 혐기소화에 문제가 없을 것으로 판단되었다 (McCarty, 1964).
Table 2.
Chemical composition of Hibiscus cannabinus.
| Parameters | TS† | VS‡ | TKN§ | NH4+-N¶ |
| ---------------------------------------------- mg kg-1 ---------------------------------------------- | ||||
| Hibiscus cannabinus | 917,511 | 814,589 | 5,283 | 99 |
Table 3.
Chemical composition of inoculum.
섬유소 성상특성
케나프의 중성세제 불용성 섬유 (neutral detergent fiber, NDF)와 산성세제 불용성 섬유 (acid detergent fiber, ADF)의 함량은 Table 4와 같았다. 헤미셀룰로오스, 셀룰로오스, 리그닌의 함량을 나타내는 NDF는 64.34%였으며, NDF에서 헤미셀룰로오스를 제외한 ADF의 함량은 50.13%이었다. ADF에서 셀룰로오스를 제외한 ADL은 리그닌으로 함량은 5.25%이었다. 식물성 바이오매스에서 기인하는 리그노셀룰로오스의 기질의 분해는 다양한 성분함량, 셀룰로오스 결정도, 리그닌 함량에 따라 다를 수 있으며 (Jean et al., 2016), 메탄생산량은 헤미셀룰로오스 함량이 높은 경우에는 양의 상관관계를 셀룰로오스 및 리그닌은 음의 상관관계에 기여한다고 선행 연구로 알려져 왔다 (Carlsson et al., 2012). 따라서 본 공시 재료인 케나프는 헤미셀룰로스 함량은 낮은 편이고 리그닌 함량은 셀룰로오스계 바이오매스의 평균 수치인 10 - 12% 보다는 낮았으나 셀룰로오스 함량이 44.88%로 매우 높아 혐기성 미생물이 유기물을 분해하는데 어려움이 있을 것으로 예측 되었다 (Xu et al., 2019).
Table 4.
NDF and ADF content of Hibiscus cannabinus.
메탄퍼텐셜 및 유기물 분해 반응속도 해석
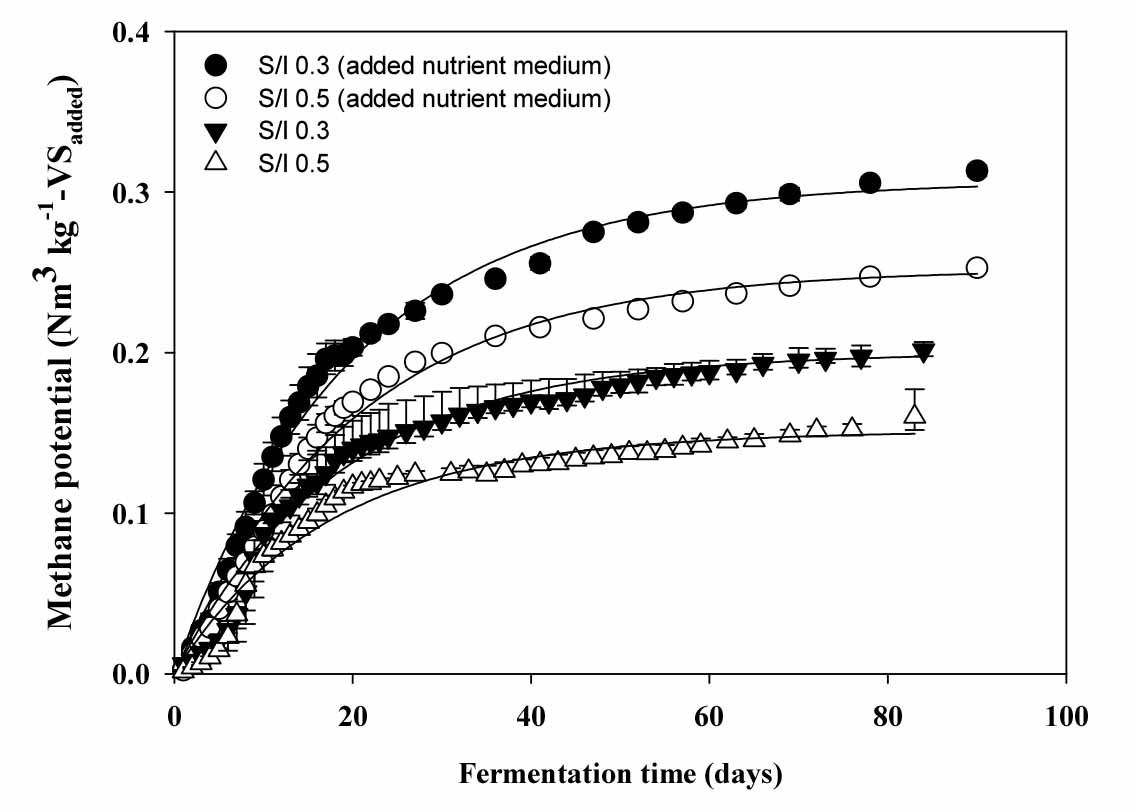
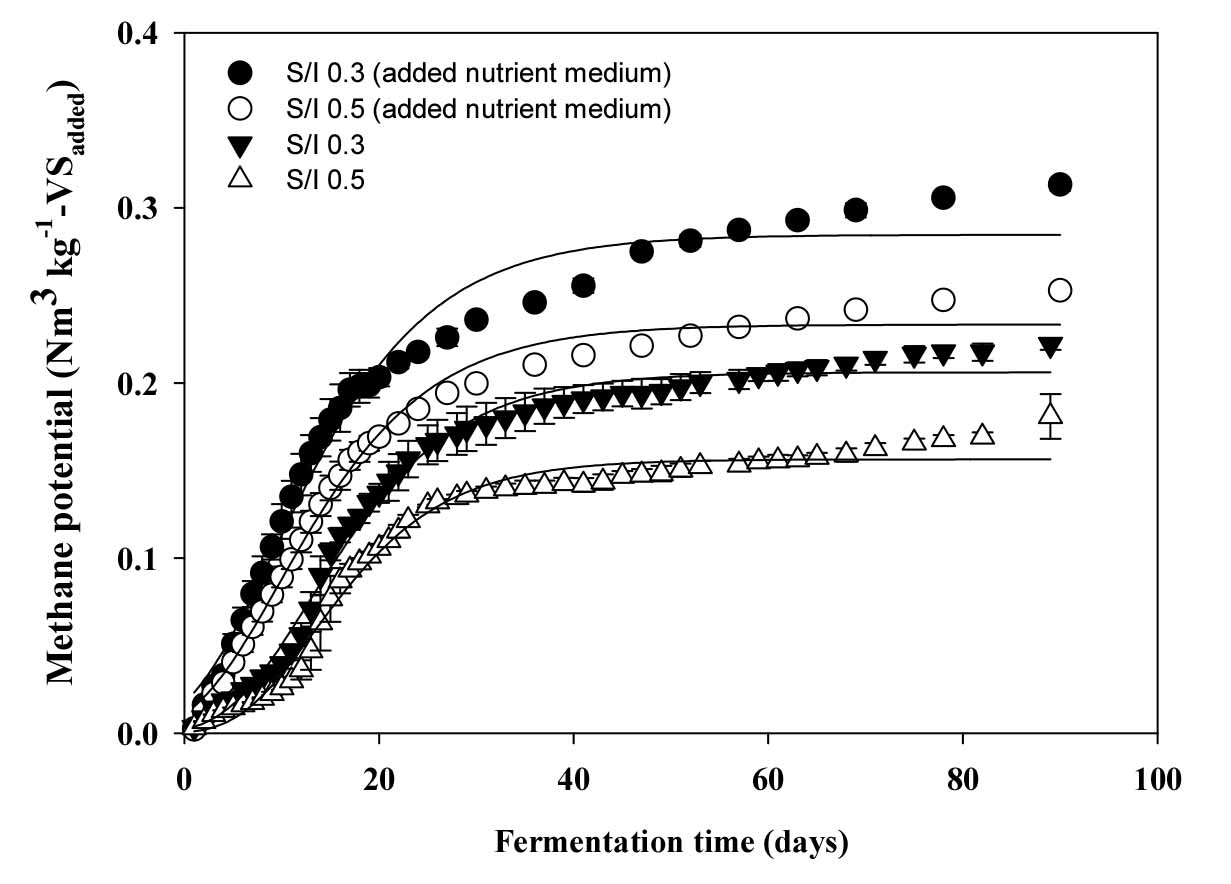
케나프의 원소분석 결과를 Boyle의 유기물 분해 반응식 (Eq. 1)을 이용하여 이론적 메탄퍼텐셜을 산출한 결과 이론적 메탄퍼텐셜은 0.441 Nm3 kg-1-VS이었다 (Table 5). 생화학적 메탄퍼텐셜은 BMP assay의 결과를 Modified gompertz model과 Parallel first order kinetics model을 적용하여 유기물 분해특성을 해석하였다. 본 연구에서 사용된 모델은 유기물의 분해 특성에 따라서 누적 메탄생산 곡선을 해석하는데 장단점을 볼 수 있다. Gompertz 모델의 경우는 지체생장기간이 긴 유기물의 경우 초반의 지체성장기를 잘 반영하는 특성이 있으나 후반기의 지속적인 유기물 분해는 잘 반영하지 못하는 특성이 있으며, 반면에 병열 1차반응속도식은 본 연구의 케나프처럼 지체성장이 4 - 5일로 길게 나타날 경우 초반의 지체성장기는 잘 반영하지는 못하지만 분해가 비교적 어려운 유기물의 경우 회분식 혐기반응기의 운전 후기까지 지속적인 누적 메탄생산 증가를 잘 반영하는 특성이 있어 본 연구에서는 2가지 모델로 케나프의 누적 메탄생산곡선을 각각 해석하였다 (Fig. 1, Fig. 2).
Modified gompertz model을 이용한 유기물 분해 반응속도 해석
Modified gompertz model을 이용하여 케나프의 유기물 분해 반응속도를 분석한 결과는 Table 5와 같다. 영양배지 처리구에서 S/I ratio 0.3, 0.5일 때, 케나프의 누적 메탄생산량 (P)은 각각 74, 101 mL, 일 최대 메탄생산량 (Rm)은 9.27, 8.87, mL day-1, 혐기미생물이 기질을 분해하는데 적응하는 시간인 지체성장기 (λ)는 0.07, 0.93 day이었다. 생화학적 메탄퍼텐셜은 0.286, 0.233 Nm3 kg-1-VSadded으로 생화학적 메탄퍼텐셜에 이론적 메탄퍼텐셜 값을 나눈 혐기적 유기물 분해율 (VSr)은 64.90, 53.04%이었다. 영양배지 무처리구에서 S/I ratio 0.3, 0.5일 때, 케나프의 누적 메탄생산량 (P)은 각각 128, 162 mL, 일 최대 메탄생산량 (Rm)은 8.47, 7.63 mL day-1, 혐기미생물이 기질을 분해하는데 적응하는 시간인 지체성장기 (λ)은 4.40, 5.64 day이었다. 생화학적 메탄퍼텐셜은 0.206, 0.157 Nm3 kg-1-VSadded, 혐기적 유기물 분해율 (VSr)은 46.67, 35.51%이었다. 메탄생산량의 경우 영양배지 처리와 무처리의 차이가 S/I 비율별 약 28%, 31%의 차이를 보였고 지체성장기가 무처리의 경우는 4 - 5일로 매우 긴 것으로 나타났으며 유기물 분해율도 각각 25.2%, 16.3%로 영양배지 처리를 하였을 때 향상된 분해율을 보여주어 케나프의 혐기소화를 위해서는 영양배지 또는 가수분해 전처리공정이 필수적이라 판단되었다. 보통 셀룰로오스와 헤미셀룰로오스 모두 혐기성 메탄으로 전환할 수 있지만, 이것의 분해를 위해서는 식물성 섬유소의 결정도가 크게 영향을 미치는 것으로 보고 되고 있다 (Yi et al., 2014). 케나프는 그 구조 특성이 목질계 바이오매스와는 대조적으로 일반적으로 전혀 분해가 되지 않는다고 알려진 리그닌의 함량은 상대적으로 낮고 셀룰로오스 함량이 높아 영양배지의 처리의 유무가 메탄생산량과 유기물 분해율에 영향을 준 것으로 판단되었다.
Table 5.
Methane potential and modified gompertz model parameters according to the canabinus of S/I ratio 0.3, 0.5.
Parallel first order kinetics model을 이용한 유기물 분해 반응속도 해석
Modified gompertz model에서 산출된 영양배지 무처리구의 지체성장기는 S/I ratio 0.3, 0.5에서 4.26, 5.48 day이었다. 이처럼 긴 지체성장기를 갖는 기질의 경우 Parallel first order kinetics model을 이용한 혐기 미생물의 반응속도 및 성장특성의 해석에 어려움이 있다 (Lee et al., 2020). 따라서 지체성장기와 이 기간 동안 발생한 바이오가스는 혐기 미생물이 케나프를 분해하는데 적응하는 기간이라고 판단해 제외하고 분석하였다.
Parallel first order kinetics model을 이용하여 케나프의 유기물 분해 반응속도를 분석한 결과는 Table 6과 같다. 영양배지 처리구에서 S/I ratio 0.3, 0.5일 때, 최대 메탄생산량 (Bmax)은 124, 155 mL, 병렬 1차 반응 계수 (fe)은 0.518, 0.523이다. 이분해성 유기물 (VSe)함량은 23.9, 19.73%, 분해저항성 유기물 (VSp)함량은 21.36, 14.38%이며, BMP assy 동안에 분해되지 않은 난분해성 유기물 (VSNB)함량은 45.26, 34.10%이었다. 생화학적 메탄퍼텐셜은 0.200, 0.150 Nm3 kg-1-VSadded, 혐기적 유기물 분해율은 45.26, 34.10%이었다. 영양배지 무처리구에서 S/I ratio 0.3, 0.5일 때, 최대 메탄생산량 (Bmax)은 80, 109 mL, 병렬 1차 반응 계수 (fe)은 0.522, 0.533이다. 이분해성 유기물 (VSe)함량은 36.60, 30.43%, 분해저항성 유기물 (VSp)함량은 33.51, 26.71%이며 난분해성 유기물 (VSNB)함량은 29.89, 42.86%이었다. 생화학적 메탄퍼텐셜은 0.309, 0.252 Nm3 kg-1-VSadded, 혐기적 유기물 분해율 (VSr)은 70.11, 57.14%이었다. Parallel first order kinetics model을 이용한 분석은 영양배지 처리구가 미처리구에 비해 S/I ratio 0.3, 0.5에서 이분해성 유기물이 12.70, 10.70% 증가하였고, 분해저항성 유기물이 12.15, 12.33% 증가하였다. 이러한 결과는 셀룰로오스계 바이오매스의 혐기소화 효율 증진을 위해 섬유소 분해균 첨가와 미생물 영양배지를 첨가했을 때, 기존보다 메탄 생산량이 증가한 Kim et al. (2012)의 연구와 유사하게 나타났다. 본 연구는 Parallel first order kinetics model을 이용하여 반응속도를 해석하여 혐기소화 중 차이를 보이는 유기물 분해속도를 바탕으로 전개식을 활용하여 유기물의 분포를 추정하였다. 본 연구에서 난분해성 유기물이라고 정의한 것은 식물계 바이오매스에서는 주로 Ash와 리그닌, 분해저항성 유기물은 셀룰로오스 이분해성 유기물은 헤미셀룰로오스가 주로 분포할 것으로 예측하였다. 그러나 영양배지 처리 시 난분해성 유기물이 54 - 65%에서 29 - 42%로 분포량이 줄어든 것이 확인되어 본 연구의 난분해성 유기물은 주로 리그닌이 차지할 것이라는 예측이 빗나가는 결과를 보였다. 또한 일부 학자들의 셀룰로오스의 결정화가 셀룰로오스의 가수 분해에 부정적인 영향을 미친다는 것을 증명한 결과에 비추어볼 때 (Yoshida et al., 2008; Zhu et al., 2008) 본 연구의 난분해성 유기물이라 함은 셀룰로오스의 결정화 정도에 따라 리그닌과 함께 혼재한다고 보는 것이 타당해 보인다.
Table 6.
Methane potential and parallel first order kinetics model parameters according to the canabinus of S/I ratio 0.3, 0.5.
결과적으로 케나프는 영양배지를 처리하지 않을 경우 메탄생산퍼텐셜이 매우 낮아 통합 혐기소화 기질로 적합하지 않은 것으로 보인다. 물론 영양배지를 적용할 경우에는 메탄생산퍼텐셜은 상당량 증가하였으나, 상용화 공정의 관점에서 본다면 추가공정이 포함되어야 하며 이는 플랜트 설비 및 운전비용의 상승을 의미하여 케나프의 바이오가스 생산 원료로서의 가치는 높지 않다고 볼 수 있다.
Conclusions
경제성과 생산성이 우수한 케나프를 이용하여 혐기소화 공정을 이용한 바이오가스화 연구를 진행하였으며, 높은 섬유질 함량으로 인해 분해율이 낮은 케나프의 바이오에너지 전환효율을 향상시키기 위하여 접종액에 영양배지를 첨가하였을 때 혐기미생물의 메탄전환 효율을 비교 ‧ 분석하였다. 실험결과, S/I ratio 0.3, 0.5에서 영양배지 무처리구의 생화학적 메탄퍼텐셜은 0.202, 0.181 Nm3 kg-1-VSadded로 유기물 분해율은 45.80, 41.04%이었다. 이는 약 50.13%의 ADF로 인한 낮은 분해율과 긴 지체성장기의 영향으로 판단된다. 이러한 결과는 ADF의 함량이 약 62.91%인 거대억세의 메탄퍼텐셜을 분석한 Yoo et al. (2017)의 연구에서 S/I ratio 0.3, 0.5일 때, 43.40 - 48.00%의 분해율을 보인 결과와 유사하게 나타났다. 케나프의 낮은 메탄전환율을 증가시키기 위해 영양배지를 처리한 실험에서 생화학적 메탄퍼텐셜은 0.313, 0.253 Nm3 kg-1-VSadded이었다. 영양배지를 처리할 경우 S/I ratio 0.3, 0.5에서 유기물 분해율은 25.17, 16.33% 증가 되었으며, Modified gompertz model를 이용한 분석결과에서 지체성장기 역시 영양배지 무처리에서 4.40, 5.64 day에서 0.07, 0.93 day로 단축되었다. Parallel first order kinetics model을 이용한 분석은 영양배지 처리구가 미처리구에 비해 S/I ratio 0.3, 0.5에서 이분해성 유기물이 12.70, 10.70% 증가하였고, 분해저항성 유기물이 12.15, 12.33% 증가하였다. 이러한 결과는 셀룰로오스계 바이오매스의 혐기소화 효율 증진을 위해 섬유소 분해균 첨가와 미생물 영양배지를 첨가했을 때, 기존보다 메탄 생산량이 증가한 Kim et al. (2012)의 연구와 유사하게 나타났다.
본 연구결과, 영양배지 첨가로 인해 혐기미생물 중 섬유질을 분해하는 미생물의 에너지 전환 효율이 증가한 것으로 판단된다. 따라서 케나프를 이용하여 바이오가스화를 시키기 위해서는 다양한 전처리를 통한 분해가 어려운 난분해성 물질인 섬유질 물질의 가용화와 지체성장기를 단축하여 바이오에너지를 회수할 수 있는 추가적인 연구가 필요할 것으로 판단되었으나, 상용화 공정에서의 추가 공정이 필요하다는 점에서는 케나프의 바이오가스 기질로서는 적합하지 않는 것으로 보인다.