Introduction
Materials and Methods
Biologically produced sulfur (BPS)의 특성
Batch adsorption experiments
Adsorption isotherm
Adsorption kinetics
Results and Discussion
pH와 흡착제 사용량, 이온 세기에 따른 Pb 흡착
Adsorption isotherms
Adsorption kinetics
Adsorption mechanism
Conclusions
Introduction
중금속은 환경의 질과 인간의 건강을 위협하는 물질로 특히, 토양과 물의 중금속 오염은 전 세계적인 환경문제이다. 일반적으로 중금속은 자연적 혹은 인위적인 원인에 의해 토양과 수계로 유입되고 이로 인해 중금속의 토양 및 수질 기준을 초과하는 경우가 발생한다. 이 중 납 (Pb)은 카드뮴 (Cd)이나 비소 (As) 보다는 독성이 낮지만, 산업분야에서 광범위하게 사용되고 있어 배출량이 많은 중금속이다 (Mazaheri et al., 2015; Choi, 2016). Pb는 국제암연구소 (international agency for research on cancer, IARC)의 분류기준에 따라 2B (possibly carcinogenic to humans)에 속하는 물질이며, 신장과 면역체계, 신경조직에 심각한 손상을 가져온다 (Choe, 2007). 이에 Pb에 대한 법적 기준을 충족하기 위해 농경지 토양의 경우 안정화제를 이용한 흡착 및 침전 공정, 수질의 경우 화학적 침전, 이온 교환, 막 여과 및 흡착과 같은 다양한 공정이 활용되고 있다 (Kim et al., 2010; Azzam et al., 2016; Carolin et al., 2017). 이 중 흡착제를 사용한 정화 기법은 효율성이 높으며 조작이 용이하여 활성탄, 바이오차 및 천연 재료와 같은 다양한 흡착제가 수용액에서 중금속 이온을 제거하기 위한 연구에 사용되었다 (Hua et al., 2012; Hydari et al., 2012; Choi, 2016; Inyang et al., 2016; Carolin et al., 2017; Tang et al., 2018). 이 중 비표면적이 큰 활성탄이 주로 사용되고 있었으며, 최근 활성탄 대비 오염물질과의 높은 반응성과 큰 표면적으로 다양한 종류의 나노 물질을 사용한 연구도 소개되고 있다 (Azzam et al., 2016; Das et al., 2017; Li et al., 2018a). 그러나 이런 물질들은 고비용, 높은 에너지 소비, 독성 용매 및 물질 사용에 의한 폐수 처리 문제로 사용상 한계점이 있다고 보고되고 있다 (Dias et al., 2007; Wang et al., 2014; Queiroz et al., 2020). 이에 비용이 저렴하며, 효율이 높고 환경 친화적인 신규 흡착제 개발의 중요성이 커지고 있다.
매립지에서 발생하는 황화수소 (hydrogen sulfide, H2S)는 악취가 나는 독성가스로 대기 방출을 저감하기 위해 1차 화학적 (Eq. 1) 및 2차 생물학적 (Eq. 2) 탈황 처리 과정을 통해 생성된 황 (biologically produced sulfur, BPS)으로 전환하는데, 이때 원소 황 (elemental sulfur) 입자를 포함해 황화물이 일부 존재한다 (USEPA, 2004; Heo et al., 2018). 이렇게 생성되는 BPS는 연간 우리나라의 수도권 매립지에서 약 10,000톤에 달하는 것으로 추정되며, 향후 발생량은 더 증가할 것으로 예상되고 있다 (Kim et al., 2021). 따라서 다량으로 발생되는 BPS에 대한 재활용 방안 마련이 시급하다.
Hard and soft acids and bases (HSAB) 이론에 따르면 soft Lewis acids는 soft Lewis bases와 반응하는 것을 선호하며, Pb을 비롯한 여러 중금속이 soft Lewis acids로 분류된다 (Wingenfelder et al., 2005). 최근 선행 연구에서 황화물 (SH)이나 유기황화합물인 thiol groups (R-SH)과 같이 Lewis bases를 이용한 화학적 흡착반응을 이용하여 중금속 제거효율 향상을 위한 방법들이 제시되고 있다 (Xia et al., 2017; Lv et al., 2018; Tang et al., 2018). Pb를 대상으로 한 실험으로는 Liang et al. (2009)이 thiol기를 silica에 적용하여 Pb에 대한 제거 효율을 향상시켰으며, Li et al. (2018b)는 열분해한 하수슬러지 활성탄에 thiol 작용기를 적용한 결과 최대흡착량이 238.1 mg g-1로 Pb 흡착제로의 활용가능성을 확인하였다. 또한, amino기와 thiol기를 각각 활성탄에 적용하여 Pb 흡착실험을 수행한 결과 thiol기를 적용하였을 때 최대흡착량이 232.02 mg g-1로 amino기 처리한 것보다 1.6배 높았다 (Tang et al., 2018). 이처럼 BPS에 존재하는 NaHS 같은 황화물은 HSAB 원리에 따라 Pb 이온과 빠르고 강한 흡착이 이뤄질 것으로 판단되며, 결과적으로 Pb 제거를 위한 실용적인 흡착제로서 BPS의 활용이 가능할 것이다. 또한, 매립지 탈황 공정에서 발생한 고형 부산물을 재활용하는 것이기 때문에 경제적이고 환경친화적이다. 더욱이 현재 BPS는 2018년도부터 농림축산식품부의 유기농업자재로 공시되어 있어 중금속 흡착 능력이 입증 된다면 중금속 오염 농경지 토양 안정화제로 활용 가능할 것으로 사료된다.
이에 본 연구에서는 배치 흡착 실험을 통해 BPS의 Pb 흡착 능력과 메커니즘을 알아보고, 흡착 등온선 및 동역학 매개변수로 평가된 BPS의 Pb 제거 효율을 과립 활성탄 (granular activated carbon, GAC)과 비교하였다.
Materials and Methods
Biologically produced sulfur (BPS)의 특성
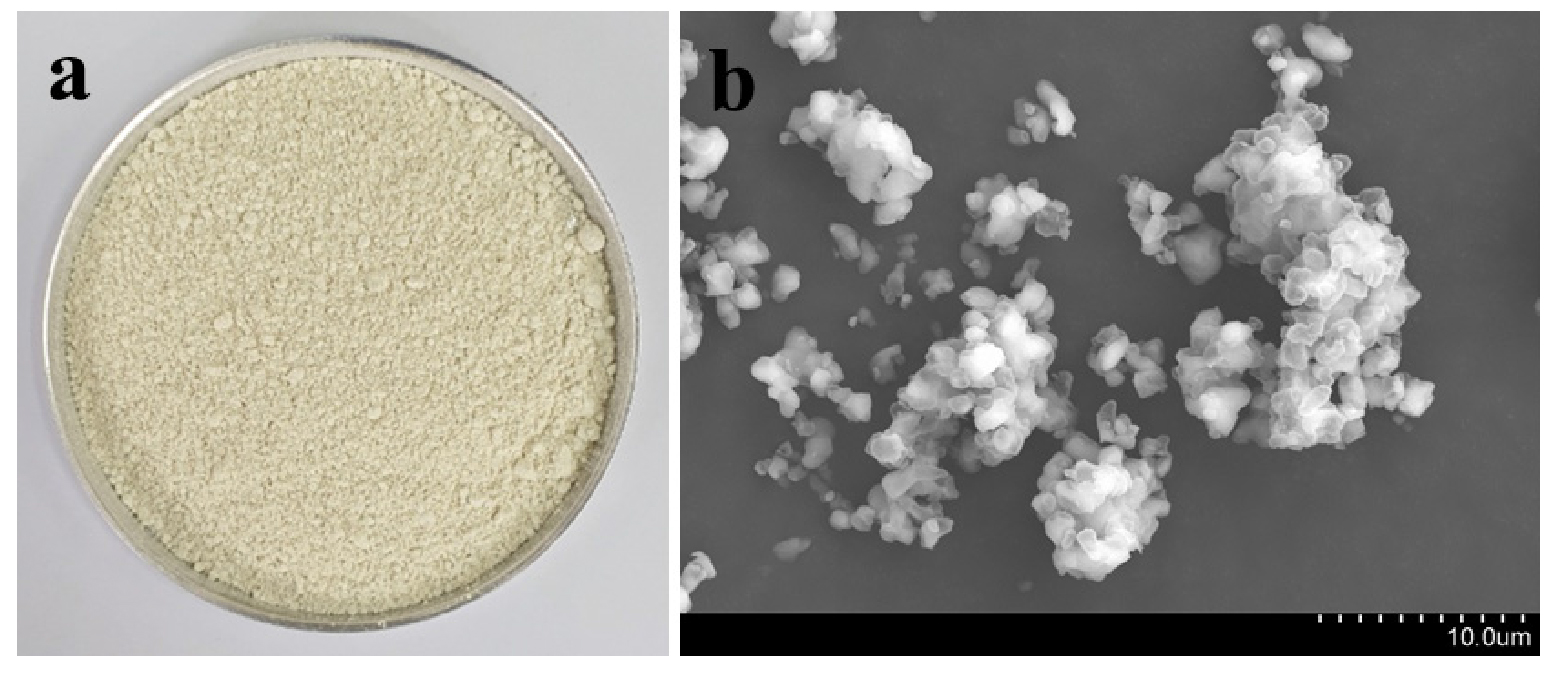
본 연구에 사용한 BPS는 수도권매립지 황화가스 탈황공정에서 발생한 슬러지 상태의 원료 물질을 E사로부터 공급받아 원심분리 후 고체 BPS를 60°C의 오븐에서 48시간 건조한 뒤 1 mm 체거름한 것을 실험에 사용하였다. BPS는 밝은 노란색을 띄고 있었고, 약간의 황화물 냄새가 나는 특성을 지니고 있었으며, 주사전자현미경 (scanning electron microscope, S-4800, Hitachi, Japan)으로 관찰한 표면은 매끄러운 입자 형태를 나타냈다 (Fig. 1). BPS의 원소 조성은 S이 81.8%로 대부분을 차지하고 있었으며, Kim et al. (2021)에 따르면 본 연구에서 사용한 BPS의 XPS 스펙트럼 분석결과 S 원소, 황산화물, 무기 황화물 (S2-)에 해당하는 피크가 검출된 것으로 나타났다.
Batch adsorption experiments
BPS를 이용한 Pb2+ 제거 실험을 위해 흡착 실험을 수행하였다. Pb2+ 수용액은 Pb(NO3)2 (MW: 331.21 g, Wako, Osaka, Japan)을 사용하였으며, 흡착 실험은 pH와 흡착제 사용량, 이온강도, Pb2+ 농도, 반응시간을 여러 조건으로 처리하여 수행하였다 (Table 1). Pb2+ 수용액의 pH는 0.1 M HNO3과 NaOH 용액을 이용해 보정하였고, 이온 세기 조정은 KCl 용액을 사용하였다. 흡착 실험은 처리 조건에 맞춰 BPS와 Pb2+수용액을 혼합 후 항온교반기 (JEIO TECH, SI-600R, Korea: 25°C, 150 rpm)에서 처리별 시간에 따라 교반 후 0.45 µm membrane filter로 여과하였다. 과립 활성탄 (GAC, 8 - 20 mesh, Sigma-Aldrich, St. Louis, Missouri, USA)도 BPS와의 흡착 효율 비교를 위해 동일한 조건으로 실험을 수행하였다. 실험 후 여액의 Pb2+ 함량은 유도결합플라즈마 분광분석기 (ICP-OES, iCAP 6300 duo, Thermo Fisher Scientific, Waltham, Massachusetts, USA)로 분석하였다. 평형상태에서의 Pb2+ 제거율 (R; %)과 제거량 (qe; mg g-1)은 Eq. 3과 Eq. 4로 계산하였다.
여기서, C0와 Ce는 각각 초기와 평형상태의 Pb2+ 농도 (mg L-1)이며, V는 수용액의 용량 (mL), m은 흡착제의 질량 (mg)이다. 모든 실험은 3반복으로 수행하였고, 평균값을 사용하였다.
Table 1.
Descriptions for conditions of the batch adsorption experiments.
Pb 흡착에 의한 표면 조성과 종 분리 변화를 관찰하기 위해 X선 광전자 분광기 (XPS, K Alpha+, Thermo Scientific, Loughborough, UK) 를 이용하여 흡착 실험 전, 후 BPS의 표면 특성을 분석하였다.
Adsorption isotherm
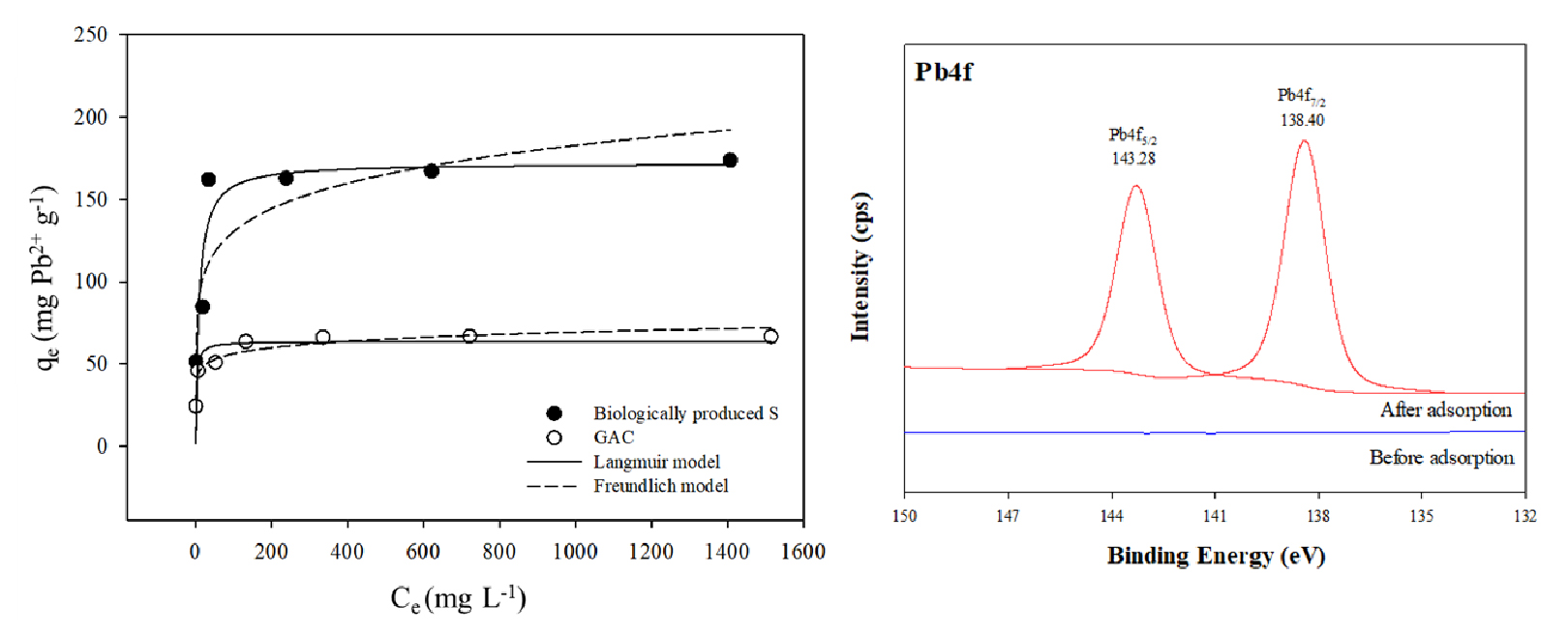
BPS의 Pb 흡착 능력과 메커니즘을 평가하기 위해 Langmuir (Eq. 5)와 Freundlich (Eq. 6) 모델식을 Pb2+ 농도별 BPS 및 GAC 흡착실험 결과에 적용하였다.
여기서, qe는 평형 상태에서 흡착된 Pb의 양이며 (mg g-1), Qm은 최대흡착용량 (mg g-1), Ce는 용액에서 Pb2+의 평형농도 (mg L-1), b는 흡착의 자유 에너지와 관련된 Langmuir 상수, Kf는 Freundlich 모델의 흡착 용량 및 강도와 관련된 상수, 1/n은 상수이다. 흡착 모델에 대한 실험결과의 적합도는 높은 결정계수 (R2)로 평가하였다.
Adsorption kinetics
BPS의 Pb2+ 흡착 kinetic을 평가하기 위해 반응 시간별 BPS 및 GAC의 Pb2+ 흡착실험 결과에 pseudo-first order, pseudo-second order 및 double-exponential model을 적용하였다. 각각의 모델식을 살펴보면 pseudo-first order kinetic model은 Eq. 7과 같다 (Shen et al., 2017):
여기서, qe (mg g-1)와 qt (mg g-1)는 평형과 반응시간 (t, min)에서의 흡착 용량이며, K1 (min-1)은 pseudo-first order 속도 상수이다.
Pseudo-second order kinetic model은 Eq. 8과 같다 (Shen et al., 2017):
여기서, K2 (g mg-1 min-1)는 pseudo-second order의 반응속도 상수이다.
Double-exponential kinetic model은 Eq. 9와 같다 (Chiron et al., 2003):
여기서, mads (g L-1)는 수용액의 흡착제 양이며, D1 (g L-1)과 D2 (g L-1)는 각각 빠른 반응과 느린 반응의 흡착속도상수이다. KD1와 KD2 (min-1)는 double exponential 속도상수이다.
위 세 가지 모델식에 대한 데이터의 적합도는 높은 결정계수 (R2)와 낮은 RMSE (low root mean square error)로 판정하였다 (Eq. 10).
여기서, qi,exp 및 qi,cal은 각각 흡착 용량의 실험과 모델식에서 계산된 값이고 N은 실험 횟수이다.
Results and Discussion
pH와 흡착제 사용량, 이온 세기에 따른 Pb 흡착
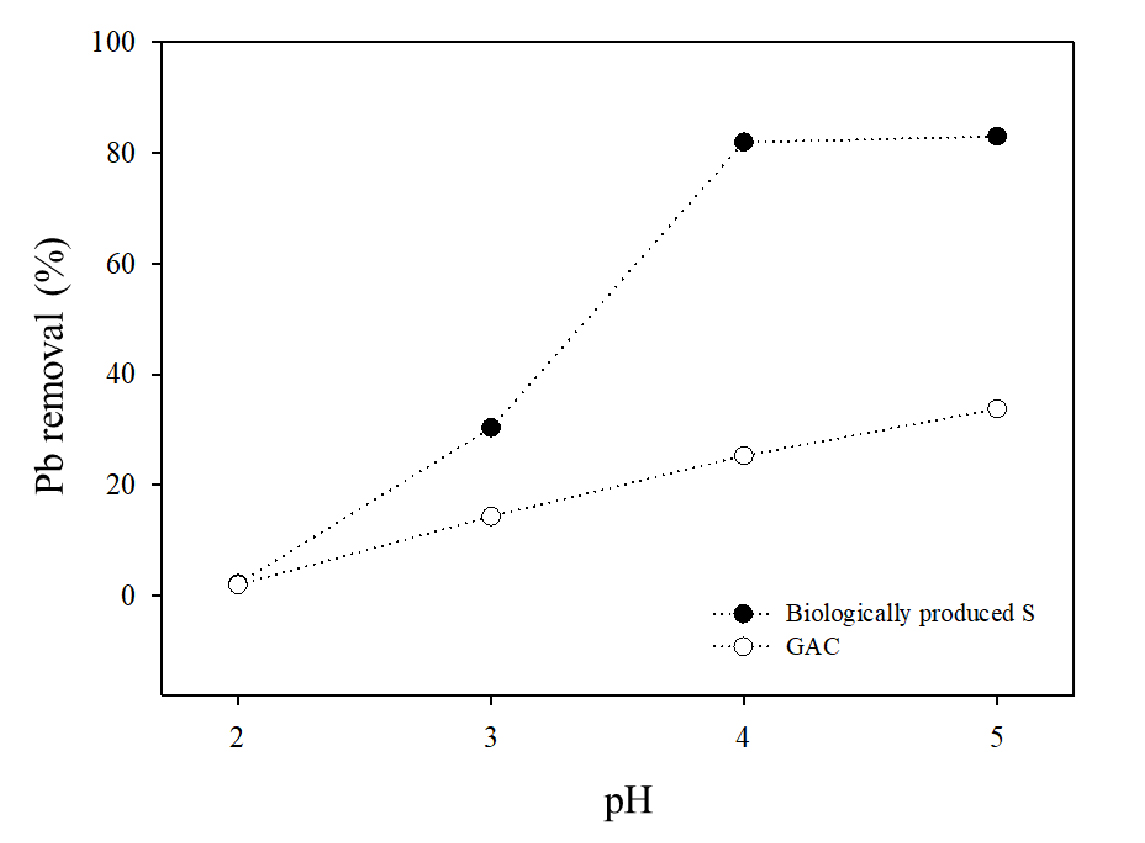
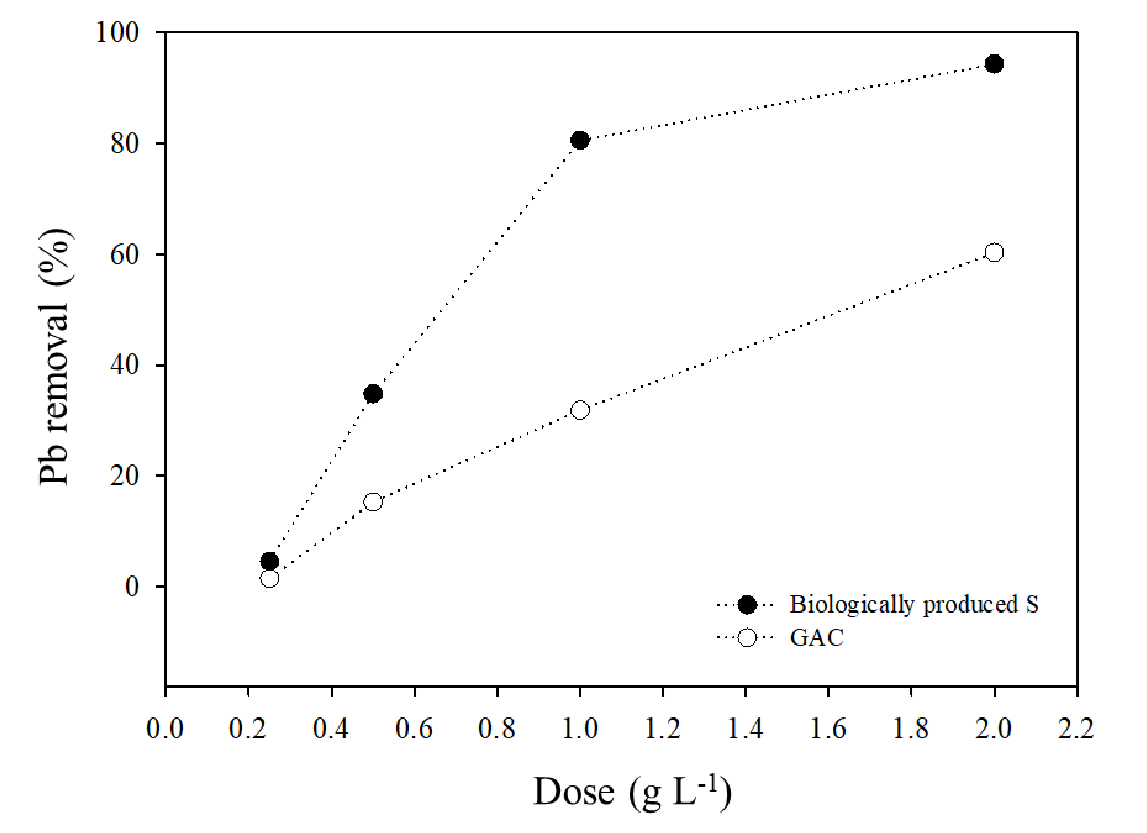
용액의 pH는 중금속의 화학종의 변화와 흡착제의 표면 전하 변화에 유의미한 영향을 준다 (Dragan et al., 2014). 본 연구에서도 수용액의 pH를 2에서부터 5까지 조절하면서 실험을 수행한 결과, BPS와 GAC 모두 pH 2에서는 1% 미만의 제거율을 보였으며 이후 pH가 증가함에 따라 Pb2+ 제거율이 증가하는 경향을 보였다 (Fig. 2). BPS는 pH가 4와 5일 때 제거율 (80%)이 가장 높았으며, 이처럼 pH 증가에 따른 Pb2+ 제거율의 상승은 흡착제의 표면 음전하의 증가와 NaHS 같은 황화물로부터 수용액의 S2+ 농도의 증가에 따른, PbS 침전물 형성에 의한 것으로 판단된다 (Janssen et al., 1999; Gharabaghi et al., 2012). GAC와 BPS의 Pb2+제거율을 비교하면 pH 2를 제외하고 모든 처리구에서 BPS가 높았고, pH 4에서는 3배, pH 5에서는 2.5배 높았다. 흡착제의 양을 다르게 처리한 실험결과, 흡착제의 양이 증가함에 따라 제거율이 상승하여 BPS 2 g L-1을 처리한 처리구는 약 94%의 Pb2+가 제거되었다 (Fig. 3). GAC는 2 g L-1을 처리하였을 때 Pb2+를 60% 제거하는 것으로 나타났다 (Fig. 3). 이처럼 수용액 중 흡착제 양의 변화는 흡착제 이온과 흡착되는 물질과 흡착제의 흡착 지점 간의 상호작용에 변화를 일으키고 이로 인해 흡착 과정에 영향을 미쳤기 때문이다 (Li et al., 2015). 결과적으로 동일한 pH 및 흡착제 처리량에서 BPS가 GAC 보다 Pb2+ 제거율이 높았다. 그리고 본 실험을 통해 얻은 BPS의 흡착 효율을 고려하여 후속 배치 실험의 실험 조건 (Table 1)을 수용액의 pH는 5로 흡착제 처리 농도는 1 g L-1로 설정하였다.
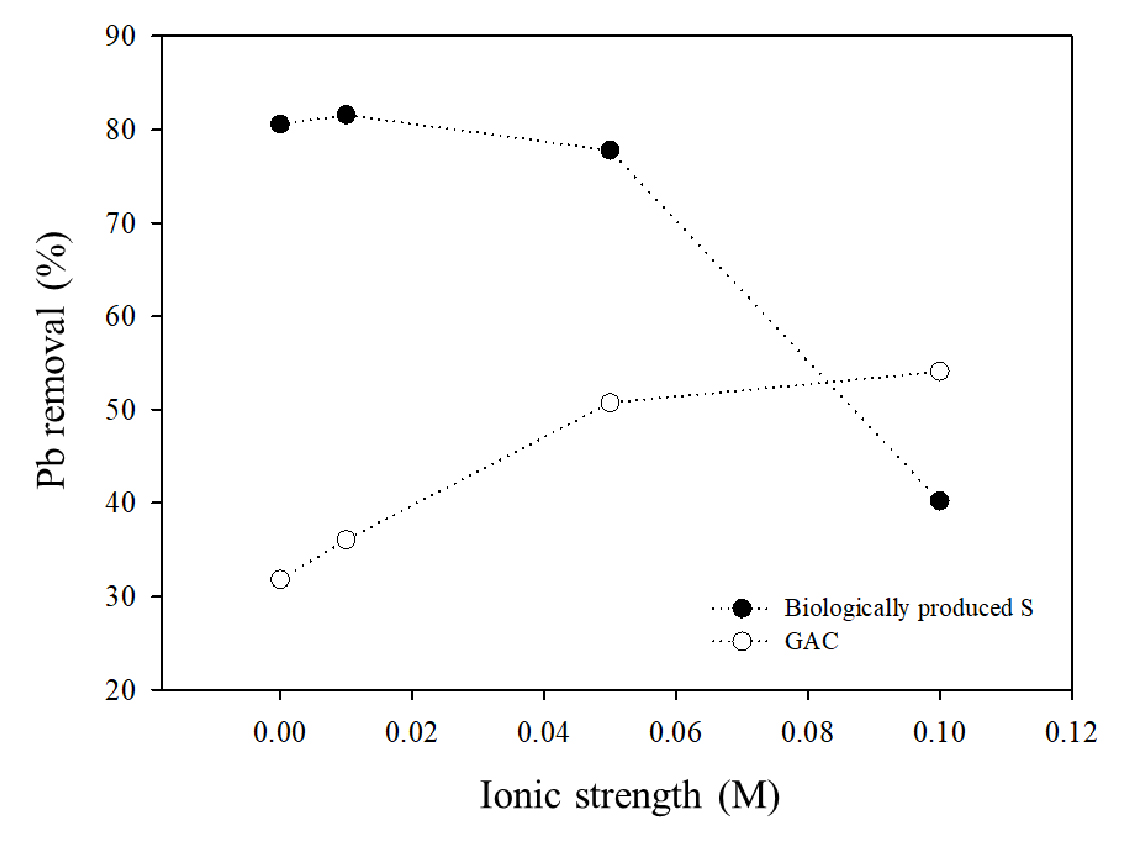
BPS의 이온 세기에 따른 흡착 반응은 Fig. 4와 같이 KCl 농도가 0 M에서 0.1 M로 증가함에 따라 선형적으로 Pb2+ 제거율이 감소하는 것을 확인할 수 있었다. 이는 BPS가 전해질이 가해지면 입자가 뭉쳐지는 콜로이드의 특성을 나타내기 때문이며 (Janssen et al., 1999), 이온 강도의 증가하면서 BPS의 전기이중층 (electrical double layer)을 가려 제거효율이 감소하는 것으로 판단된다 (Kim et al., 2021). 하지만 반대로 탄소계 흡착제인 GAC는 이온강도가 증가하면서 표면의 전기이중층이 압축되면서 Pb2+의 제거율이 일정 수준 증가한 것으로 나타났다 (Boudrahem et al., 2009).
Adsorption isotherms
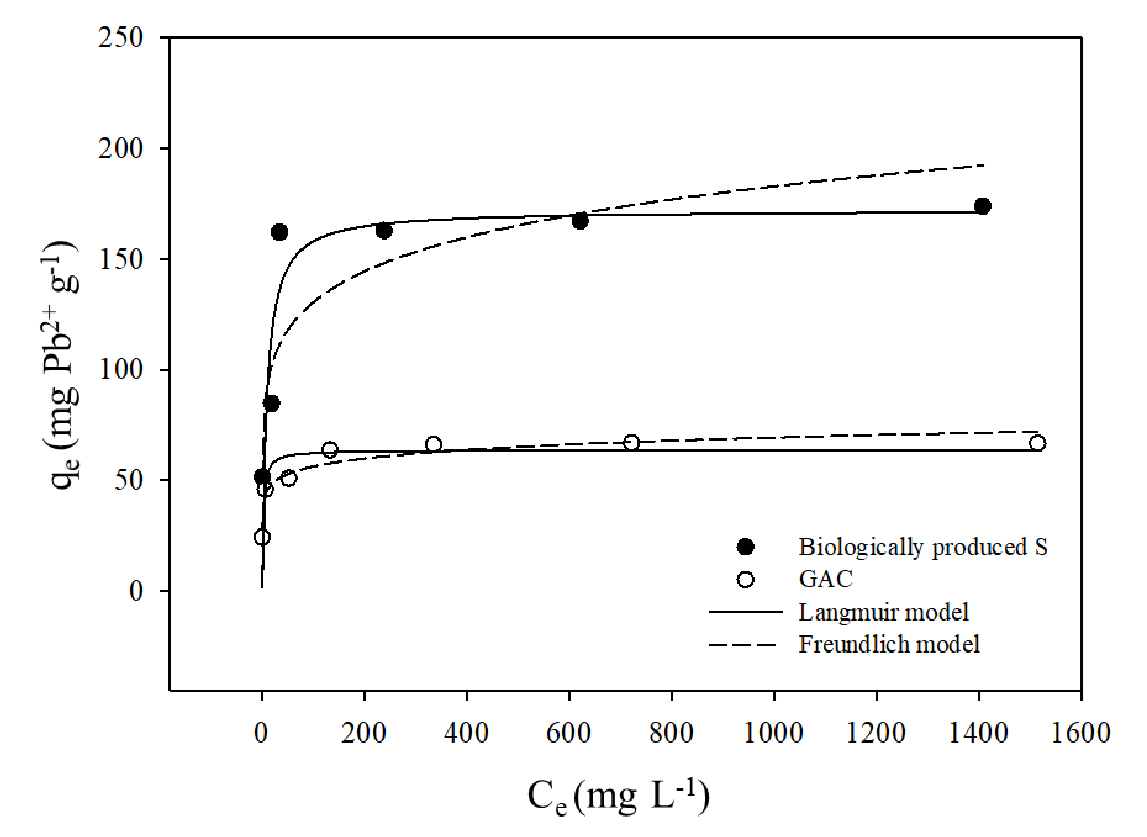
BPS와 GAC의 흡착능을 알아보기 위해 Langmuir와 Freundlich 등온흡착식에 적용하여 등온선과 매개변수를 산출하였다 (Fig. 5, Table 2). 결정계수 (R2)로 봤을 때 BPS에 대한 Pb2+의 흡착은 Freundlich (R2 = 0.878)보다는 Langmuir 등온선 (R2 = 0.999)이 잘 맞는 것으로 나타났다. 이는 Pb2+가 BPS의 단층 흡착 사이트에 분포할 가능성을 보여준다 (Veloso et al., 2020). BPS는 GAC보다 Pb2+를 상대적으로 많이 흡착했으며 최대 흡착량은 175.4 mg g-1로 GAC의 최대 흡착량 (67.1 mg g-1)보다 약 3배 많았다. 또한, BPS의 최대 Pb2+ 흡착 용량은 이전 연구에서 보고된 다른 많은 일반적인 흡착제와 유사하거나 더 높았는데 (Table 3), 이는 BPS가 Pb2+ 제거를 위한 효율적인 흡착제로 활용될 수 있음을 보여주는 결과로 판단된다.
Table 2.
Adsorption parameters of Langmuir and Freundlich isotherm models by the BPS and GAC.
| Adsorbent | Langmuir model | Freundlich model | ||||
| Qm (mg g-1) | b (L mg-1) | R2 | Kf (mg g-1) | 1/n | R2 | |
| BPS | 175.44 | 0.10 | 0.999 | 48.88 | 0.21 | 0.878 |
| GAC | 67.11 | 0.17 | 0.999 | 34.71 | 0.10 | 0.954 |
Table 3.
Comparisons of Pb2+ adsorption capacities by various adsorbents.
| Adsorbents | qe (mg g-1) | References |
| Agave Bagasse | 93.1 | Cholico-Gonzalez et al. (2020) |
| Apple pomace | 16.4 | Cholico-Gonzalez et al. (2020) |
| Cedar leaf ash | 7.2 | Hafshejani et al. (2015) |
| Walnut shell | 31.2 | Almasi et al. (2012) |
| S. Oleasea bark | 69.4 | Khatoon et al. (2018) |
| Quercus mongolica | 23.5 | Choi et al. (2021) |
| Activated alumina | 83.3 | Naiya et al. (2009) |
| Amino-functionalized activated carbon | 142.0 | Tang et al. (2018) |
| Thiol-functionalized activated carbon | 232.0 | Tang et al. (2018) |
| Thiol-functionalized cellulose nanofiber membrane | 22.0 | Choi et al. (2020) |
| Thiol-functionalized silica | 117.5 | Liang et al. (2009) |
| Thiol-functionalized activated carbon from sewage sludge with coal | 238.1 | Li et al. (2018b) |
| Zeolite-supported nanoscale zero-valent iron | 85.4 | Li et al. (2018a) |
| Granular activated carbon | 67.1 | This study |
| Biologically produced sulfur | 175.4 | This study |
Adsorption kinetics
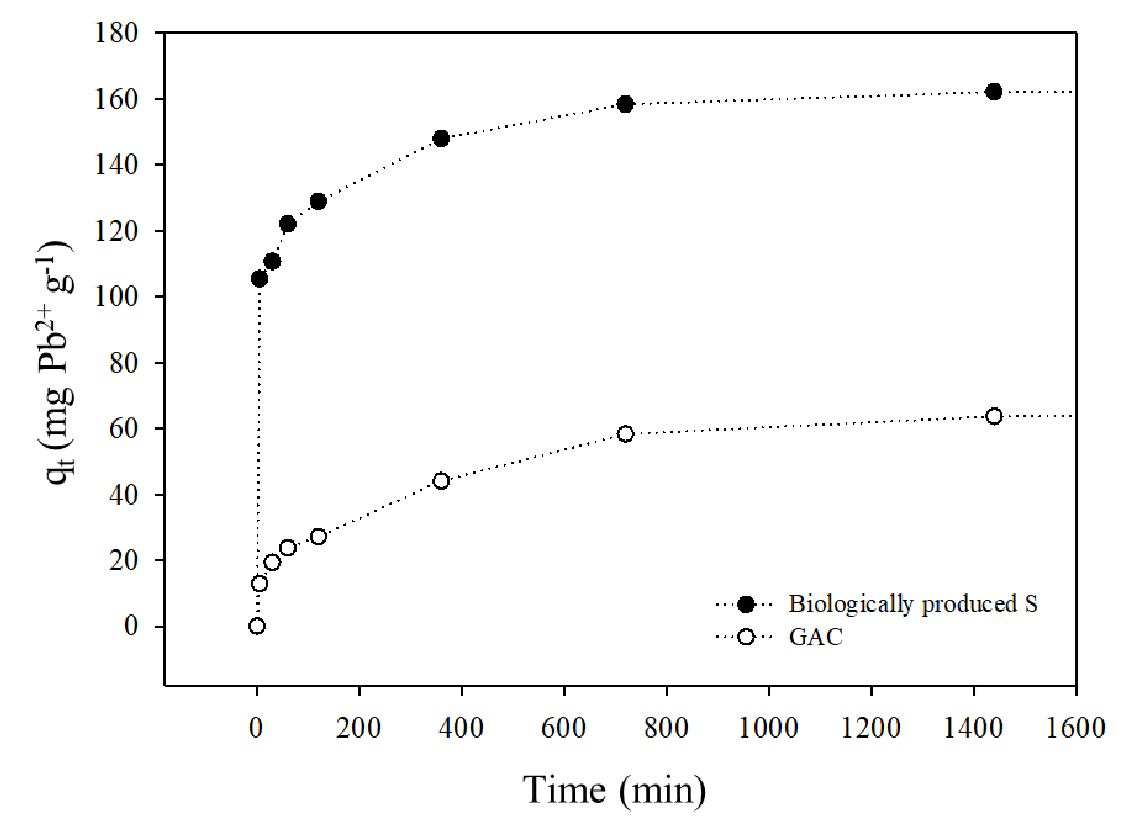
흡착 시간에 따른 BPS에 대한 Pb의 흡착 반응은 반응 초기 매우 빠르게 발생하여, 약 54.5%의 Pb2+를 5분 만에 흡착·제거하였고, 이후 유사 평형 (162.14 mg Pb2+ g-1)에 도달할 때까지 점진적으로 증가하였다 (Fig. 6). 그러나 GAC는 5분 이내에 6.5%만 제거하였다. 중금속 제거 공정에 관한 모델링 및 설계는 흡착 속도 및 메커니즘을 기반으로 한 흡착 kinetic 매개변수에 의존한다 (Jang et al., 2018). 이에 실험 결과를 바탕으로 pseudo-first order, pseudo-second order 및 double-exponential model의 kinetic 매개변수를 도출하였고 (Table 4), 높은 결정계수와 낮은 RSME에 기초하여 double-exponential model이 BPS에 대한 Pb 흡착 kinetic에 가장 적합한 것으로 나타났다 (Table 4). 이는 BPS의 Pb 흡착 과정이 double-exponential model의 두 가지 속도 상수 (KD1와 KD2)에 따라 초기의 빠른 흡착과 초기 이후 느린 흡착 두 단계로 진행이 된다는 것을 의미한다. 또한, BPS가 반응 초기의 Pb와 빠른 흡착 반응을 보이는 것은 BPS의 표면의 음 전하와 황화물 작용기 (soft Lewis base)에 대한 Pb (soft Lewis acid)의 강한 화학적 흡착의 결과인 것으로 판단된다 (Janssen et al., 1999; Gharabaghi et al., 2012; Tang et al., 2018). 그리고 반응 초기 이후 흡착 속도가 느려진 것은 초기 빠른 흡착 반응으로 BPS 표면에 남아 있는 흡착 사이트가 감소하였기 때문인 것으로 판단된다 (Kim et al., 2021).
Table 4.
kinetic-model parameters for Pb2+ adsorption onto biologically produced sulfur.
Adsorption mechanism
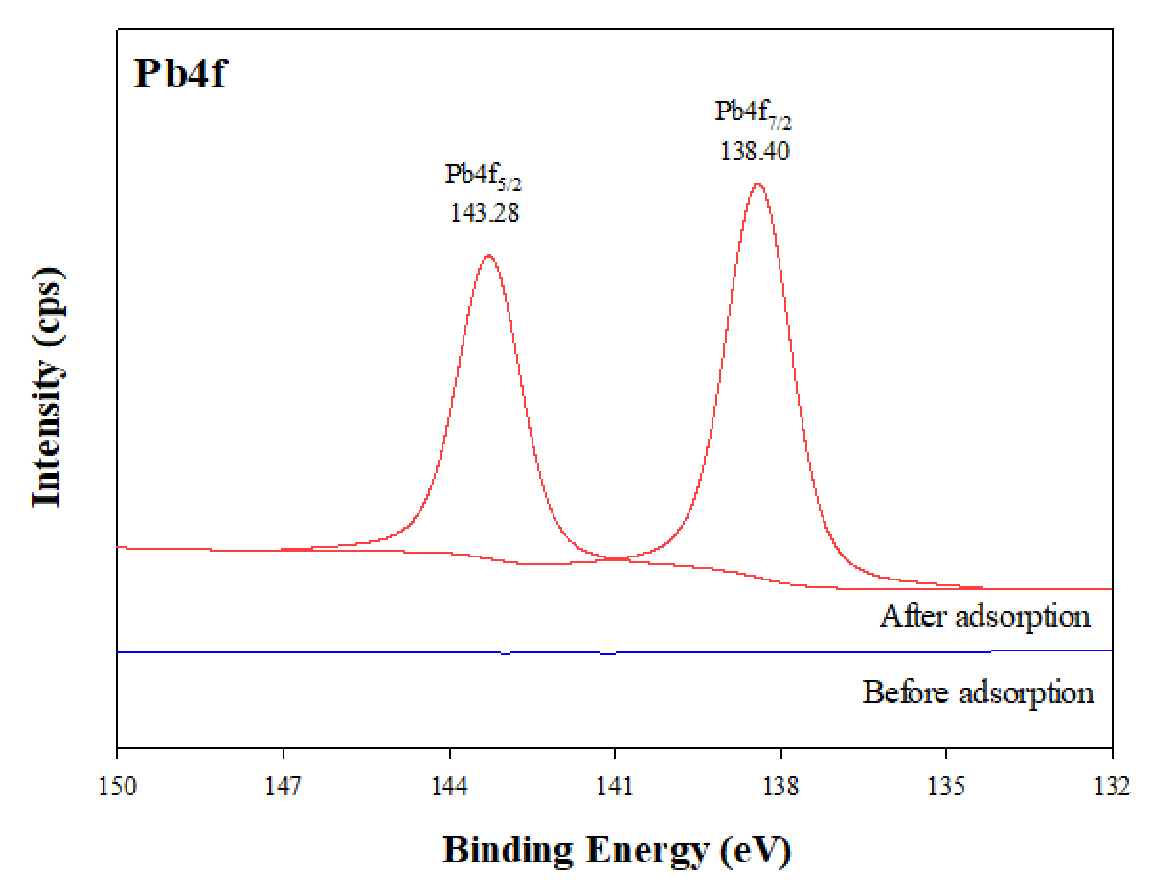
BPS의 Pb2+ 제거 메커니즘을 알아보기 위한 실험 전, 후 BPS의 XPS 분석결과는 Fig. 7과 같다. 실험 전 BPS에서는 검출되지 않던 Pb4f에 대한 피크가 실험 후 BPS에서 관측되었다. 특히, Pb 4f5/2와 Pb 4f7/2의 결합에너지는 143.28 eV와 138.40 eV로 이는 전형적인 PbS 복합체의 에너지로 알려져 있다 (Liang et al., 2009; Jawad et al., 2017; Li et al., 2018b). 즉, BPS에 대한 Pb2+ 흡착 매커니즘은 BPS 표면에서 황화물과 Pb2+이 반응하면서 PbS 복합체를 형성에 기인한 것으로 판단된다.
Conclusions
매립지 가스 탈황 공정에서 생성된 BPS의 표면 특성과 동역학 반응 메커니즘 분석결과 Pb에 대한 우수한 흡착제인 것으로 나타났고, 비교실험을 위해 사용한 대표적인 흡착제인 GAC보다 BPS의 제거 효율이 더 좋았다. BPS는 Pb 흡착 시 Pb 화합물 중 안정한 형태로 존재하는 Pb-S 복합체로 결합했고, 동역학 반응결과에서 빠른 속도로 이들 복합체를 형성하는 것으로 나타났다. 이에 BPS는 HSAB 원리에 따라 중금속으로 오염된 토양 및 폐수를 안정화 또는 정화를 위한 새로운 흡착제로 널리 사용될 수 있을 것으로 판단된다.