Introduction
Materials and Methods
시험구 시비 관리 및 토양시료 채취
메탄 산화능 평가
토양 화학성 분석
토양 DNA 추출 및 qPCR
통계 분석
Results and Discussion
시비별 메탄 산화능 평가
토양 세균 군집의 풍부도, 다양성, 세균과 메탄산화균 밀도 분석
토양 세균 및 메탄산화균 군집 분포 특성
토양 화학성
Conclusions
Introduction
이산화탄소 (CO2), 메탄 (CH4), 아산화질소 (N2O)는 농업에서 배출되는 주요한 온실가스이며, 그 중 메탄은 이산화탄소 다음으로 강력한 온실기체로 전체 지구온난화의 약 16 - 25%를 차지하고 있다 (IPCC, 2014). 범지구적으로 연간 576 Tg의 메탄이 대기중으로 배출되며 (Saunois et al., 2020), 전체 배출량의 약 70%가 인간활동 (anthropogenic)을 통해 방출된다 (Le Mer and Roger, 2001). 특히 벼 논에서 배출되는 메탄은 인위적인 배출량의 약 15 - 40% (25 - 150 Tg year-1)를 차지하고 있고, 현재 세계적 인구증가 추세에 따라 전 세계의 논 면적은 2018년 167백만 헥타르 (ha)로 1960년 대비 약 39%가 증가하였다 (FAO, 2018). 추후 벼 재배면적 증가로 인해 메탄배출량 또한 크게 증가할 것으로 예상되나, 적극적인 감축 전략 수립과 이에 필요한 메탄 저감 기작에 관한 연구는 여전히 활발하게 이루어지지 않고 있는 실정이다.
현재까지 대기중 메탄을 제거하기 위해서는 대류권 (troposphere)에서 OH∙ 라디칼과 화학반응 (CH4 + OH∙ → CH3∙ + H2)이 일어나거나, 성층권 (stratosphere)에서 염소와 반응을 통해 대기 화학적으로 제거되는 것 (CH4 + Cl∙ → HCl + CH3∙)을 제외하면, 토양에서 메탄을 산화시키는 것만이 유일한 제거 방법이다. 벼 논에서 메탄 저감을 위한 핵심적인 토양관리 전략은 메탄산화균 (methanotrophs)의 활성을 극대화시켜 대기로 배출되는 메탄을 최소화하는 것이다. 일반적으로 논 토양과 같은 혐기조건에서 생성된 메탄의 약 90%가 뿌리와 논표면과 같은 산화층에서 메탄산화균에 의해서 산화된다고 보고된 바 있다 (Frenzel et al., 1992; Oremland and Culbertson, 1992; Le Mer and Roger, 2001).
특히 시비관리 (비료시용, 유기물 관리 등)는 토양 내에서 양분 유효도 및 탄소 기질이용성 (C substrate availability)을 변화시켜 메탄순환 관련 미생물 군집의 활성과 벼 생육 특성에 직 ‧ 간접적 영향을 줄 수 있고 (Le Mer and Roger, 2001), 벼 논에서 질소비료 시용은 메탄순환에 직접적인 영향을 줄 수 있다. 메탄생성적인 측면에서 질소비료의 시용은 질소순환 관련 미생물 중 질산환원미생물 (nitrate-reducing bacteria)의 활성을 증진시켜, 메탄생성균과 토양 내 탄소기질 경쟁을 촉진시킬 수 있기 때문에 전반적인 메탄생성과정이 억제되거나 느려질 수 있다 (Bodelier and Steenbergh, 2014). 추가적으로 탈질과정에서 생성되는 NO2-, NO 등과 같은 중간 생성물이 메탄생성균을 포함한 다른 미생물 군집에 독성을 나타낼 수 있기 때문에 메탄생성량이 직접적으로 감소될 수 있다 (Roy and Conrad, 1999).
반면, 벼 논에서 질소 비료의 시용은 벼 생육을 증가시킬 수 있고, 뿌리 생육 증진을 통해 메탄생성균의 기질인 뿌리삼출물 (exudates), 유기산 등 생성량을 증가시켜 벼 논에서 메탄생성량을 증가시킬 수 있다 (Kim et al., 2016). 메탄산화의 측면에서 질소비료의 시용은 벼 근권 질소가 제한 (limitation)될 때 메탄산화능을 증진시킬 수 있으나, 일반적으로 암모니아태 질소를 시용할 경우 메탄과 기질수준의 경쟁적 저해를 촉진하여, 오히려 메탄산화가 억제될 수도 있다 (Bodelier, 2011). 이는 농경지의 시비관리 방식 등에 따라 토양환경 내 양분 유효도, 기질이용성 뿐만 아니라 벼 생육 특성 등에 의한 다양한 차이에 발생될 수 있고, 이로 인해 메탄산화능에 큰 차이가 있을 수 있어 시비와 관리방식이 일정한 지역을 중심으로 관련 연구가 필요한 실정이다. 또한 시비로 인한 벼 생육 증진으로 인해 근권에서 식물-미생물 상호작용 (plant-microbes interactions)이 심화되어 메탄산화에 관여하는 미생물 (syntrophs)의 활성과 군집 구조에도 직 ‧ 간접적인 영향을 줄 것으로 판단되나 (Ho et al., 2016), 이에 대한 정밀한 평가는 여전히 부족한 실정이다.
본 연구에서는 장기비료연용 논 토양에서 시비관리에 따른 메탄산화능을 실내 실험을 통해 정밀하게 평가하고, 메탄산화균 군집의 정량적 분포 특성과 다양성 및 토양 화학성을 종합적으로 평가하여 메탄산화력을 증진시킬 수 있는 합리적 시비 관리 방안을 모색하고, 기초 연구 자료로 본 연구결과를 활용하고자 하였다.
Materials and Methods
시험구 시비 관리 및 토양시료 채취
시험구는 경상남도 밀양시 식량과학원 남부작물부 영년 동일구 시험 연구 포장에 설치되었으며, 완전 임의배치 3반복으로 설치되었다. 처리구 (10 m × 10 m)는 총 4개로 무비 (control), NPK (무기질), Compost (퇴비단용), NPK + Compost (유무기질 혼용) 각각 설정하였다. NPK와 NPK + Compost 처리구는 농촌진흥청 국립농업과학원 작물별 비료사용처방에 준하여 N-P2O5-K2O (120-80-80 kg ha-1)를 1967 - 1972년까지 동일한 방식으로 시비하였다 (Lee et al., 2013). 이때 질소는 요소, 인산은 과인산석회, 칼리는 염화가리를 사용하여 시용하였고, 1972년부터 현재까지 N-P2O5-K2O (150-100-100 kg ha-1) 수준으로 처리하였다. Compost의 경우 볏짚과 우분을 혼합하여 제조한 퇴비를 10 Mg ha-1 수준으로 처리하였으며, 벼 이앙 전에 표층시비하고 삽을 이용하여 혼합하였다. 본 연구에서 사용된 토양은 2016년 6월 벼 이앙 이전 비담수 상태의 토양을 오우거 시료채취기를 사용하여 표층토 (~15 cm) 부분만을 채취하였으며, 이때 사용된 본 토양의 이화학적 및 생물학적 특성은 Table 1에 나타내었다.
Table 1.
Chemical properties of soils before the experiment.
메탄 산화능 평가
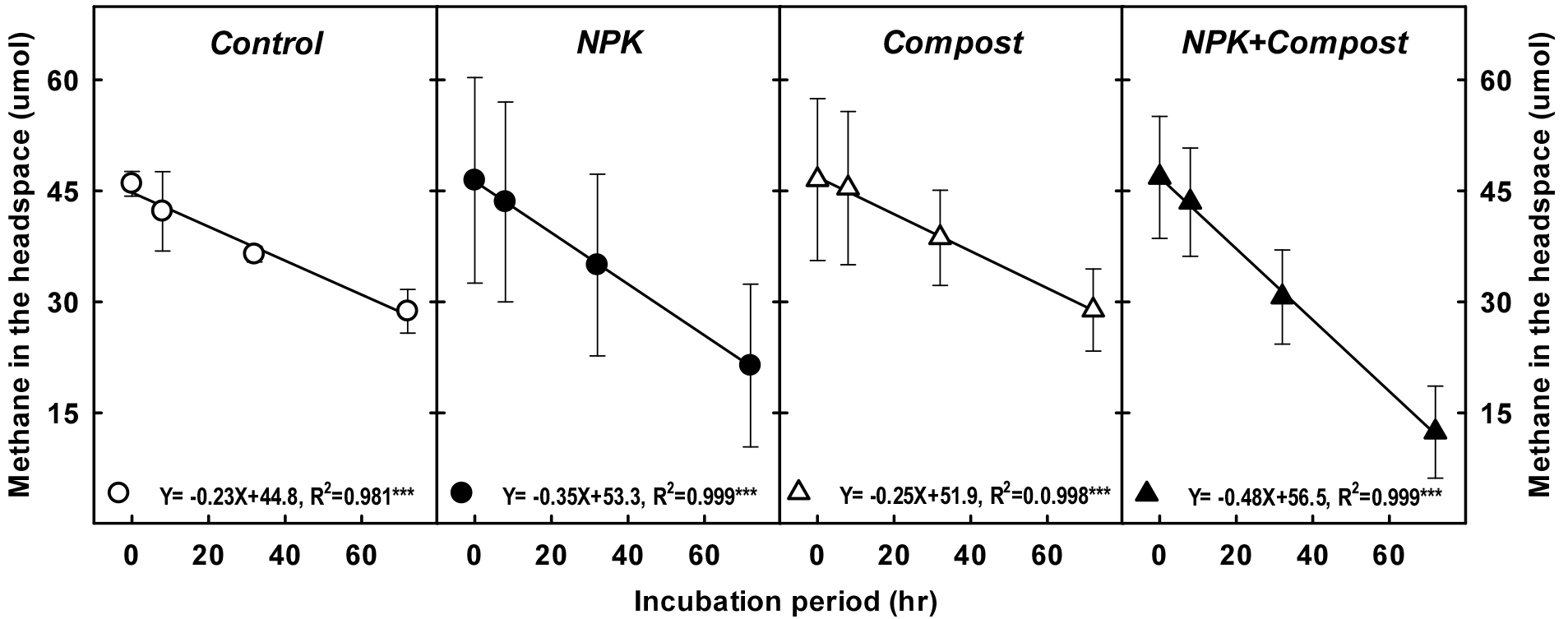
메탄산화능 평가를 위해 슬러리 배양 실험 (slurry incubation)을 수행하였다 (Kim et al., 2015). 2 mm 체에 통과시킨 습토 10 g을 150 mL serum bottle에 넣은 후, 멸균 증류수 10 mL 추가한 후 시료가 균질화 될 때까지 충분히 손으로 혼합하였다. 이후 뚜껑을 막지 않은 상태로 에어컴프레셔를 이용하여 약 1시간 동안 토양에 직접 주입하면서 산소를 공급하였다. Butyl rubber stopper로 뚜껑을 막고, headspace의 최종 메탄농도가 1% (v v-1)가 되도록, 메탄 표준가스 (99.0% v v-1, Sigma-Aldrich, USA)를 syringe를 이용하여 각 병마다 내부로 1 mL씩 내부로 주입한 후 공기를 혼합하였다. 주입 직후 각 병 내부의 headspace 초기 메탄농도를 측정하기 위해 포집한 가스시료는 가스크로마토그래피 (GC-2014, Shimadzu, Japan)를 이용하여 정량 분석하였다 (Choi et al., 2020; Lee et al., 2020, 2021). 이후 배양용 병을 암조건 진탕기로 옮긴 후 상온에서 120 rpm으로 진탕하면서, 총 4회 headspace의 메탄농도를 측정하였으며, 시간별 농도의 감소치를 linear regression curve를 이용하여 추세선을 작성한 후 slope 값을 계산하여 메탄산화능으로 평가하였다. 이때 r값이 0.95 이하인 시료는 재분석하였다.
토양 화학성 분석
채취한 분석용 토양 시료는 그늘에서 건조한 다음 2 mm 체에 통과시켜 화학성 분석에 사용하였다. 토양산도의 경우 토양과 증류수를 1:5 비율로 침출하여 pH meter (Orion stat A212, Thermo Scientific, Indonesia)로 측정하였다. 토양 내 총 탄소와 질소 함량은 원소분석기 (EA2400II, PERKIN ELMER, USA)를 이용하여 정량분석 하였다. 용존유기탄소와 질소 (water extractable carbon and nitrogen)는 습토 3 g에 3차 증류수 30 mL를 넣어 1시간 동안 진탕한 이후, 멜브레인필터로 여과 (0.45 µm, acrodisc syringe filter) 한 다음 여과액을 총유기탄소분석기 (TOC-VCPN, Shimadzu, Japan)로 측정하였다. 양이온치환용량은 Brown 간이법을 이용하여 분석하였다.
토양 DNA 추출 및 qPCR
2 mm체를 통과시킨 습토 0.5 g을 PowerSoil DNA isolation kit (Quiagen, USA)를 사용하여 제조사의 방법을 참고하여 DNA를 추출하였다. 토양 DNA는 NanoDropTM 1000 Spectrophotometer (Thermo Fisher Scientific, USA)을 통해 정량하였다. 토양 내 세균과 메탄산화균을 정량분석하기 위해 SYBR green을 이용한 quantitative PCR (qPCR) 분석을 수행하였으며, 기존 연구에서 사용된 동일한 프라이머 염기서열과 유전자 증폭방식을 사용하여 분석을 수행하였다 (Ho et al., 2015). 유전자의 최적 정량분석을 위해 반응곡선, 증폭효율 및 융해 곡선 분석 등을 통해 최적 조건을 확립하고 실험을 수행하였다.
세균 군집 분포 특성 추출된 토양 DNA 염기서열은 천랩 (Chunlab, Seoul, Korea)에서 Illumina Miseq. platform을 이용하여 분석하였으며, 메탄산화균을 포함한 세균 군집 분포 특성을 기존연구에서 보고된 표준화된 분석방법을 참고하여 동일한 방식으로 분석하였다 (Kim et al., 2020). 증폭구역은 16s rRNA V3-V4 region을 대상으로 하여, 프라이머와 바코드는 341F-805R을 사용하였다 (Fadrosh et al., 2014). 염기서열 분석은 유파스 (UPARSE) 프로그램을 이용하여 OTU 클러스터링을 수행하였으며, 염기서열들은 Mothur (version 1.27.0) 프로그램을 이용하여 정리 후 분석하였다 (Schloss and Handelsman, 2006).
통계 분석
SAS package (SAS Institute Inc., Cary, NC, USA)를 사용하여, 일원분산분석 (one-way ANOVA)을 수행하였다. 시비처리간 통계적인 유의차가 존재할 경우, 사후 분석을 실시하였다. 이때 Tukey test를 이용하여 5% (p ≤ 0.05) 확률의 유의수준에서 시비 처리 간 효과를 비교하였다.
Results and Discussion
시비별 메탄 산화능 평가
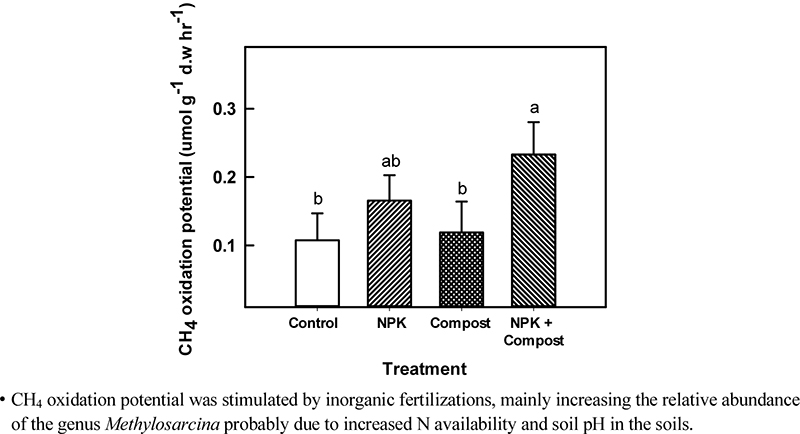
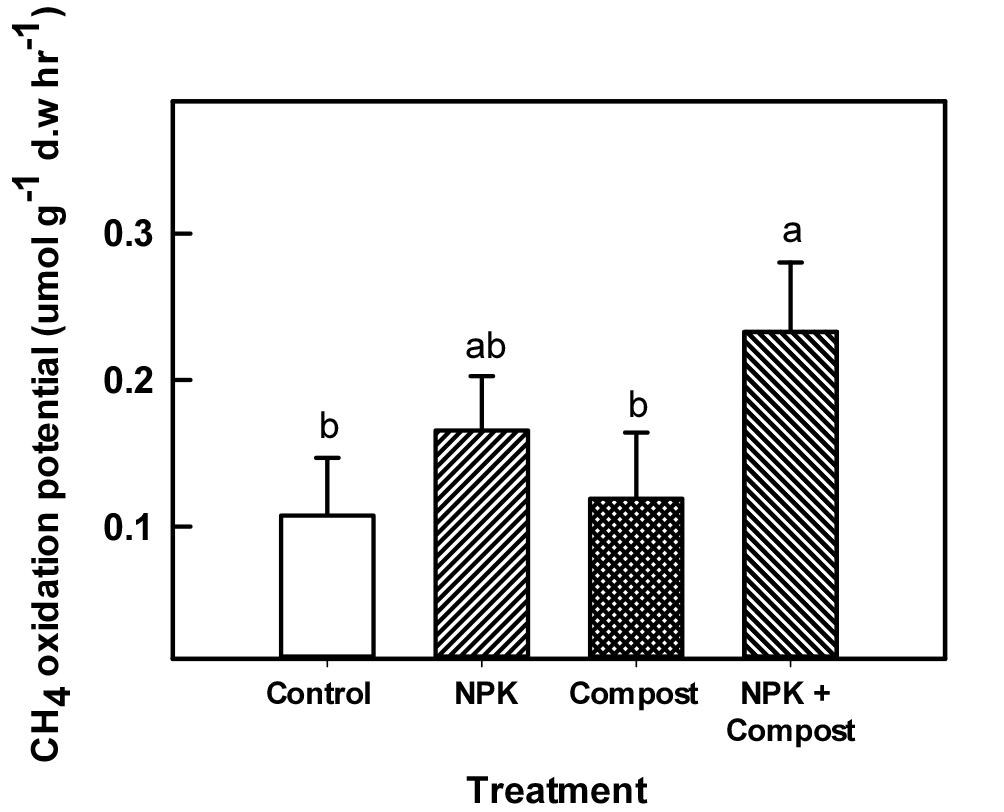
실내 실험을 통해 논 토양에서 장기 시비 관리가 메탄산화능에 미치는 영향을 평가하였다 (Fig. 1, Fig. 2). 시기별로 headspace 내 메탄 농도가 감소하는 기울기를 평가한 결과, Control (-0.23) > Compost (-0.25) > NPK (-0.35), NPK + Compost (-0.48) 순으로 메탄이 빠르게 산화되었으며, 무기질비료 시용구에서 무기질비료 무시용구 (control 및 compost)에 비해 메탄이 더욱 빠르게 산화되었다 (Fig. 1). 시비관리에 따른 논 토양의 전반적인 메탄산화능을 평가한 결과 (Fig. 2), Control에서는 시간당 0.107 umol g-1 d.w 만큼의 메탄이 산화되었고, Compost의 경우 시간당 0.119 umol g-1 d.w 만큼이 산회되는 것으로 조사되었으나, 두 처리간 유의한 차이는 없었다. 공통적으로 무기질비료가 투입된 단용처리구 NPK (시간당 0.165 umol g-1 d.w)와 유무기질비료 혼용처리구인 NPK + Compost (시간당 0.223 umol g-1 d.w)는 Control 대비 약 54%와 118% 메탄 산화능이 각각 증가한 것으로 나타났다.
기존 연구에서 암모니아태 질소 비료시용은 벼 논에서 메탄산화를 억제할 수 있다고 보고된 바 있다 (Bodelier and Laanbroek, 2004). 이는 암모니아태 질소가 메탄과 효소수준에서 기질의 경쟁 증가로 인해 메탄산화효소의 활성이 감소될 수 있기 때문이다. 하지만 본 연구에서는 질소비료 시용에 따라 오히려 메탄산화능이 크게 증가하는 상반된 결과를 확인할 수 있었다. 담수조건인 벼논에서는 토양 내 유무기물질의 하부 용탈이 활발하게 일어날 수 있고, 장기간 벼를 재배할 경우 질소를 포함한 양분 부족현상이 일어날 수 있다 (Peng et al., 2011). 특히 질소비료 시용량이 연간 100 N ha-1 이하인 경우, 질소가 상대적으로 제한될 수 있기 때문에, 비료의 시용은 메탄산화를 촉진시킬 수 있다고 보고된 바 있다 (Bodelier and Steenbergh, 2014; Wei et al., 2016). 따라서 담수 벼 논에서 장기간 비료를 시용하였을 경우 질소비료의 적절한 시용은 메탄산화력을 증진시켜 초기 메탄배출량을 저감할 수 있을 것으로 판단된다. 추후 장기연용 논 포장에서 메탄배출량의 평가를 통해 메탄산화능 증진을 통한 배출량 저감효과를 구명해야 할 것으로 보인다.
토양 세균 군집의 풍부도, 다양성, 세균과 메탄산화균 밀도 분석
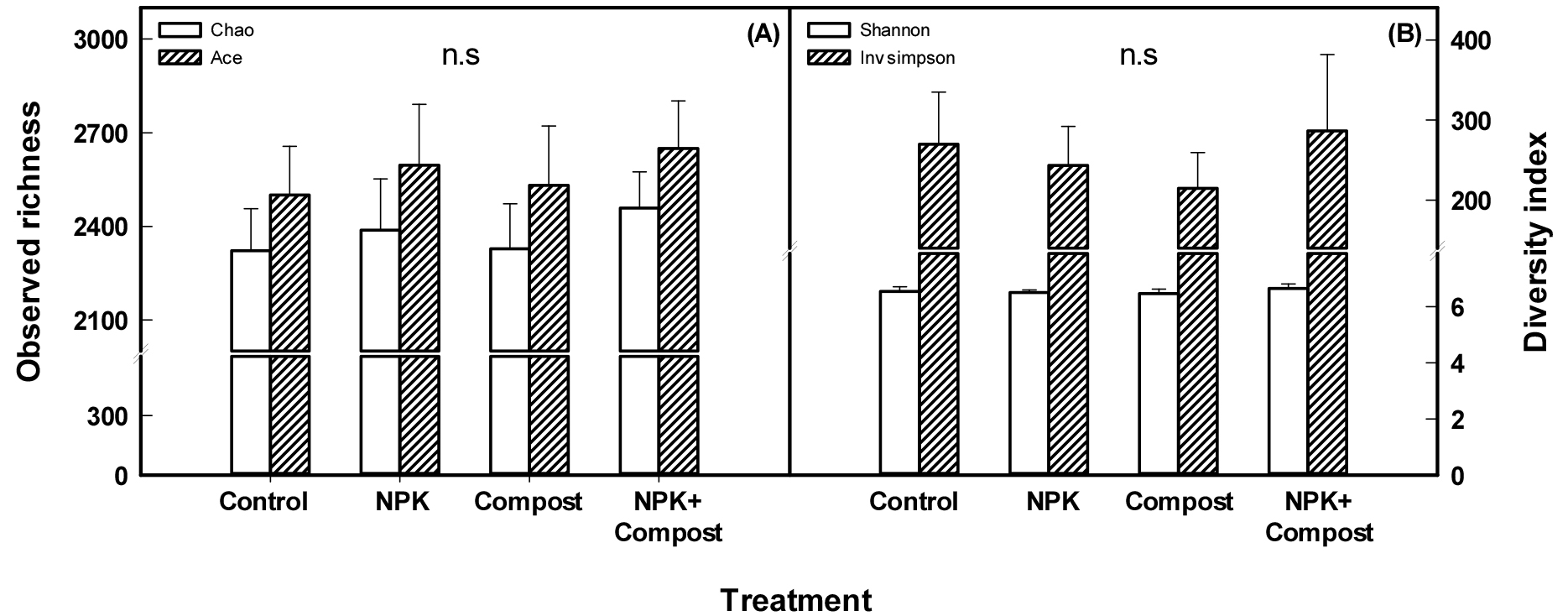
장기연용 논 토양에서 세균 군집의 종풍부도와 다양성을 평가한 결과 (Fig. 3), 종풍부도와 다양성은 시비관리 방식에 따라 다소 차이가 있었으나, 통계적인 유의차는 확인되지 않았다. Wu et al. (2011) 연구에서도 장기연용 논 토양의 세균 군집 특성과 종풍부도 다양성을 평가하였으나, 본 연구결과와 동일하게 시비처리간 유의한 차이를 확인할 수 없었다.
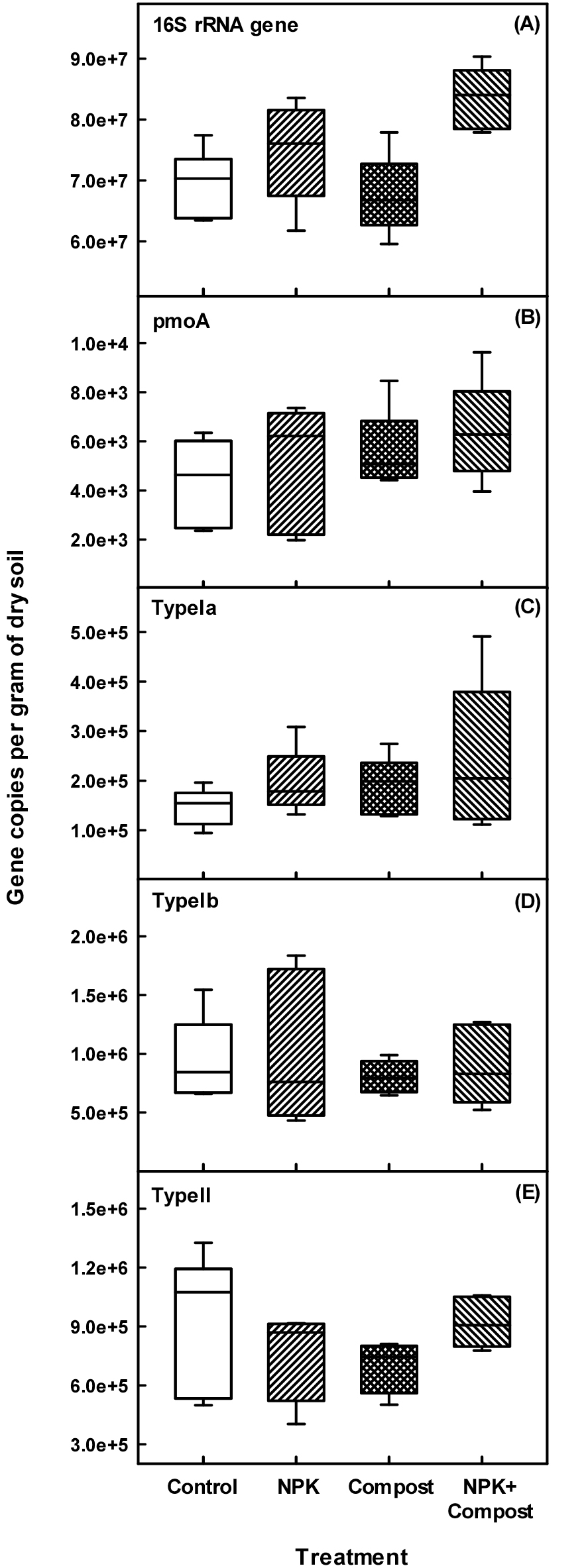
세균의 정량분석을 위해 qPCR을 실시하였다 (Fig. 4A). 시비관리별 토양 내 세균의 밀도 (16s rRNA gene)를 조사한 결과, Control (7.0 × 107 gene copies per g-1 d.w)과 Compost (6.8 × 107 gene copies per g-1 d.w)에 비해 NPK (7.5 × 107 gene copies per g-1 d.w)와 NPK + Compost (8.4 × 107 gene copies per g-1 d.w)에서 가장 높은 값을 나타내었다. 일반적으로 담수환경인 벼 논에서는 영양분의 용탈과 작물 질소 흡수 등으로 인한 질소의 제한이 빈번하게 발생될 수 있다 (Peng et al., 2011). 따라서 미생물의 에너지원인 유기물 투입과 영양원인 질소비료의 투입은 전반적인 세균 개체수 증가에 긍정적인 영향을 준 것으로 판단되며, 이로 인해 메탄산화능 증진에도 유의하게 영향을 준 것으로 판단된다 (Table 2).
Table 2.
Correlation between methane oxidation potential and soil biochemical properties in rice paddy soils under the different fertilization regimes.
일반적으로 메탄을 산화하면서 에너지를 얻는 미생물을 메탄산화균 (methanotrophs)이라고 하며, 메탄산화에 필요한 메탄산화효소 (methane monooxygenase)를 암호화하는 pmoA 유전자를 지니고 있다. 그래서 qPCR을 이용하여 pmoA 유전자를 정량분석 기술은 메탄산화균의 밀도를 파악하기 위해 폭넓게 이용되고 있다 (Gutierrez et al., 2013; Lee et al., 2014; Ho et al., 2015). 본 연구에서도 시비관리별 논 토양의 메탄산화균 (pmoA gene)을 정량분석한 결과 (Fig. 4B - 4E), 시비 처리간 큰 차이는 없었으나, Control (4.4 × 103 gene copies per g-1 d.w)과 Compost (5.2 × 103 gene copies per g-1 d.w) 처리구 대비 NPK (5.6 × 103 gene copies per g-1 d.w)와 NPK + Compost (6.3 × 103 gene copies per g-1 d.w) 처리구에서 높은 밀도를 확인할 수 있었다. Wei et al. (2016)의 연구결과에 따르면 벼 논에서 질소비료 (요소)의 시용은 메탄산화능과 메탄산화균의 활성을 증가시켰고, 메탄산화균 개체수와 활성이 증가되었기 때문으로 보고한 바 있다. 본 연구에서도 벼 논에서 무기질비료 시용으로 인해 전반적인 세균밀도 증가와 함께 메탄산화균의 밀도도 동시에 증가하였고, 이러한 증가로 인해 시비처리구에서 메탄산화능이 향상될 수 있었던 것으로 판단된다 (Fig. 2). 다만, 메탄산화능의 경우, 세균밀도 증가와는 유의한 정의 상관관계를 보였으나, 메탄산화균의 전체 밀도와는 뚜렷한 상관관계를 찾을 수는 없었다 (Table 2). 또한 본 연구에서 논 토양에서 시비방법에 따라 전체적인 메탄산화균 군집 밀도는 차이를 보였으나, 개별 메탄산화균 Type Ia, Type Ib, Type II 간에는 유의미한 차이가 없는 것으로 조사되었으며, 유의한 상관관계도 없는 것으로 나타났다 (Fig. 4, Table 2).
토양 세균 및 메탄산화균 군집 분포 특성
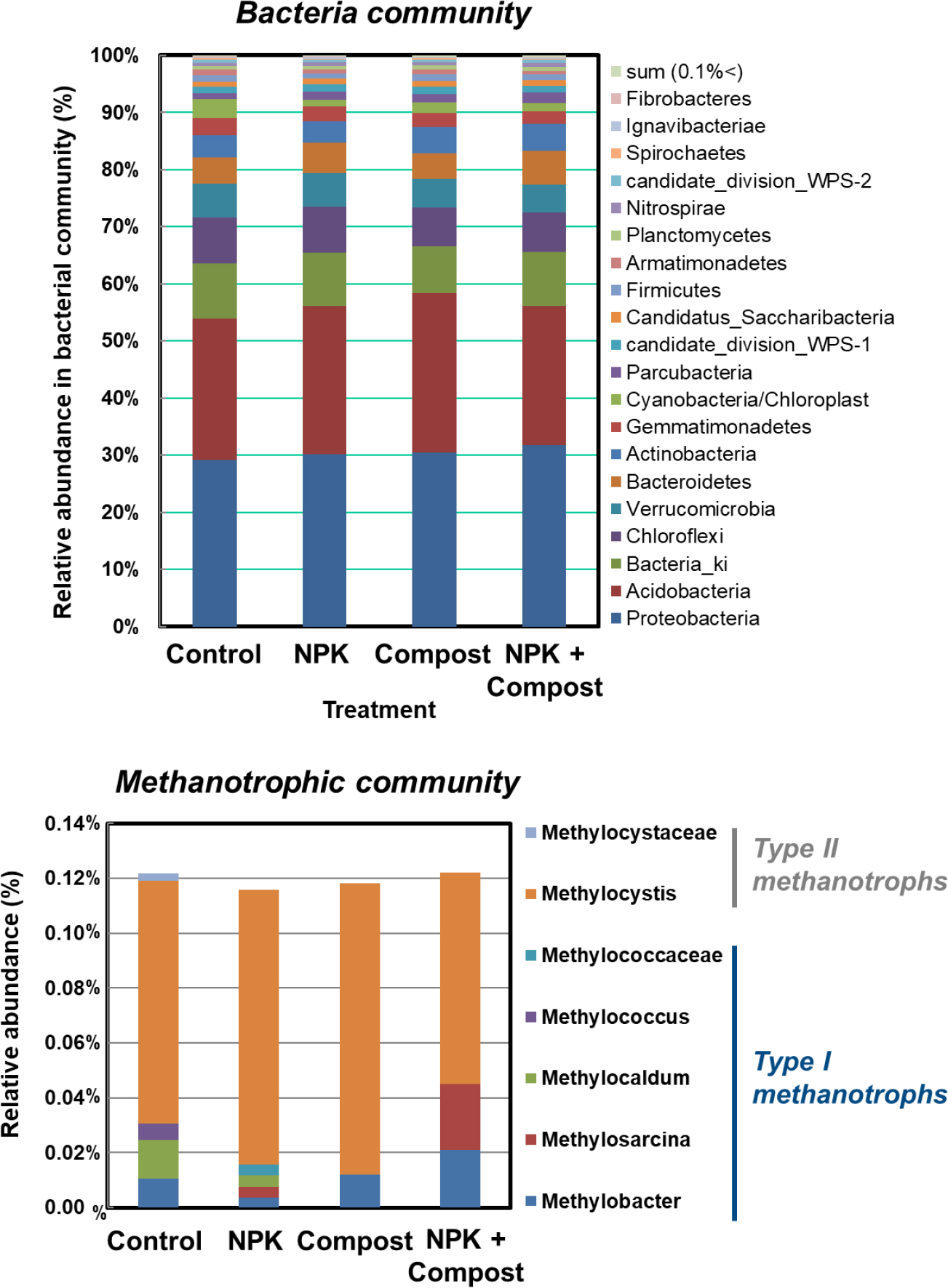
장기연용 논 토양에서 시비관리에 따른 토양의 미생물 군집 분포 특성을 조사하였다 (Fig. 5). 본 연구에 사용된 논 토양의 경우 Proteobacteria와 Acidobacteria 두 phyla가 우점하는 것으로 나타났으며, 전체 군집에서 최대 58% 이상을 차지하는 것으로 조사되었다. 하지만, 세균 군집의 경우 시비관리에 따라 처리간 큰 차이를 보이지 않았다.
메탄산화균은 세균으로 분류학적으로는 Gammaproteobacteria에 속하는 Type I과 Alphaproteobacteria에 속하는 Type II로 세분할 수 있다 (Conrad, 2007). 특히 Gammaproteobacteria는 Methylococcaceae, Methylothermaceae 2개의 과 (family), 18개 속으로 나뉘며, 대표적으로 Methylococcus, Methylocaldum, Methylosphaera, Methylomonas, Methylobacter, Methylosarcina, Methylothermus, Methylohalobius 등이 분류되어 동정된 바 있다 (Deutzmann et al., 2014; Hirayama et al., 2014; Hoefman et al., 2014). 일반적으로 Type I 메탄산화균의 경우 낮은 농도의 메탄을 산화시키며, 고농도의 산소를 필요로 한다. 메탄산화균 중에서 Alphaproteobacteria는 Beijerinckiaceae, Methylocystaceae 2개의 과 (family), 5개의 속 (genera)이 있으며, 대표적인 속으로는 Methylocystis, Methylosinus, Methylocella, Methylocapsa 등이 이에 포함된다. Type I과는 상반되게 고농도의 메탄을 산화시키며, 저농도의 산소조건을 필요로 한다. Type I보다 Type II 메탄산화균의 경우, 벼 논에서 보다 안정적으로 서식하며, 벼 생육과도 상관관계가 높은 것으로 보고된 바 있다 (Conrad, 2007). 메탄산화균의 생리적인 특징을 고려하여 Type I 메탄산화균의 경우 Methylobacter와 Methylosarcina 그룹을 모아서 Type Ia, Methylococous 그룹을 Type Ib로 명명하고 있다 (Kolb et al., 2003).
본 연구에서는 전체 세균 군집의 약 0.12% 정도가 메탄산화균인 것으로 조사되었으며, 시비관리에 따라 메탄산화균의 군집의 상대적인 비율 차이는 거의 없는 것으로 나타났다 (Fig. 5). 흥미롭게도 본연구에서 메탄산화능이 크게 증가되었던 무기질비료 시용구 (NPK, NPK + compost)에서만 Type I 메탄산화균인 Methylosarcina 속 (genus)을 확인할 수 있었다 (Fig. 5). 특히 NPK + Compost 처리구 (0.024%)에서 NPK처리구 (0.004%)에 비해 상대적인 비율은 약 6배 이상 높은 것으로 조사되었으며, Methylosarcina 속 (genus)의 상대적인 비율과 메탄산화능 간 유의한 상관관계가 있는 것으로 확인되었다 (Fig. 2, Table 2).
기존 연구에서는 벼 논에서 질소비료의 시용이 메탄산화능과 메탄산화균의 활성을 증가시켰으며, 메탄산화균 중 특히 Methylobacter, Methylosarcina 그룹의 개체수와 활성이 증가되었기 때문으로 보고한 바 있다 (Wei et al., 2016). Chan and Parkin (2001)의 연구에 따르면 메탄 농도가 충분할 경우 무기질소 함량의 증가는 메탄산화능을 증진시킬 수 있지만, 대기 메탄 농도 수준일 경우 메탄이 제한 요인으로 작용하여 무기질소를 첨가하더라도 더 이상의 메탄 산화능이 증가되지 않는다고 보고한 있다. 본 연구에서도 벼 논의 경우 메탄의 농도가 높게 형성되고, 질소가 용탈로 인해 부족한 환경이 형성되었을 것으로 판단되며 (Conrad, 2007; Peng et al., 2011), 이로 인해 벼 논에서 비료 시비가 메탄산화능을 증진시킬 수 있었던 것으로 판단된다. 단, 담수조건과 벼 생장시기 등에 따라 산화환원 전위 변화 및 산소 고갈 등 서식환경 변화로 인해 토양 내 미생물 군집의 차이가 나타날 수 있기 때문에 (Liesack et al., 2000; Ahn et al., 2016), 추후 시기별로 토양시료를 채취하여 추가적인 조사가 필요하며, 현장에서 작기 중에 메탄배출량 등을 종합적으로 평가해야 할 것으로 판단된다.
토양 화학성
장기연용 논 토양의 화학성을 조사한 결과 (Table 1), 시비에 따라 전반적인 토양의 특성이 유의하게 변화하는 것으로 조사되었다. 다양한 토양 특성 중 특히, 메탄산화능이 증가하였던 무기질비료 시용구 (NPK, NPK + compost)의 경우 pH와 수용성 질소 (water extractable N)의 증가가 두드러지는 것으로 조사되었다. 다양한 환경요인 중에서 토양의 pH와 질소유효도는 메탄산화균의 활성과 군집 특성에 영향을 주는 핵심 인자로 알려져 있다 (Le Mer and Roger, 2001; Conrad, 2007; Lauber et al., 2009; Tripathi et al., 2018). 본 연구에서도 토양 pH의 경우 메탄산화능과 유의한 정의상관 관계를 보이는 것으로 조사되었다. 특히 Control (5.16)과 Compost (5.26) 처리구 대비 무기질비료 시용구인 NPK (5.40)와 NPK + Compost (5.46)에서 유의한 수준의 증가를 보이는 것으로 조사되었으며, pH 증가로 인한 메탄산화균의 활성 증가가 메탄산화능 증진에 영향을 준 것으로 판단된다 (Zhao et al., 2020). Water extractable N는 유효태 질소로써 미생물이 쉽게 이용할 수 있는 형태 중 하나로, 본 연구에서도 시비처리에 따라 함량 차이가 유의하게 나타난 것으로 조사되었다. Water extractable N는 메탄산화능 간 유의한 상관관계를 도출할 수는 없었으나, 상대적으로 토양 내 질소유효도가 충분한 조건이 형성되었기 때문에 무기질비료 시용구에서 메탄산화능이 크게 증가된 것으로 판단된다. 유기탄소함량과 탄질률 (C/N ratio)의 경우 메탄산화능과 높은 정의 상관관계를 확인할 수 있었다 (Table 2). 일반적으로 논 토양에서 높은 탄소함량은 충분한 기질공급으로 인해 메탄생성균에 유리한 조건이 생성될 수 있으며 (Le Mer and Roger, 2001), 메탄산화에 필요한 기질인 메탄공급이 활발하게 이루어질 수 있기 때문에 메탄산화력 증진에 긍정적인 영향을 줄 수 있다. 하지만 본 연구에서는 메탄산화능 평가를 실내에서 수행하였고, 메탄을 충분하게 주입한 점을 감안하면 토양 내 높은 탄소함량은 메탄산화균을 포함한 전반적인 미생물활성 증진에 긍정적인 영향을 줄 수 있었던 것으로 판단된다.
Conclusions
실내실험을 통해 장기연용 논 토양에서 메탄산화능을 평가하였으며, 메탄산화균의 정량분석과 세균 군집의 분포 특성과 토양화학성을 조사하였다. 결과적으로, 시비관리 방식에 따라 메탄산화능은 유의한 차이를 보였으며, 특히 무기질비료 시용구에서 전반적인 산화능이 향상되었으며, NPK + Compost 처리구에서 가장 높은 산화능을 보였다. 세균 군집의 밀도와 메탄산화균 전반에 걸친 밀도가 무기질비료 시용구에서 전반적으로 증가하였고, 특히 Methylosarcina (Type I)의 비율 증가가 두드러지게 나타났다. 무기질 비료를 장기간 시용한 토양의 특성을 평가한 결과, 토양 pH가 전반적으로 증가하였고, 질소유효도 또한 증가한 것으로 조사되었다. 따라서 벼 논에서 시비관리가 메탄산화능 증진에 영향을 줄 수 있는 것으로 판단되며, 무기질 비료 시용과 유무기질 비료 혼용을 통해 벼 논에서 메탄산화능을 증진시킬 수 있을 것으로 기대한다. 단, 시료채취 시기에 따라 미생물 군집 특성의 차이가 있을 수 있기 때문에 추후 현장연구를 통해 메탄산화능에 대한 검증이 진행되어야 할 것으로 판단된다.