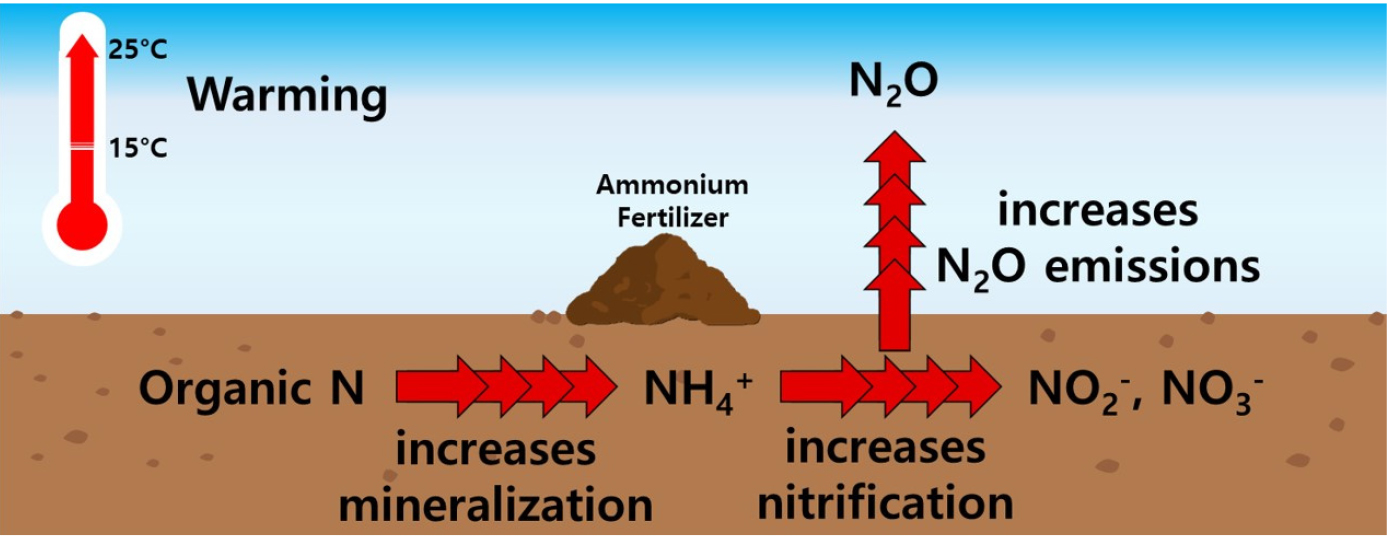
Introduction
Materials and Methods
배양 실험
시료채취 및 분석
Results and Discussion
토양 무기태 질소 및 질산화 속도
토양에서 N2O 배출
Conclusions
Introduction
아산화질소 (N2O)는 강력한 온실가스이면서 오존층 파괴 물질이고, 대기 중 농도는 꾸준히 증가하고 있다. 대기 중 N2O 농도 증가는 주로 인간활동에 의해 이루어졌고, 산업혁명 이전에 약 270 ppbv (nmol mol-1)였던 농도는 2024년 337.7 ppbv에 이르렀다 (NOAA Global Monitoring Laboratory, 2024). 대기 중 N2O는 이산화탄소 (CO2)에 비해 농도가 낮지만 대기 중 잔류기간이 길고 복사효율이 높아 100년 기준 지구온난화지수 (GWP, global warming potential)가 CO2의 273배이고, 그 결과 지구 전체 복사강제력 (radiative forcing)의 약 7.4%를 차지한다 (IPCC, 2021). 지구 전체 N2O 배출에 대해 농업활동이 차지하는 비율은 약 70% 이상으로 높고, 작물 생산 증대를 위한 무기질 및 유기질 비료 사용 증가가 주요 원인이다 (IPCC, 2021).
토양에서 N2O는 미생물이 관여하는 여러 반응으로 생성되어 배출된다. 암모니아 (NH3) 산화 (질산화), 질산 (NO3-) 환원 (탈질), 혐기성 암모니아 산화, 유기질소 산화 등의 경로를 통해 N2O가 생성될 수 있고 (Bremner, 1997; Toma et al., 2011; Wei et al., 2017; Nie et al., 2019), 그 중 N2O 배출의 많은 부분을 차지하는 경로는 질산화와 탈질이다. 질산화 과정은 통기성이 좋은 호기 조건의 토양에서 활발히 일어나고, 유기질소의 미생물 분해로 생성된 암모늄 (NH4+)이 아질산 (NO2-)을 거쳐 NO3-로 산화되는 반응으로 첫 번째 과정 중에 N2O가 생성될 수 있다. 탈질 과정은 논이나 습지와 같은 통기성이 낮은 혐기 조건의 토양에서 활발히 일어나며, 토양에 존재하는 NO3-가 NO2-을 거쳐 N2O, N2 등으로 환원되는 과정이다. 탈질 과정은 N2까지 완전 반응하는 것이 이상적이지만 미생물의 종류나 효소 활성에 따라 중간생성물인 N2O가 배출된다 (Chèneby et al., 1998; Saggar et al., 2012).
질소 변환 과정에서의 N2O 생성은 미생물 관여 반응이므로 온도, 수분, 기질, pH와 같은 환경요인에 영향을 받는다 (Che et al., 2014; Cai et al., 2016; Wang et al., 2021). 특히 온도의 경우, 30°C 이하에서 온도 상승에 따라 질산화 반응 속도가 빠르고 N2O 배출량이 증가한다는 것은 여러 연구에서 언급된 바 있다 (Goodroad and Keeney, 1984; Maag and Vinther, 1996; Avrahami et al., 2003; Zhang et al., 2019). Xia et al. (2020)는 분뇨 처리 토양에서의 N2O 배출은 따뜻한 온대기후의 토양에서 더 높았다고 보고하였다. Bahram et al. (2022)는 따뜻한 습지 토양은 N2O 배출에 관여하는 질산화 고세균이 풍부하여 N2O 배출이 높다고 설명하였다. Fidel et al. (2019)는 무처리구와 바이오차를 적용한 토양을 10, 20, 30°C 에서 배양했을 때 온도가 증가할수록 N2O 배출량이 높아졌음을 보고하였다. 이와 같은 연구는 온도 변화에 따라 토양 중 N2O 배출량의 증감 여부와 그 변화량에 대해 초점이 맞춰져 있고, 그 변화량을 일으키는 기작 및 수치 해석은 부족한 상황이다.
통기 조건의 호기성 토양에서 온도가 증가할 경우 미생물 활성 증가로 N2O 생성 속도가 증가할 수 있지만, N2O 누적 배출량은 N2O 생성에 필요한 반응기질인 NH4+의 양에 의해 좌우될 수 있다. 농경지에 비료로 요소 또는 암모늄염 (예를 들어 황산암모늄)을 처리할 경우, 초기에는 온도가 높은 조건에서 N2O 배출 속도는 빠를 수 있지만, 그만큼 기질인 NH4+가 빠르게 소모되면서 후기에는 오히려 온도가 높은 조건에서 N2O 배출 속도가 느려질 수 있고 그 결과 전체 기간에 걸친 누적 배출량에 대한 온도의 영향은 적게 나타날 수 있다. 토양에서의 N2O 누적 배출량을 구하기 위해 주로 챔버 방법을 사용하는데, 이는 챔버 내 토양을 외부 공기와 열린 상태로 유지하다가 주기적으로 챔버를 닫힌 상태로 일정시간 유지한 후 농도 변화를 분석하고 여기에 채취 사이의 기간을 적용하여 누적 배출량을 산출하는 방법이다 (Lee et al., 2021; Jin et al., 2023; An et al., 2024). 그러나 이와 같은 방법은 질소를 시비한 토양에서 질소 변환이 빠르게 일어날 경우 열린 상태 동안에 일어날 수 있는 특이적인 N2O 배출의 변화를 감지하기에는 어려움이 있다. 본 연구에서는 N2O 배출 속도는 온도의 영향을 받지만 전 기간에 걸친 N2O 누적 배출량은 기질의 양에 의해 크게 좌우된다고 가설을 세웠다. 이 가설을 검증하기 위해 통기 조건의 토양에 암모늄염을 처리한 후 15°C와 25°C에서 항온배양실험을 진행하였고, N2O 배출량을 구하기 위해 배양기간 동안 밀폐된 조건을 유지하였다.
Materials and Methods
배양 실험
실험에 사용한 토양은 전북특별자치도 익산시 정족동에 위치한 밭에서 채취하였고, 풍건 후 2 mm 체로 걸러 실험에 사용하였다. 토양의 pH는 6.7로 약산성이고, 총 탄소와 질소함량은 각각 17.2와 1.8 g kg-1이며, 토성은 양토이다 (Table 1). 배양실험을 위해 76개의 100 mL 폴리에틸렌 병에 토양을 25 g씩 담았고, 미생물활성을 높이기 위해 토양 수분함량을 포장용수량보다 낮은 16%로 맞춘 후 25°C의 암조건 배양기에서 7일간 예비 배양을 하였다. 이후 질소에 대한 처리구와 무처리구로 토양이 담긴 병을 38개씩 나누고, 질소처리구에는 황산암모늄 [(NH4)2SO4]을 처리하였다. 질소 처리를 위해 황산암모늄 용액을 1 mL씩 토양에 넣었고, 처리한 질소의 양은 174 mg N kg-1이며, 이는 농경지 면적 기준 20.9 kg N 10a-1 (토양 전용적 밀도 1.2 Mg m-3, 토양 깊이 0.1 m 기준)를 처리한 양과 동일하다. 질소 처리 토양을 균일하게 섞은 후 토양 전용적밀도가 1.2 g cm-3가 되도록 하였고, 그 후 증류수를 이용하여 토양수분함량을 포장용수량인 22%로 맞추었다. 이 토양을 1 L 유리 배양용기 (incubating jar)에 넣어 뚜껑을 닫고, 무처리구와 질소 처리구 각각에 대해 38개 배양용기를 반 (19개)으로 나누어 각각 15°C와 25°C에서 배양하였다. 질소 및 온도에 대한 처리구별로 토양이 담긴 배양용기는 19개가 되고, 이중 15개는 3개씩 5번에 걸쳐 토양 분석을 위해 사용하였다. 나머지 4개는 뚜껑에 개폐가 가능한 튜브를 연결하여 주기적인 가스채취와 배양 마지막에 토양 분석을 위해 사용하였다. 가스 분석을 위해 주 2 - 3회 배양용기 내 공기를 채취하였고, 채취 후 토양 수분을 맞추고 배양용기를 환기하였다. 그리고 토양이 들어있지 않은 배양용기에 대해서도 같은 방법으로 배양하고 공기를 채취하였다.
Table 1.
Physicochemical properties of soil used for the experiment.
| Parameters | Values |
| pH1:5 | 6.7 |
| Total C (g kg-1) | 17.2 |
| Total N (g kg-1) | 1.8 |
| Field capacity (%, w/w) | 22.0 |
| 2 M KCl extractable NH4+ (mg N kg-1) | ND1 |
| 2 M KCl extractable NO3- (mg N kg-1) | 27.7 |
| Texture | Loam |
| Sand (%) | 27.3 |
| Silt (%) | 48.4 |
| Clay (%) | 24.3 |
시료채취 및 분석
배양실험에 사용한 토양의 물리화학적 특성은 풍건 후 2 mm 체로 거른 후 분석하였다. 토양 pH는 토양을 1:5 비율 (W/V)의 증류수로 진탕 후 pH 측정기 (SevenCompact S220, Mettler Toledo, Switzerland)로 측정하였다. 토양의 총 탄소와 질소는 원소분석기 (Flash 2000 series, Thermo, USA)로 분석하였다. 토양 무기태 질소 (NH4+-N, NO3--N)는 토양을 2 M KCl로 침출 여과하여 증류법으로 측정하였다 (Keeney and Nelson, 1982). 암모늄태 질소 (NH4+-N) 분석을 위해 여과용액에 MgO를 넣어 증류하였고, 이때 휘산된 NH3를 H3BO3 용액에 포집한 후 HCl 용액으로 적정하였다. 증류 후 식힌 용액에 데바르다 합금 (Devarda’s alloy) 분말을 넣어 암모늄태 질소와 동일한 방법으로 질산태 질소 (NO3--N)를 분석하였다. 토양의 포장용수량 (field capacity, FC)은 압력판 추출장치 (Pressure plate extractor, Soilmoisture Equipment Corp., USA)를 이용하여 33 kPa 장력에서 구하였고, 토성은 과산화수소로 유기물을 분해하고 sodium hexametaphosphate로 분산한 후 피펫법으로 측정하였다 (Gee and Bauder, 1986).
배양 중 토양 무기태 질소 농도 변화를 구하기 위해, 배양기간 중 각 처리구별로 총 6회에 걸쳐 토양을 채취하였다. 온도에 따라 무기태 질소의 변화 속도가 다르기 때문에 15°C는 5, 11, 15, 19, 27, 35일에, 25°C는 2, 5, 8, 10, 12, 21일에 채취하였고, 질소 처리구의 채취일에 맞춰 무처리구 토양도 채취하였다. 각 처리구별로 3개의 배양용기를 임의로 선택하여 토양을 균일하게 섞은 후 시료를 채취하여 분석하였다.
순 무기화 (net mineralization, NM) 양은 배양 마지막에 채취한 토양의 무기태 질소 농도에서 초기 토양의 농도를 빼서 구하였다. 질소 처리구의 NH4+-N 감소 속도와 NO3--N 증가 속도는 배양기간동안 각 농도의 변화에 대한 선형 회귀식의 기울기로 하였다.
가스채취용 배양용기 시료는 각 처리구별로 4개이고, N2O와 CO2 배출량을 측정하기 위해 주 2 - 3회 배양용기내 공기를 60 mL 주사기로 채취하였다. 채취한 기체 시료는 FID-methanizer 검출기와 micro-ECD 검출기가 내장된 가스크로마토그래피 (7790A, Agilent, USA)로 분석하였다. N2O와 CO2 플럭스 (flux)는 아래 Eq. 1을 이용하여 계산하였다.
여기서, 는 N2O와 CO2의 기체밀도로서 각각 1.967와 1.977 kg m-3, v는 배양용기의 부피 (m3), W는 배양용기 내 토양 무게 (kg), 는 가스채취를 위한 배양기간 (day), 는 배양기간 동안 배양용기 내 N2O와 CO2의 증가 농도 [각각 ppbv (nmol mol-1)와 ppmv (µmol mol-1)], T는 배양용기 내 온도 (K)이다.
토양 무기태 질소 및 가스 데이터에 대한 통계분석은 R 프로그램 (version 4.3.3)을 이용하고, 처리간 비교를 위해 0.05% 유의수준에서 최소유의차 (LSD) 검정을 실시하였다.
Results and Discussion
토양 무기태 질소 및 질산화 속도
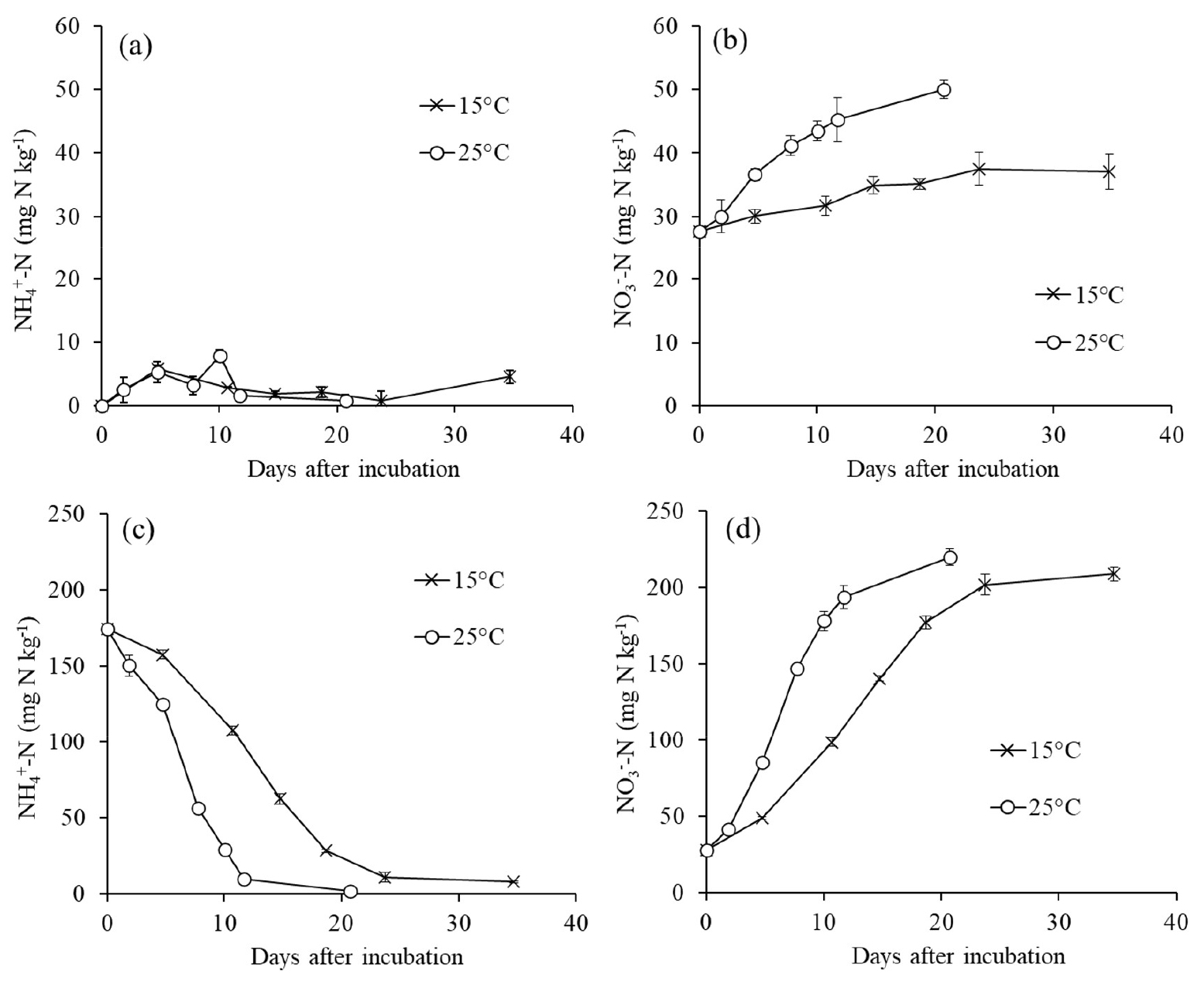
질소를 처리하지 않은 무처리구에서 토양의 NH4+-N는 배양기간 동안 10 mg N kg-1 미만으로 농도가 유지되었고, NO3--N는 점차 증가하였다 (Fig. 1a, 1b). 질소를 처리하지 않았지만, 이와 같이 NO3--N가 증가한 것은 배양기간 동안 토양 유기질소가 미생물 분해로 무기화되어 NH3가 생성되고 이후 암모니아 산화 과정으로 NO3-가 생성된 결과이다. 또한 배앙기간 동안 NH4+-N가 낮게 유지된 것은 본 실험 조건에서 유기질소의 무기화에 의한 NH4+-N 생성보다 NH4+-N 산화 속도가 빠르게 진행된 결과이다. 전체 무기태 질소 (NH4+-N와 NO3--N의 합) 농도는 15°C보다 25°C에서 더 높았다. 일반적으로 토양에서 온도가 증가할수록 미생물 활성이 증가하기 때문에 (Taylor et al., 2021), 높은 온도에서 미생물 분해가 활발히 일어날 수 있다. 배양기간 동안 무기태 질소 농도 변화로 구한 순 무기화 (NM) 양은 15°C 와 25°C에서 각각 14.0와 23.1 mg N kg-1이었고, 토양 총질소를 기준으로 구한 순 무기화율은 각각 0.8과 1.4%이었으며, 두 온도 사이의 순 무기화율 비율 (NM25°C / NM15°C)은 1.65이었다.
암모늄염 처리구에서는 NH4+-N가 시간에 따라 점차 감소하고 NO3--N는 점차 증가하였다 (Fig. 1c, 1d). 이는 처리한 NH4+가 산화되어 NO3-로 변환되는 질산화 과정의 결과이다 (Yun et al., 2011). 그러나 배양기간 동안 감소한 NH4+-N의 양 (15°C에서 166.2 mg N kg-1, 25°C에서 172.2 mg N kg-1)에 비해 NO3--N의 증가한 양 (15°C에서 181.1 mg N kg-1, 25°C에서 192.2 mg N kg-1)이 더 많았고, 이는 무처리구 토양에서 살펴본 토양 유기질소의 무기화가 작용한 결과이다. 암모늄염 처리구에서 순 질소 무기화 양은 15°C와 25°C에서 각각 14.9와 20.1 mg N kg-1로 무처리구 토양과 비슷하였고 (P > 0.05), 두 온도 사이의 순 무기화율 비율 (NM25°C / NM15°C)은 1.35이었다.
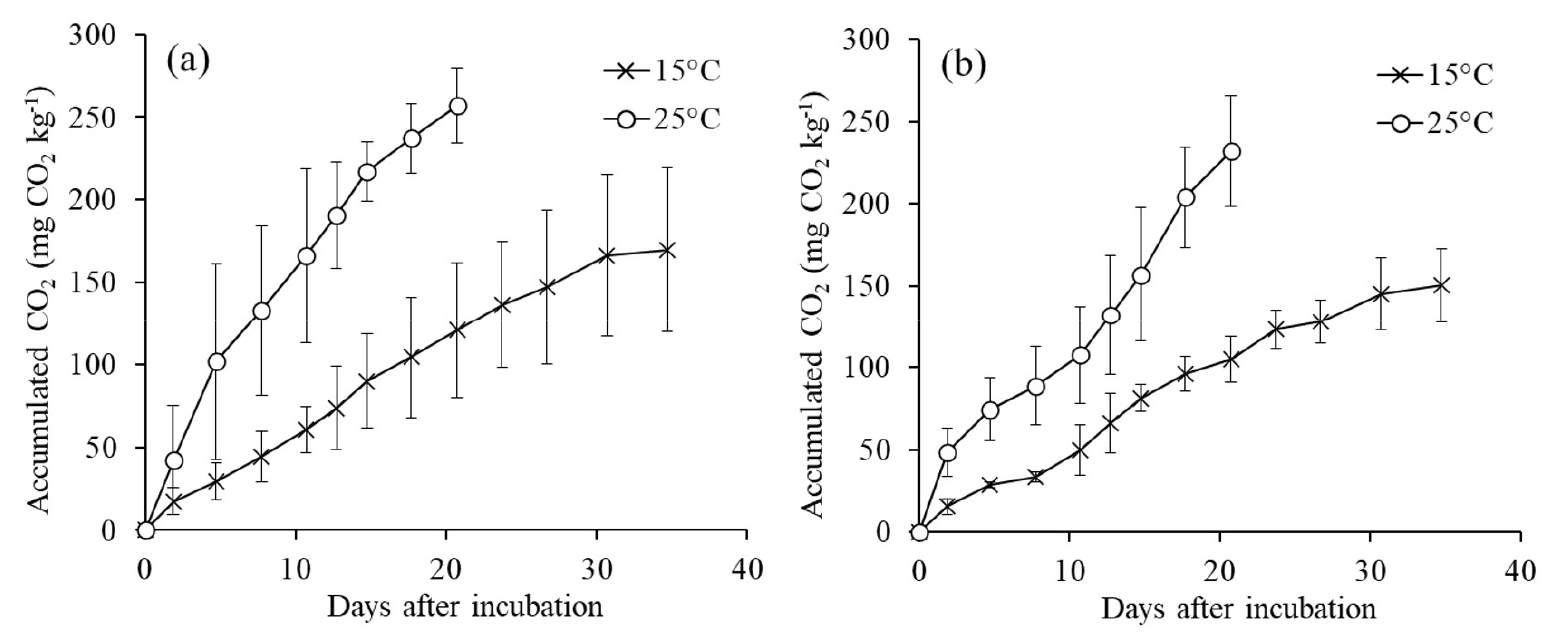
질소의 순 무기화율에 대한 온도의 영향은 토양 호흡률에서도 잘 나타났다. 배양기간 동안 누적 CO2 배출량은 질소처리와 상관없이 15°C보다 25°C에서 더 높았다 (Fig. 2). 질소 무처리구의 누적 CO2 배출량은 25°C에서 256.9 mg CO2 kg-1로 15°C (169.6 mg CO2 kg-1)의 1.52배였고, 질소 처리구에서는 25°C에서 232.1 mg CO2 kg-1로 15°C (150.4 mg CO2 kg-1)의 1.54배였다. 이와 같은 비율은 10°C 증가함에 따라 토양 호흡률이 1.5 - 3배 증가한다는 다른 연구의 보고와 일치하였다 (Parada et al., 1983; Norstadt and Porter, 1984; Fang and Moncrieff, 2001; Zang et al., 2019). 또한 이 수치는 앞에서 살펴본 두 온도 사이의 순 질소 무기화율 비율 (무처리구 1.65, 암모늄염 처리구 1.35)과도 비슷한 수치였고, 이는 미생물 활성 증가에 의한 토양 유기 질소의 무기화가 무기태 질소 증가에 기여했음을 보여준다.
배양기간 동안 NH4+-N와 NO3--N의 농도변화는 15°C보다 25°C에서 더 빨랐다 (Table 2). 15°C와 25°C에서 NH4+-N의 농도는 각각 19일과 10일까지 각각 28과 29 mg N kg-1로 선형 감소하였다 (Fig. 1c, Table 2). 이 시기에 NH4+-N 감소 속도 (ammonium disappearance rate, ADR)는 15°C (8.1 mg N kg-1 d-1)보다 25°C (14.9 mg N kg-1 d-1)에서 더 빨랐고 (P < 0.05), NO3--N 증가 속도 (nitrate production rate, NPR)도 15°C (8.2 mg N kg-1 d-1)보다 25°C (15.8 mg N kg-1 d-1)에서 더 빨랐다 (P < 0.05). 암모늄 산화에 관여하는 미생물의 활성은 15 - 30°C 구간에서 온도가 증가함에 따라 증가한다고 알려져 있다 (Avrahami et al., 2003; Yun et al., 2011; Taylor et al., 2019). 온도가 10°C 증가할 때 질산화 미생물 활성의 증가 비율 (Q10)은 2에 근접한다고 여러 연구에서 보고되었고 (Maag and Vinther, 1996; Maslov and Maslova, 2022), 본 연구에서도 15°C에서 25°C로 10°C 증가할 때 NH4+ 농도 변화 속도 비율 (ADR25°C / ADR15°C)과 NO3- 농도 변화 속도 비율 (NPR25°C / NPR15°C)은 각각 1.83과 1.93으로 2에 가까웠다.
NH4+-N 감소 속도와 NO3--N 증가 속도를 서로 비교하였을 때 온도 증가에 따라 차이가 커졌다. 15°C와 25°C 모두 유의적인 차이는 없었지만 (Table 2), NO3--N 증가 속도는 NH4+-N 감소 속도에 비해 15°C는 0.9%, 25°C는 5.7% 더 컸다. 유기질소의 무기화는 토양 NH4+-N를 증가시키는 과정이므로 토양 NH4+-N 감소 속도를 더 작게 만들 수 있다. 반면에 NO3--N 증가 속도는 무기화 과정의 영향을 덜 받은 수치이다. 이와 같은 이유로 높은 온도에서 NH4+-N 감소 속도에 비해 NO3--N 증가 속도의 증가가 더 뚜렷하게 나타났다고 판단된다.
Table 2.
NH4+-N disappearance and NO3--N production rates in soil during incubating at 15 and 25°C.
| Temperature | NH4+-N disappearance | NO3--N production | ||
| Rate (mg N kg-1 d-1) | r1 | Rate (mg N kg-1 d-1) | r | |
| 15°C | 8.12 (±0.05)bA2 | -0.988**3 | 8.19 (±0.22)bA | 0.992*** |
| 25°C | 14.90 (±0.32)aA | -0.989** | 15.80 (±0.47)aA | 0.993*** |
토양에서 N2O 배출
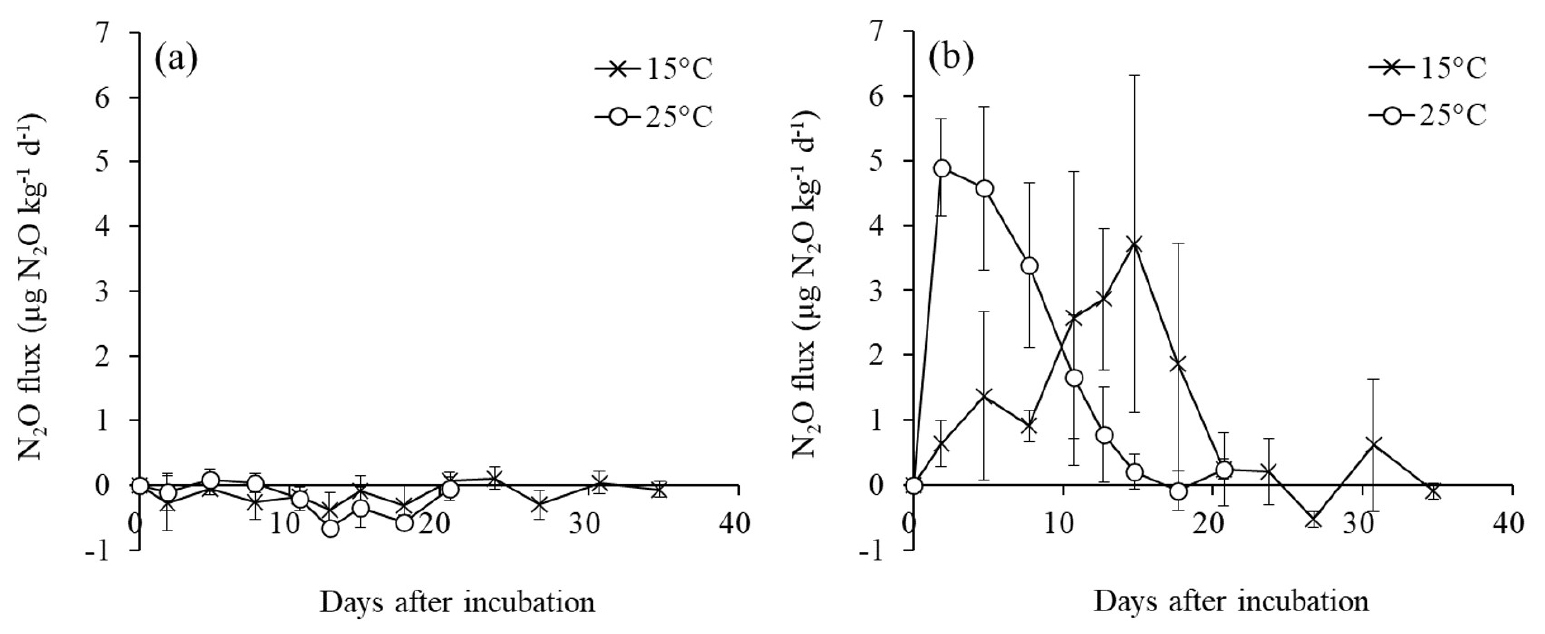
N2O 배출은 무처리구와 암모늄염 처리구 사이에 뚜렷한 차이를 보였다. 질소 무처리구에서 N2O 배출은 거의 나타나지 않았지만 (Fig. 3a), 암모늄염 질소 처리구에서는 시간에 따라 뚜렷하게 증가했다가 다시 감소하는 경향을 보였다 (Fig. 3b). 이와 같은 양상은 암모늄 처리에 따른 토양 NH4+-N 농도 변화가 N2O 생성에 크게 영향을 주었기 때문이라고 판단된다. 토양에서 N2O가 생성되는 경로는 크게 2가지가 있다. 하나는 습지와 같은 혐기 조건에서 NO3-를 기질로 하는 미생물에 의해 환원되는 과정 (탈질) 중에 N2O가 생성되는 경로이고, 다른 하나는 밭과 같은 호기 조건에서 미생물에 의해 NH4+이 NO3-로 산화되는 과정 (질산화) 중에 생성되는 경로이다 (Bateman and Baggs, 2005; Wang et al., 2021). 본 연구에서 N2O 배출은 질산화 과정 중 일어났다고 판단되고, 그 이유는 토양 수분함량을 포장용수량으로 유지하여 통기성이 좋았다는 것이고, 다른 이유는 토양의 NH4+ 농도 변화에서 찾아볼 수 있다. N2O 배출이 거의 관찰되지 않은 무처리구 (-1.0 – +0.2 µg N2O kg-1 d-1)와 다르게 암모늄염 처리구는 토양 NH4+ 농도가 높은 시기에 N2O 배출도 활발히 일어났고, NH4+-N 농도가 약 10 mg N kg-1의 낮은 수준까지 감소한 시기 (15°C와 25°C에서 각각 배양 후 24일과 12일) 이후로 더 이상의 N2O 배출이 없었다 (Figs. 1 and 3). 따라서 본 토양에서 질산화 과정이 N2O 배출의 주요 경로라고 판단된다.
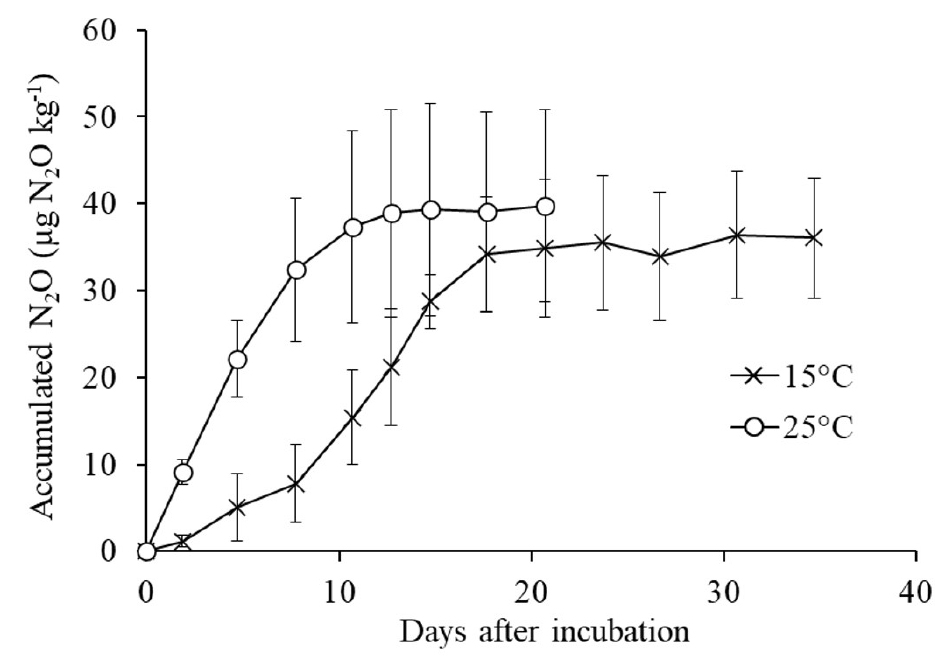
질소 처리구에서 N2O 누적 배출량은 온도가 높을 때 더 빠르게 증가하였다 (Fig. 4). 토양 중 NH4+-N 농도가 20 mg N kg-1보다 높게 존재했던 기간 동안 (15°C와 25°C에서 배양 후 각각 18일과 8일까지)의 N2O 누적 배출 증가 속도 (평균 N2O 플럭스)는 15°C와 25°C에서 각각 4.20와 2.00 µg N2O kg-1 d-1이고, 두 온도 사이의 비율은 2.10으로 25°C에서 110% 더 높았다. 이 비율은 NO3--N 생성 속도에서 살펴본 비율 (NPR25°C / NPR15°C = 1.93)과 비슷하였다. 즉 본 결과는, 온도 증가에 따른 NH4+ 산화 속도 (NO3- 생성 속도)의 증가에 의존하여 N2O 생성 및 방출이 증가하였다는 것을 보여준다.
높은 온도에서 N2O 누적 배출량이 빠르게 증가하였고 배양 동안에 최종 누적 배출량도 더 높은 경향을 보였다. 그러나 N2O 누적 배출량에 대한 15°C (36.0 µg N2O kg-1 d-1)와 25°C (39.8 µg N2O kg-1 d-1)의 비율은 1.10으로 25°C에서 10% 높았지만 서로 유의적인 차이는 없었다 (P > 0.05). 온도가 증가할 경우 질소 무기화 증가의 결과로 NH4+-N 양이 증가하여, NH4+ 산화 (NO3- 생성) 과정에서 발생하는 N2O 양이 증가할 수 있다. 온도가 10°C 증가할 때 N2O 누적 배출량의 10% 증가는 온도 증가에 따른 NO3--N 생성 양의 증가와 비교해 볼 수 있다. 마지막 배양일에 15°C와 25°C의 토양 NO3--N 농도는 각각 208.8과 219.9 mg N kg-1로 질소 처리 전 토양 (28 mg N kg-1)에 비해 각각 181.1과 192.2 mg N kg-1만큼 증가하였다 (Fig. 1d). 질산태 질소의 증가 양은 15°C에 비해 25°C에서 더 컸고 (P < 0.05, LSD = 8.4 mg N kg-1), 두 증가 양의 비율은 1.06으로 10°C 증가할 때 6% 증가했음을 보여준다. 이 수치는 N2O 누적 배출량의 10% 증가의 60%를 설명해주는 수치이다. 만일 암모늄염 시비량이 감소할 경우 N2O 누적 배출량의 증가율은 더 증가하고 이 증가에 대한 유기질소 무기화의 기여율도 더 증가할 것이고, 시비량이 증가할 경우 반대의 경향이 나타날 것으로 판단된다. 종합해보면 암모늄염 비료를 시비한 호기조건의 토양에서 온도가 15°C에서 25°C로 증가할 경우 N2O 배출량이 증가할 수 있지만 이는 토양 유기질소의 무기화 증가와 이에 따른 질산화되는 질소 양의 증가가 크게 기여했음을 보여주고 있다 (Fig. 5). 즉 질산화 과정에서 N2O 배출 양은 기질인 암모늄의 양에 의해 크게 좌우함을 보여준다.
Conclusions
본 연구는 토양에서 온도가 N2O 배출에 미치는 영향을 확인하고자 통기성 수분조건의 토양에 암모늄염을 처리한 후 15°C와 25°C에서 배양실험을 하였다. 두 온도 모두 토양 중 암모늄태 질소가 존재하는 동안에 N2O가 활발히 배출되었고, 이는 질산화가 N2O 배출의 주요 경로임을 보여준다. 15°C와 비교하여 온도가 높은 25°C에서 유기질소 무기화의 증가에 따른 순 질산화된 질소의 양이 6% 증가하였다. 또한 토양에 암모늄태 질소가 존재하는 동안 N2O 배출속도는 15°C보다 25°C에서 증가하였고, 배양기간 동안 N2O 누적 배출량도 10% 증가하였지만 통계적으로 유의적이지는 않았다 (P > 0.05). 온도 증가에 따른 N2O 누적 배출량의 증가가 유의적이지 않고, 여기에 더하여 그 증가 양의 60%는 온도 증가에 따른 유기질소 무기화 증가에 의해 설명되어지기 때문에, 질산화 과정 중 N2O 생성에 대한 온도의 직접적인 영향은 더욱 적어진다. 즉, 온도 증가에 따라 N2O 누적 배출량이 증가하는 것은 토양 유기질소의 무기화와 이에 따른 암모늄태 질소 생성과 질산화 반응의 증가가 N2O 배출량의 증가로 이어진 결과이다. 이 결과는 호기조건의 토양에서 N2O 누적 배출량은 온도의 직접적 영향보다는 기질 양의 영향을 크게 받음을 보여준다. 그러나 본 연구는 토양 종류 및 온도 조건이 한정되어 있어 더 다양한 조건에서의 추가 연구가 필요하다.