Introduction
Materials and Methods
토양시료 및 시험식물
토양 화학적 특성 및 토양 내 비소 전함량 및 유효태함량 분석
벼 생장반응 및 수량구성요소 평가
식물체 내 비소 전함량 분석
데이터 분석과 통계처리
Results and Discussion
비소 수준별 토양 화학적 특성 변화
비소 수준별 벼 생육 차이 및 백미 비소 함량
토양과 백미 비소 함량 간의 관계
Conclusions
Introduction
독성 금속 물질에 의한 토양 오염은 전세계적으로 식량안보 및 생태계 위협요인으로 작용하고 있으며, 결국 우리 인간의 건강에도 직접적인 영향을 미친다 (Antoniadis et al., 2019). 다양한 독성 금속 물질 중 비소는 인체에 매우 유독한 발암물질로 국제암연구소 (international agency for research on center, IARC)에서는 비소 및 비소화합물을 1급 발암물질 (Group 1)로 분류하고 있으며 (IARC, 2004), 미국 독성물질 질병 등록국 (agency for toxic substances and disease registry, ATSDR)에서는 2019년 기준 비소를 인체 독성 수준과 노출량을 고려한 화학물질 목록 중 관리대상 1위 물질로 등록하였다 (ATSDR, 2019).
농경지 토양 중 비소 함량은 인간의 인위적 활동에 의해 증가할 수 있으며, 대표적으로 폐광산, 산업단지 등의 오염원으로부터 영향을 받을 수 있다 (Cappuyns et al., 2002; Dradrach et al., 2020). 비소의 독성은 비소종에 따라 다른 것으로 알려져 있는데 무기태인 3가 비소 (As3+, arsenite)와 5가 비소 (As5+, arsenate)가 유기태 비소 MMA (monomethylarsonic acid)나 DMA (dimethylarsinic acid) 등보다 상대적으로 강한 독성을 지니고 있으며 (Jiang et al., 2014), 무기태 비소 중에서는 As3+가 As5+보다 대부분의 생물체 내에서 독성이 더 강하며 이동성이 높은 것으로 알려져 있다 (Cao et al., 2003; Coelho et al., 2020). 따라서 담수 상태에서 혐기 조건을 지닌 논토양에서는 비소로 오염되면 As5+가 As3+로 전환되고, 이들 토양에서 재배된 쌀은 비소 오염 가능성이 높아진다. 이로 인해 현재 우리나라는 토양 비소 오염으로부터 안전한 쌀 생산을 위해 식품공전에 쌀에 한하여 무기비소 기준을 0.2 mg kg-1으로 설정하고 있다.
쌀에 대한 무기비소 기준이 설정되고, 작물의 안전성이 강조되면서 최근까지 비소 오염 논토양에 안정화제를 처리하여 작물의 비소 흡수량을 제어하기 위한 다양한 연구가 진행되었다(Yun et al., 2011; Kim et al., 2014, 2019; Seo et al., 2017; Choi et al., 2021). 하지만 여전히 비소 오염은 다양한 외부 환경 요인에 의해 발생하여 인간 건강을 위협하고 있으며, 최근에는 기후 변화에 의해 토양 비소 오염이 가속화될 수 있다는 연구 결과도 소개되었다 (Muehe et al., 2019). Muehe et al. (2019)의 연구에서는 기후변화로 토양 온도가 상승하게 되면 미생물 활성을 포함한 다양한 토양 특성 변화에 의해 토양 중 비소 식물유효도 함량이 증가하게 되고 결국 쌀의 무기비소 함량이 현재보다 약 2배 증가하고, 수량은 39% 감소하는 것으로 나타났다. 결국 앞으로도 토양 비소 오염 문제는 더욱 확대될 것으로 판단되며 토양의 비소 안정성 연구를 포함한 비소 오염에 따른 농업환경 변화에 대해 다양한 연구가 요구된다.
본 연구는 그동안 국내에서 연구가 미흡했던 토양 중 비소 함량 변화가 토양의 화학적 특성에 미치는 영향을 포함해 벼의 생육 상태 그리고 백미의 비소 함량에 미치는 영향에 대해 연구를 수행하였다.
Materials and Methods
토양시료 및 시험식물
본 연구에 사용된 토양은 국립농업과학원 내 시험포장에서 채취하여 처리구별 토양을 조제한 후 시험에 이용하였다. 인위적인 고농도의 비소오염토양은 식양토를 채취하여 풍건세토 후 2 mm 체로 걸러진 토양에 충분한 양의 물로 용해시킨 메타아비산나트륨 (NaAsO2; Sigma-Aldrich, Inc.)을 첨가하여 조제하였고, 이 오염토양은 3년 이상의 안정화과정을 거친 후 인위적 비소오염토양으로 사용하였다. 비소의 토양혼화처리는 1,050 mg kg-1 농도의 인위적 비소오염토양을 기존 비소 함량이 6 mg kg-1인 식양토에 희석하여 6수준의 비소처리구 (6, 25, 34, 42, 50, 59 mg kg-1)를 조제하였고, 질소, 인산 그리고 칼리질비료는 국립농업과학원 작물별 시비처방기준에 의거하여 각기 110, 45, 그리고 57 kg ha-1으로 토양에 혼화처리하였다. 시험식물인 신동진벼 종자를 70% 에탄올로 2분간 멸균하고, 수도물로 여러 번 세척한 다음, 2 mL L-1 농업용 살균제 (8% ipconazole) 용액에서 48시간 동안 표면살균한 후 수도물로 종자를 완전히 헹구었다. 그 표면살균된 종자를 30°C에서 48시간 동안 더 침종 및 발아시킨 후, 온실조건 하에서 수도용 상토로 충진된 규격육묘상 (60 cm × 30 cm × 3 cm tray)에 파종하고, 균일하게 생장한 25일된 유묘를 선별하여 각 처리구별 Wagner 포트 (0.05 m2 표면적, 13 kg 처리토양 충진)에 1주씩을 이식하고, 자연광에서 대략 주야간 30/20°C 평균온도를 유지하였다. 또한 상시담수조건으로 3 - 4 cm 담수심을 유지하기 위하여, 부족시 마다 모든 처리포트에 동일한 양의 수돗물을 공급하면서 이앙기 (7월 9일)부터 수확기 (10월 14일)까지 3개월 동안 실험을 수행하였다.
토양 화학적 특성 및 토양 내 비소 전함량 및 유효태함량 분석
벼 수확 후에 토양 화학적 특성과 비소의 전함량 및 유효태함량 분석을 위하여, 음지에서 풍건한 각 처리별 약 200 g 토양시료를 고무망치로 잘게 부수어 2 mm 표준체로 거른 시료를 분석에 사용하였다. 토양화학적 특성 분석은 항목별로 농촌진흥청 농업과학기술에서 제시한 표준분석방법에 준하여 실시하였다 (RDA, 2012). 토양 pH와 EC는 토양과 증류수를 1:5의 비율로 진탕한 후, 각각 pH, EC meter (Orion Star A215, Thermo Scientific Orion, USA)를 사용하여 측정하였고, 유기물은 Tyurin법, 유효인산은 Lancaster법으로 분석하였다. 치환성 칼륨, 칼슘, 마그네슘 등의 양이온은 1 M NH4OAC (pH7.0)로 침출하여, 유도결합플라즈마 분광광도계 (ICP-OES, GBC, Australia)로 분석하였고, 암모니아태 질소와 질산태 질소는 2 M KCl로 침출한 후 Kjeldahl법으로 분석하였다. 토양의 전질소는 토양 시료를 막자사발로 곱게 갈은 다음에 원소분석기 (Vario Max, Elementar, Germany)로 정량하였다.
토양 비소 전함량 분석을 위해, 1차 걸러진 토양시료를 다시 토양파쇄기를 이용하여 300 rpm에서 10분 동안 곱게 마쇄한 후 비소 전함량 분석에 이용하였다. 토양 비소 전함량 분석은 곱게 마쇄된 시료를 왕수 (conc. HCl + HNO3)로 150°C에서 2시간 분해한 다음, 유도결합프라즈마 원자방출분광기 (ICP-AES, AU/CINTRA 6, GBC Scientific, Australia)로 측정하였다 (Jung et al., 2017).
토양 비소 유효태함량 분석을 위해, 1차 걸러진 토양시료를 바로 분석에 이용하였다. 토양 비소 유효태함량 분석은 2 mm 표준체에 걸러진 시료를 Mehlich 3 침출용액 (0.2 M CH3COOH, 0.25 M NH4NO3, 0.015 M NH4F, 0.013 M HNO3, 0.001 M EDTA)으로 200 rpm에서 5분간 진탕한 다음, 0.45 µm syringe filter로 필터링 후, 유도결합프라즈마 원자방출분광기 (ICP-AES, AU/CINTRA 6, GBC Scientific, Australia)로 측정하였다 (Mehlich, 1984).
벼 생장반응 및 수량구성요소 평가
비소 독성에 대한 생장반응을 분석하기 위하여, 분얼기 (이앙 후 30일)와 유수형성기 (이앙 후 50일)에 초장과 분얼수를 조사하였다. 벼 수량과 수량구성요소 평가는 농촌진흥청 농업과학기술 연구조사분석기준에서 제시한 표준조사 절차와 방법에 의거하여 실시하였다 (RDA, 2012).
식물체 내 비소 전함량 분석
수확한 벼는 80°C에서 건조한 후 현미기 (SYTH88, Ssangyong Instrument, Korea)를 이용하여 현미로 도정한 다음 실험용 도정기 (McGill miller, HT McGill Inc, USA)를 이용하여 10분도 백미로 도정한 후 분쇄하여 분말로 만들어 분석시료로 사용하였다. 백미의 비소 함량 분석을 위하여, 시료분해는 Graphite Block Acid Digestion System (ODLAB Co., Ltd. Seoul, Korea)을 이용하였고, 분석시료 200 mg에 14 mL 질산을 넣고 산분해한 분해액을 여과지 (No. 40, Whatman, Buckinghamshire, UK)에서 불순물을 제거한 후, 유도결합플라즈마 질량분석기 (ICP-MS, Agilent 7900, Agilent Technologies Inc., Santa Clara, CA, USA)에서 비소 함량을 측정하였다.
데이터 분석과 통계처리
본 연구에서 벼 재배 실험은 완전임의배치 3반복으로 온실에서 수행하였고, 토양의 분석도 3반복으로 수행한 후 평균값을 도출하여 표와 그래프를 작성하였다. 모든 데이터의 통계처리는 Statistical Analysis Software (SAS ver. 9.2, SAS institute, USA) 프로그램을 사용하여 처리 간 분산분석 (ANOVA)을 실시하였다. 처리별 유의성은 Duncan 다중검정 (p = 0.05)을 통하여 판단하였다.
Results and Discussion
비소 수준별 토양 화학적 특성 변화
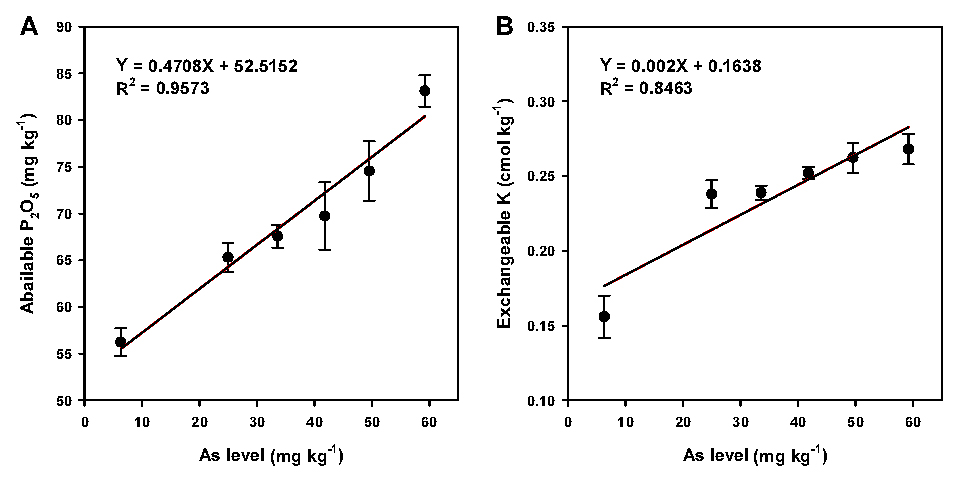
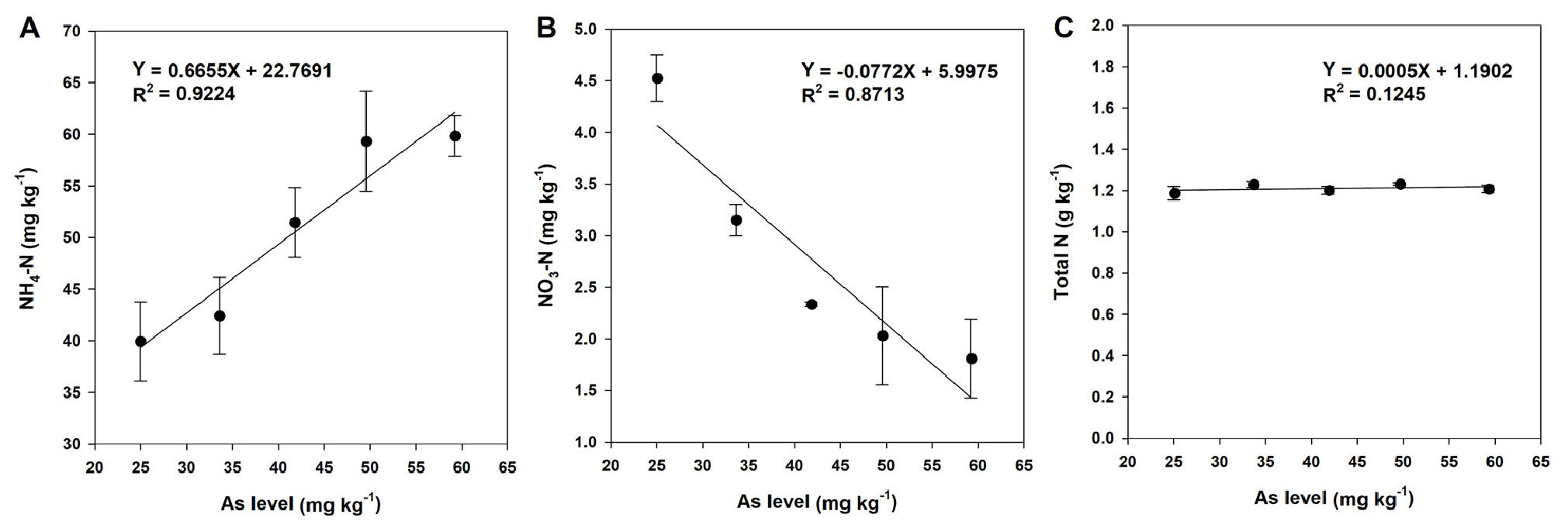
비소를 각각 25, 34, 42, 50, 59 mg kg-1의 농도로 처리한 토양의 화학적 특성 중 pH, EC, 유기물 함량, 치환성 Ca, Mg, Na 함량은 비소 농도가 증가하더라도 비슷한 수준을 나타냈다 (Table 1). 하지만 식물 생장에 필수적인 다량원소 관련 토양 중 유효인산, 치환성 K, 무기태 질소 (NH4+, NO3-) 함량은 비소 농도가 증가함에 따라 유의하게 증가 또는 감소하는 경향을 나타냈다 (Figs. 1, 2). 이와 같은 결과는 다양한 원인에 의해 발생한 결과로 보여진다. 우선 토양 중 유효인산 함량은 토양 비소 농도가 증가할수록 증가하는 경향을 보였는데, 이는 인산과 비소가 토양 흡착 자리를 두고 경쟁 관계를 보이기 때문에 토양 중 비소가 증가하면서 토양에 흡착되어 있던 다량의 인이 탈착되어 토양 중 유효인산 함량이 증가한 것으로 판단된다 (Bolan et al., 2013; Lee et al., 2017; Kim et al., 2020). 더욱이 토양 중 비소와 인의 경쟁관계는 식물이 인을 흡수하는 과정 중에서도 나타나기 때문에 토양 중 비소 함량이 증가할수록 식물 내 흡수되는 인의 함량이 감소하여 토양 내 유효인산 함량이 증가할 수 있다 (Bolan et al., 2013).
Table 1.
Chemical properties of the soil analyzed after harvesting rice plants at the harvesting stage.
또한, Jung et al. (2017)은 토양 중 비소 함량이 0 - 75 mg kg-1 범위 내에서 토양 비소 함량이 증가할수록 벼 수량은 저하되고, 재배 후 토양 유효인산과 치환성 K 함량은 높아지는 것으로 나타났다. 수경재배 조건 하에서도 양액 내 비소 함량이 증가할수록 식물 (winter wheat)의 수량은 감소하였고, 식물 줄기 내 Ca, Mg 함량은 증가했지만 N, P, K 함량은 감소하는 경향을 나타냈다 (Liu et al., 2008). 이러한 결과를 볼 때, 토양 중 비소 함량이 증가하면 비소 독성에 의해 식물 생장이 저하되고 결국 식물이 질소, 인, 칼륨 등 다량 영양물질을 흡수하지 못해 토양 중 이들 함량이 증가할 수 있는 것으로 판단된다.
토양 중 총질소 함량은 비소 수준에 의한 차이는 없었지만 (Fig. 2C), 토양 중 질산태 질소 함량은 암모늄태 질소와는 달리 비소 함량이 증가할수록 감소하는 경향을 보였다 (Fig. 2B). 이는 토양 중 비소 증가로 암모니아 산화 미생물의 풍부도와 활성에 부정적 영향을 미쳐 토양 중 질산화 잠재력이 낮아진 결과로 보여진다 (Subrahmanyam et al., 2014).
비소 수준별 벼 생육 차이 및 백미 비소 함량
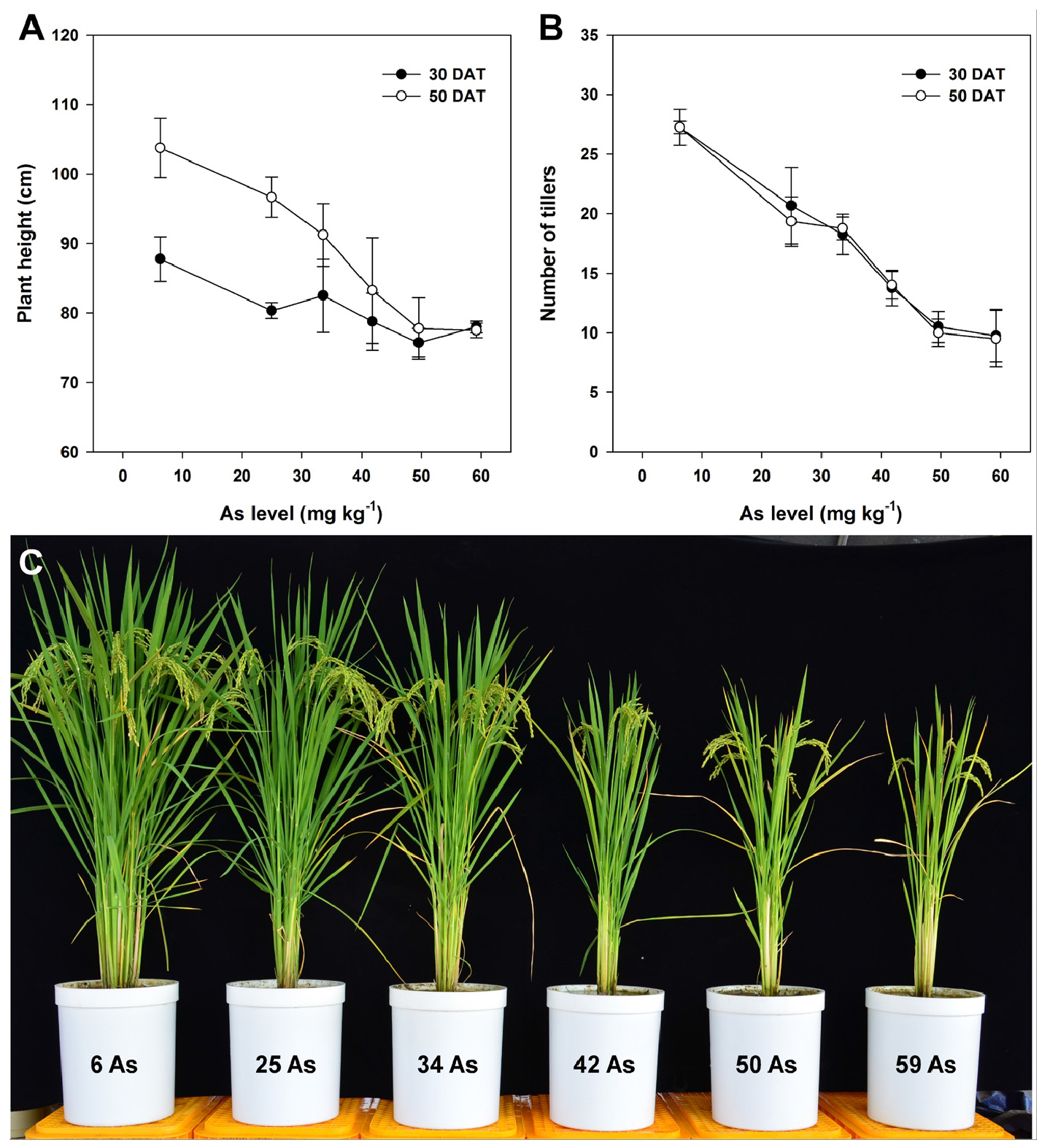
식물이 토양으로부터 비소를 흡수하면 비소 독성에 의해 세포막이 손상되어 전해질 손상이 발생하는 등 다양한 생리적 과정이 취약해지며 결과적으로 식물 생장을 억제하게 된다 (Kaya et al., 2020; Verma et al., 2020). 고농도 비소에 노출된 벼는 등숙 불량에 의해 이삭이 꼿꼿하게 유지되고, 벼 잎의 클로로필 a와 b가 감소하여 결국 광합성에 부정적인 영향을 미친다 (Kumarathilaka et al., 2018). 또한, 식물체 내 비소가 축적되면 거대분자와 세포막을 손상시키는 활성산소가 생성된다 (Finnegan and Chen, 2012; Siddiqui et al., 2020). 본 연구에서도 토양 중 비소 함량이 증가할수록 분얼기 (이앙 후 30일)와 유수형성기 (이앙 후 50일)에 벼의 초장과 분얼수는 모두 감소하였고 (Fig. 3A, 3B), 토양 중 비소가 가장 높은 토양 (59 mg kg-1)에서 수확한 벼는 백미 시료를 수집할 수 없을만큼 수량이 불량했다 (Fig. 3C).
토양 비소 수준별 수확한 벼의 수장, 수수, 수당립수, 등숙률, 천립중 및 수량을 조사한 결과는 Table 2와 같으며, 토양 분석 결과를 통해 예상할 수 있듯이 토양 비소 함량이 증가할수록 벼의 생산성 지표가 모두 낮은 것으로 나타났다. 또한, 토양 중 비소가 가장 낮은 토양 (비소 무처리구)에서 재배한 벼의 수확량 대비 비소 함량이 가장 높은 토양에서 재배된 벼의 수확량은 1/10 수준으로 나타나 비소의 독성이 벼 생산성에 매우 악영향을 미치는 것을 확인할 수 있었다.
백미 중 비소 함량은 토양 비소 수준에 따라 0.08 - 0.48 mg kg-1의 범위를 나타냈다. 토양 비소 함량이 증가할수록 백미의 비소 함량이 일정하게 증가하였으며, 비록 본 연구는 백미의 총 비소 함량을 분석했지만, 식품공전에 제시된 쌀의 무기 비소 기준 (0.2 mg kg-1)가 비교해보면 최대 2.4배 높은 것으로 나타났다.
Table 2.
Yield and yield components of rice plants as affected by As levels.
토양과 백미 비소 함량 간의 관계
토양의 총 비소 함량과 백미의 비소 함량 간의 관계는 Fig. 4A와 같이 양의 상관성을 보였으며, 토양 중 총 비소 함량이 21.85 mg kg-1일 때 백미의 비소 함량이 식품공전 기준인 0.2 mg kg-1에 도달하는 것으로 나타났다. 일반적으로 작물의 중 (준)금속 함량은 토양 중 총 중 (준)금속보다 식물 유효태 함량에 직접적인 영향을 받지만 (Kim et al., 2012, 2019), 본 연구는 동일 토양에 인위적으로 비소를 오염시켜 실험을 진행하여 토양 중 총 비소 함량과 백미의 비소 함량 상관성이 높은 것으로 나타났다. 토양 중 Mehlich 3로 추출한 식물 유효태 비소 함량도 비소 수준이 증가할수록 유의하게 증가하는 것으로 나타났으며 (Fig. 4B), 식물 유효태 비소 함량이 1.04 mg kg-1를 초과하게 되면 백미의 비소 함량 기준 0.2 mg kg-1을 초과하는 것으로 나타났다.
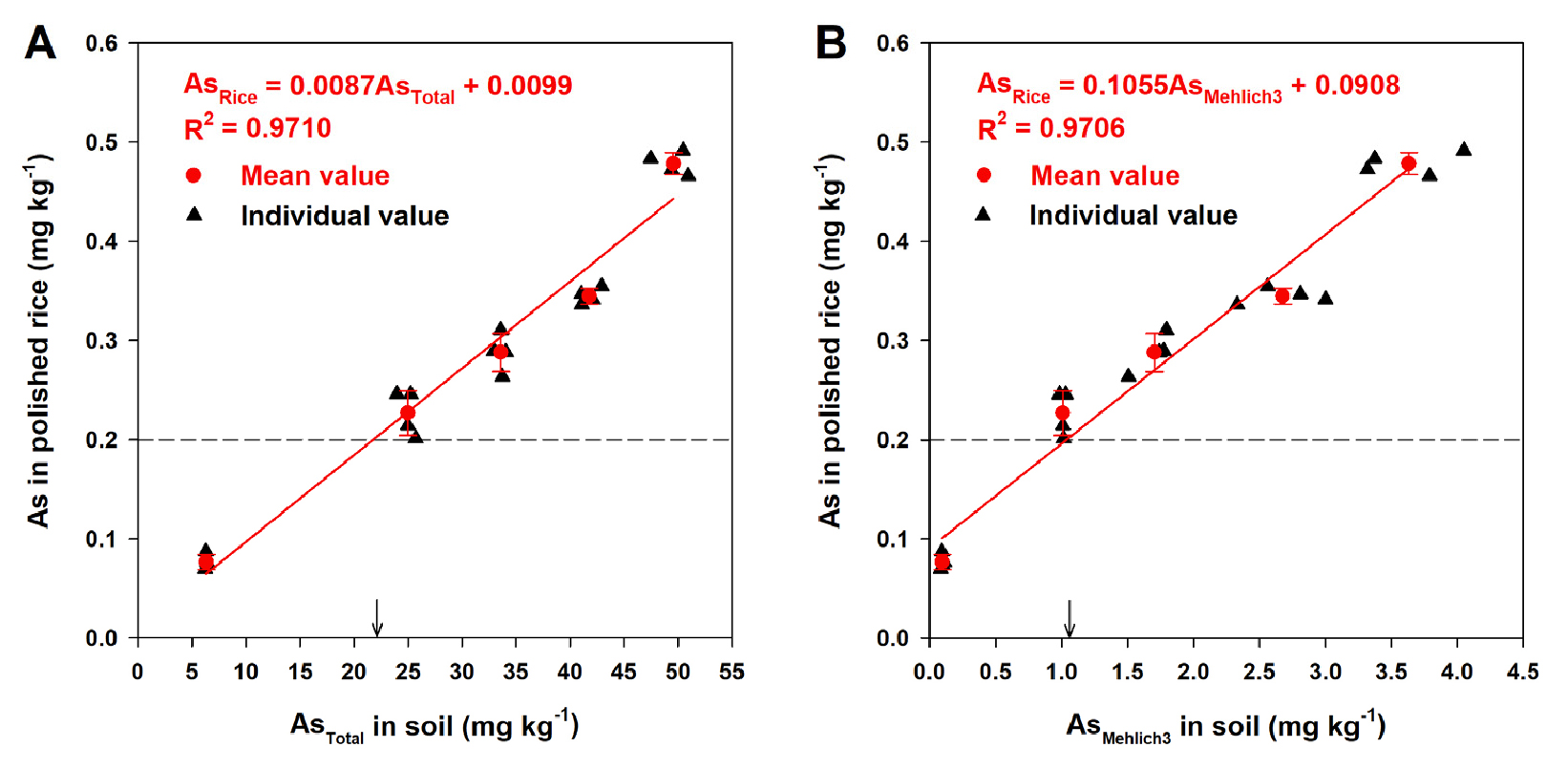
Fig. 4.
Relationship between total (A, AsTotal) and phytoavailable (B, AsMehlich3) As concentrations in the soil and As concentrations accumulated in polished rice (the red circles indicate mean values of four replications (n = 4); the black triangles indicate individual values). Regression equations generated using concentrations of the AsTotal and AsMehlich3 in soils and As concentrations in polished rice. AsTotal and AsMehlich3 indicate total and Mehlich3 extractable As, respectably. Arrow (↓) indicates concentrations of the AsTotal and AsMehlich3 in soils for the edible limiting concentration of As in polished rice (0.2 mg kg-1) in Korea. Vertical bars represent standard deviations of the mean.
Conclusions
본 연구에서는 동일한 토양 조건에서 비소 수준 증가가 토양의 화학적 특성 및 벼의 생육 특성 그리고 백미의 비소 함량에 미치는 영향을 평가하였다. 토양 중 비소 함량이 증가하면서 비소 독성에 의해 벼의 생장은 저해되었고, 백미의 비소 함량은 증가하였으며, 토양 중 유효인산, 치환성 K, 암모늄태 질소 등 대표적인 영양물질 함량은 높아지는 것으로 나타났다.
결과적으로 토양 중 비소의 증가는 토양의 영양물질 함량에 직접적인 영향을 주는 것을 확인하였고, 향후 후속 연구를 통해 비소 오염이 다양한 조건의 농경지 토양 특성에 미치는 영향 평가가 필요할 것으로 판단된다.