Introduction
Materials and Methods
토양 시료
CHCl3에 의한 cell lysis (세포 파쇄)
추출 및 미생물 생체 탄소량 결정
토양 화학성
Results and Discussion
세포 파쇄 (cell lysis) 전후에 추출된 TOC의 양
CHCl3 노출 방법에 따른 추출 계수 (KEC)의 차이
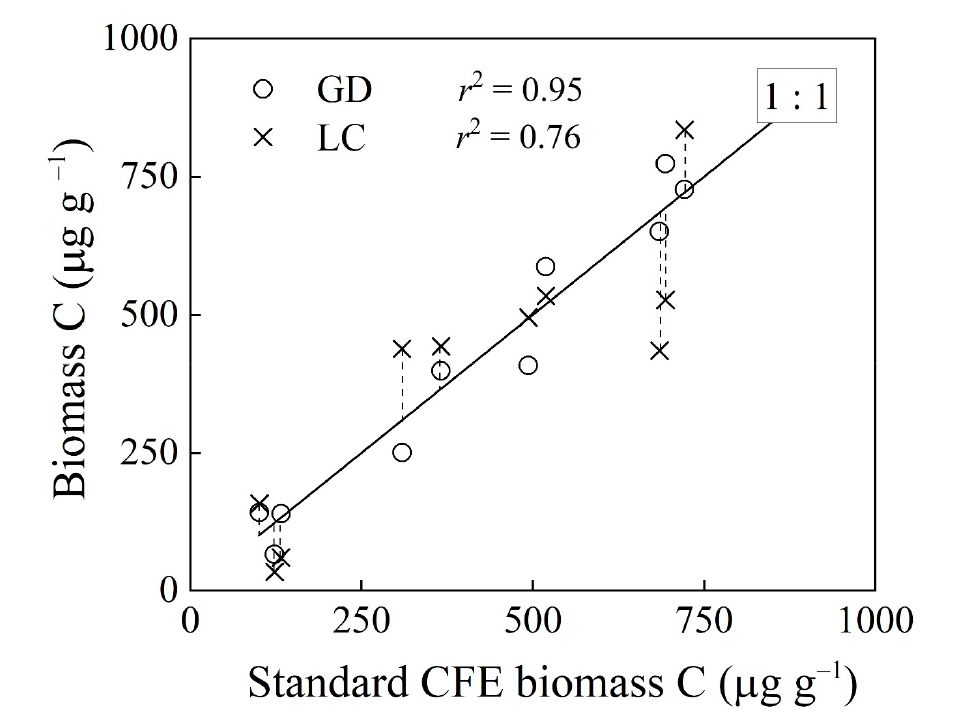
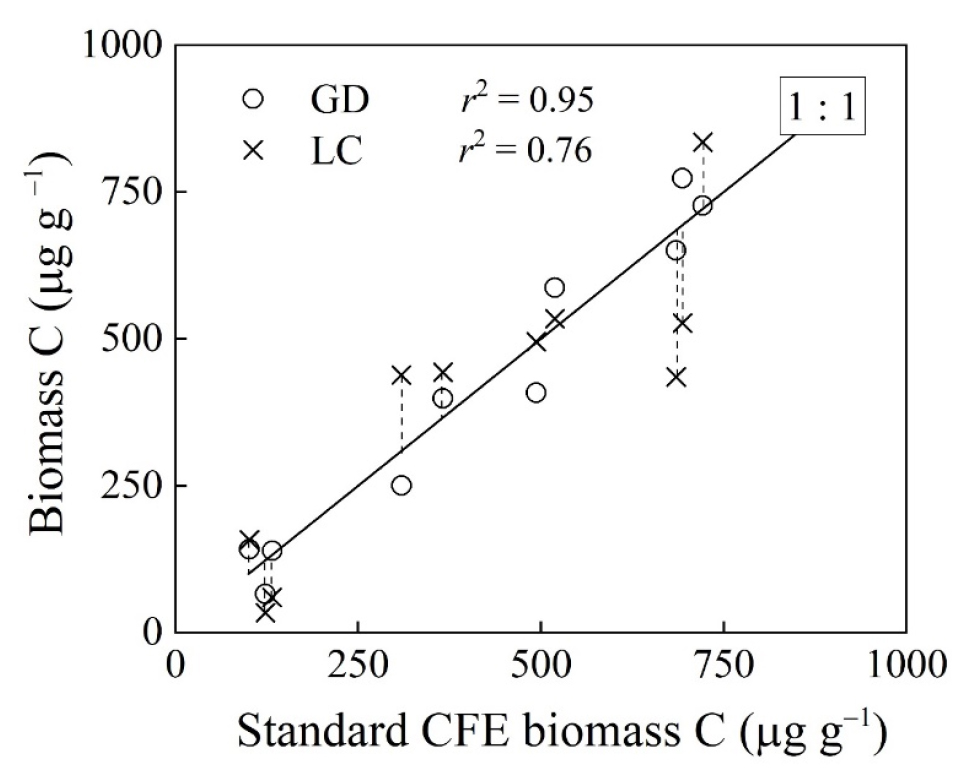
토양 미생물 생체 탄소량의 비교
Introduction
토양 미생물은 탄소와 질소를 포함한 수많은 물질들의 전지구적 순환에 매우 중심적인 역할을 수행한다. 하지만, 일반적으로 토양의 유기 탄소 함량은 건조 질량의 1 - 4% 수준이고, 토양 미생물은 다시 토양 유기 탄소 함량의 1 - 3% 미만에 불과한 것으로 알려져 있다 (Anderson and Domsch, 1989; Sparling, 1992). 한편, 미세한 토양 미생물의 양을 정밀하게 측정하는 것은 한 토양의 건강성 혹은 질을 평가하는 데 있어서 필수적인 요소로 고려되고 있다 (Jordan et al., 1995; Yoon et al., 2019; Moon et al., 2020).
토양 미생물의 정량을 위해서 평판 콜로니 계수법 (plate colony counting), 지방산 바이오마커를 활용한 인지질 지방산 (phospholipid fatty acid) 분석법, 그리고 DNA 혹은 RNA 정량법, ATP 정량법 등 많은 방법들이 활용되고 있고 (White et al., 1979; Nielsen and Winding, 2002; Leckie et al., 2004), 각기 장단점이 있어서 범용적 표준으로 받아들여지는 방법은 아직 존재하지 않는다. 하지만, 클로로폼 훈증 항온배양법 (chloroform fumigation and incubation, CFI)과 클로로폼 훈증 추출법 (chloroform fumigation and extraction, CFE)는 다른 측정법들과 달리 토양 미생물의 생체량을 탄소 기준으로 파악할 수 있는 장점이 있어서 널리 사용되고 있다 (Vance et al., 1987; Wu et al., 2000). 특히, CFE는 미생물의 세포 파쇄 (cell lysis) 작용을 하는 훈증 후 탄소 정량이 CFI에 비해 간편한 장점이 있다. 하지만, 이 두 방법 모두, 세포 파쇄 정도가 CHCl3 기체의 효과적인 토양 공극 내 침투 및 확산 정도에 크게 의존한다. 아울러, CFE는 세포 파쇄물 (cell lysate)을 모두 추출할 수 없으므로 이를 고려한 추출계수를 따로 고려해야 하는 단점이 있다 (Vance et al., 1987). 위 CFE 과정의 단점을 극복하기 위해 혹은 보다 신속/간편한 정량을 위해 변형된 방법들이 제시된 바 있는데, 대표적으로는 토양 시료에 액체 CHCl3를 바로 가하는 방법과 (Shibahara and Inubushi, 1995; Witt et al., 2000) 소량의 CHCl3를 함유하는 수용성 용액 (K2SO4)으로 교반 후 추출하는 방법이 있다 (Fierer, 2003; Fierer and Schimel, 2003). 하지만, 이러한 변형된 방법들은 소수성인 CHCl3이 친수성 환경에서 효과적으로 세포에 접근하여 파쇄하는 정도에 한계가 있다.
이에 본 연구는 기존의 CFE 변형법들보다 좀 더 개선된 접근으로, (1) 실리카 기반 고체 매트릭스 표면에 액체 CHCl3를 얇게 코팅한 후 토양 시료들과 혼합균질한 다음 항온배양하는 방법을 제시하고, (2) 이 새로운 방법이 표준 CFE 및 기존 직접 액체 추출법과 비교하여 세포 파쇄 정도, 추출 계수, 최종적인 미생물 생체량 결정에서 보이는 차이를 조사하고, (3) 아울러 간편하고 신속한 토양 미생물 생체 탄소량 측정을 위한 적용성을 검증하고자 하였다.
Materials and Methods
토양 시료
농경지, 임지, 초지에서 각 토지이용 형태 별로 비교적 넓은 범위의 미생물 생체 탄소량 비교가 가능하도록, 토양 유기물 함량 차이가 비교적 큰 토양 시료들을 2019년 6월 충북 청주시 충북대학교 캠퍼스 내 10개 지점에서 채취하였다 (Table 1). 미생물 생체량 분석은 채취 후 신선한 시료를 즉시 2 mm 체로 거른 후 실시하였고, 토양 화학성 분석은 시료를 풍건 후 일반적인 과정에 따라 수행하였다.
Table 1.
Chemical properties of examined soils.
CHCl3에 의한 cell lysis (세포 파쇄)
세포 파쇄는 a) Vapor fumigation (VF), b) Liquid chloroform (LC), c) Gas diffusion (GD), 등의 세 방법에 의해 수행되었다. 표준 CFE는 진공 상태에서 CHCl3를 끓여 훈증하는 VF 처리에 해당하고, 기준이 되는 Horwath and Paul (1994)의 방법에 따라 3차례 훈증 갱신 과정을 거친 후 25°C에서 24시간 항온배양하였다. LC는 Fierer (2003)의 방법을 약간 변형하여 토양 약 5 g에 CHCl3 4 mL와 0.5 M K2SO4 추출용액 25 mL를 가한 후 4시간 동안 진탕교반하였다. 본 연구에서 새로 시험된 GD는, 40 mL 유리 원심분리 튜브에 시약 등급 sea sand (300 - 600 mm; CAN6433, Wako, Osaka, Japan) 5 g를 넣고 0.4 mL CHCl3 (ethanol free)를 가하고 볼텍싱하여 고체 표면에 CHCl3가 얇게 코팅되도록 하였다. 이어서 즉시 습윤 토양 시료 약 5 g을 넣고 Teflon liner가 장착된 캡으로 밀봉 후 25°C에서 24시간 항온배양하였다. 항온배양 종료 후 CHCl3 5 mL를 추가로 가한 후 2분간 초음파 처리 (sonication)한 다음 1시간 동안 상온배양하였다.
추출 및 미생물 생체 탄소량 결정
VF 처리 시료들은 표준 CFE 방법에 따라 데시케이터 내부 진공을 형성/해소하는 과정을 6회 반복하여 CHCl3을 제거한 후, 0.5 M K2SO4 추출용액을 1:5 비율로 가한 후 1시간 동안 교반하여 추출하였다. LC 처리 시료들은 원심분리 (3,000 rpm, 5분) 후, 상등액을 취해 Fierer (2003)의 방법에 준해 gas blowing concentrator (S-024, Tokyo Rikakikai, Tokyo, Japan)로 10분간 N2 폭기 (bubbling)하여 용존 CHCl3를 제거하였다. GD 처리 시료들은 10 mbar 이하의 진공조건에서 1시간 동안 CHCl3을 제거한 후 표준 CFE와 동일하게 추출하였다. 각 추출된 시료들은 UV persulfate 산화법을 적용한 TOC analyzer (Sievers 5310c, GE, Boston, MA, USA)로 총유기탄소 (total organic carbon, TOC)를 측정하였다. CHCl3가 처리되지 않은 각 대조구들도 같은 방법으로 분석하였고, 미생물 탄소량은 다음과 같은 계산식으로 결정하였다 (Vance et al., 1987).
여기서, EF와 ENF는 각각 CHCl3가 처리 혹은 무처리된 시료들로부터 추출된 유기탄소 양이다 (단, 추출 비율과 토양 수분함량을 고려하여 토양 건조 질량 단위로 계산함). KEC는 각 처리의 세포 파쇄 효율 및 추출되는 세포 파쇄물의 정도를 전반적으로 나타내는 계수이고, 표준 CFE 법의 경우, 이 값은 약 0.45로 알려져 있다 (Vance et al, 1987; Joergensen and Mueller, 1996).
토양 화학성
토양 pH와 EC는 시료를 증류수 1:5법으로 측정하였고, 유기물 함량은 표준 중크롬산 분해법으로 분석하였다 (Nelson and Sommers, 1996). 유효인산은 Bray-1 액으로 추출 후 몰리브덴청법으로 측정하였고 (Kuo, 1996), 암모늄태 및 질산태 질소는 토양을 2 M KCl로 추출 후 각각 인도페놀법과 Salicylate nitronation법으로 분석하였다 (Bolleter et al., 1961; Cataldo et al., 1975). 기본적으로 모든 분석은 3반복 실행되었으며, 최소유의차 (LSD) 등의 통계분석은 SAS (ver 9.4, SAS Institute, USA) 프로그램을 이용하였다.
Results and Discussion
세포 파쇄 (cell lysis) 전후에 추출된 TOC의 양
CHCl3이 처리되지 않은 대조시료로부터 추출된 TOC (ENF)는 시험된 세 방법 모두 동일한 수준의 양을 보였고 (Fig. 1a), 본 연구에서 사용된 시약 등급의 sea sand와 같은 입자 매트릭스는 미생물 생체 탄소량을 측정하는데 안전하게 사용될 수 있음을 확인하였다. 각 토양에서 추출된 ENF의 양은 일반적으로 토양 유기물 함량이 높을수록 증가하는 경향이었다 (Table 1). 한편, 세포 파쇄 후 추출된 TOC (EF)는 세 방법 모두 ENF보다 크게 증가하였으나 (Fig. 1b), 용액 상태에서 CHCl3가 토양에 노출/접촉되는 방법 (LC)에 비해 CHCl3를 가스 상태에서 확산시키거나 (GD) 혹은 진공 상태에서 훈증 (VF)하는 경우 유의하게 더 높은 EF 값을 얻을 수 있었다. 이 결과는 VF를 사용하는 표준 CFE 방법에서 셀 파쇄 효율이 CHCl3 증기의 토양 공극 내 침투/확산 정도에 의존한다는 선행연구들의 해석들과 궤를 같이 한다 (Brookes et al., 1985; Martens, 1995; Jenkinson et al., 2004). 전반적으로 VF법이 가장 높은 수준의 추출 TOC를 보여 가장 높은 셀 파쇄 효율을 보이는 것으로 판단되지만, 본 연구에서 제안된 GD법은 진공상태에서 CHCl3를 끓여야 하는 표준 CFE에 비해 매우 간단하고 적은 노력을 요구하는 장점이 있다.
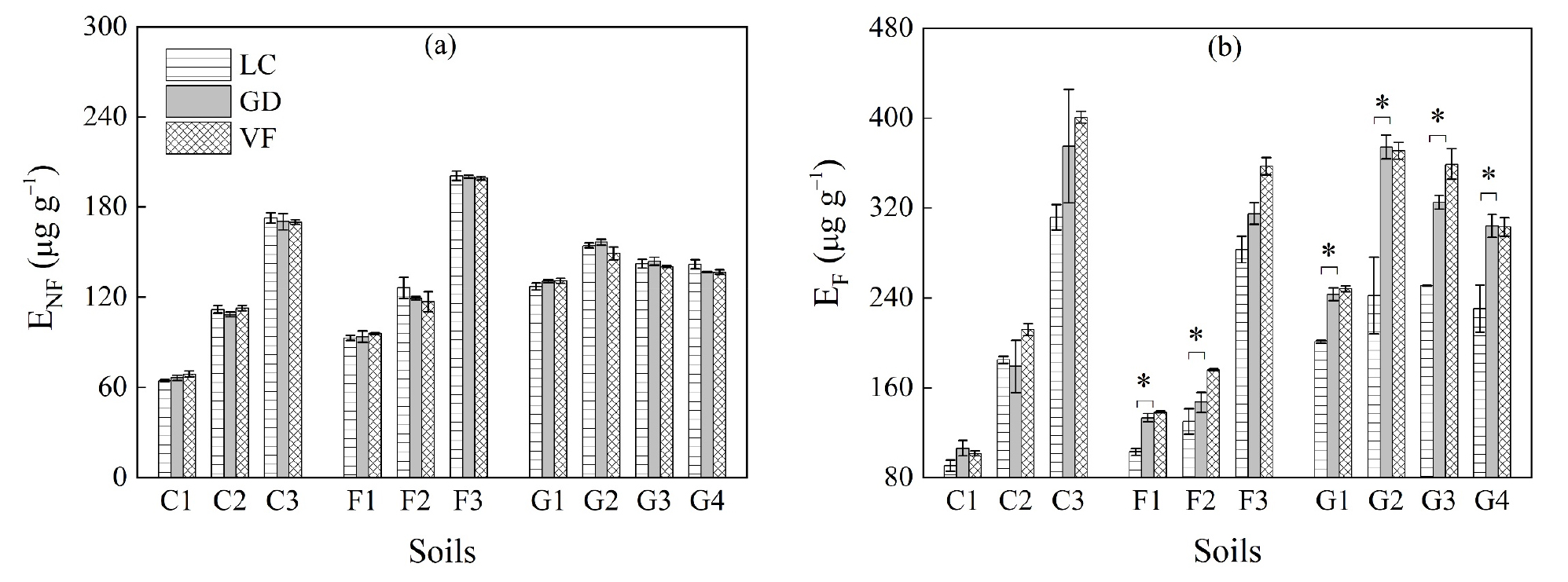
Fig. 1.
TOC extracted from soil samples before (a) and after (b) CHCl3 cell lysis (ENF and EF, respectively). The ENF and EF values were evaluated per dry mass from TOC concentration of each extract multiplied by the extraction ratio (1:5). LC, liquid CHCl3; GD, gas diffusion; VF, vapor fumigation. Error bars represent standard error (n = 3). The * symbol indicates a significant difference among the treatments at p < 0.01 (by the Fisher LSD test).
CHCl3 노출 방법에 따른 추출 계수 (KEC)의 차이
표준 CFE 법에 따라 토양 미생물 생체 탄소량을 측정하는 경우, KEC 값은 약 0.45로 알려져 있다 (Vance et al., 1987; Joergensen and Mueller, 1996). 하지만, CHCl3를 용액 상태에서 토양과 접촉/교반 하거나 (LC), 가스 상태에서 확산시킬 경우 (GD)에는, 각 방법의 셀 파쇄 정도 및 K2SO4 용액으로 추출 가능한 세포 분획을 종합적으로 반영하는 추출 계수 (KEC)를 새로 정의하는 것이 필요하다. Table 2에서 보는 바와 같이, LC법과 GD법 모두 표준 VF로 얻어진 세포 추출 유기탄소 (EF - ENF) 양과 매우 높은 정량적 상관관계를 보였고 (p < 0.001), 이로부터 구해진 KEC 값은 각각 0.24 그리고 0.40이었다. 하지만, 본 연구에서 제안된 GD법이 표준 CFE와 더 높은 상관관계를 보임은 물론, 계산된 추출 계수 역시 표준법의 0.45에 가까웠다. LC법의 상대적으로 낮은 KEC는 선행연구에서 보고된 값들과 유사한 수준이었고, CHCl3/H2O 혼합액 상태에서 소수성인 CHCl3이 효과적으로 세포에 접근하는데 제한이 있기 때문으로 여겨진다.
Table 2.
Extraction coefficients (KEC) evaluated for facilitated gas diffusion (GD) and liquid chloroform (LC) treatments.
| Regression equation | r2 (p value) | KEC† | |
| GD | y = 0.89x‡ | 0.80 (<0.001) | 0.40 |
| LC | y = 0.53x | 0.66 (<0.001) | 0.24 |
토양 미생물 생체 탄소량의 비교
LC법과 GD법 모두, 각 추출 계수를 적용하여 얻어진 미생물 생체 탄소량에서 표준 CFE로 얻어진 결과와 높은 상관관계가 있었지만 (Fig. 2) LC법은 상대적으로 무작위 편향 (random bias)이 상당히 컸고, 이 바이어스들은 미생물 생체량이 작거나 큰 것에 편중되지 않고 비교적 고르게 분포하였다. 한편, 일반 대기압에서 가스 확산을 이용하는 GD법을 사용해 얻은 미생물 탄소량은 VF를 사용하는 표준 CFE의 결과와 매우 잘 일치하였고 (r2 = 0.95, p < 0.001), 비교적 1:1 선에 잘 수렴하였다. 따라서 본 연구에서 제안된 GD법은 상대적으로 적은 노력과 간편한 토양 미생물 생체 탄소의 측정이 가능할 뿐만 아니라, 표준 CFE에 비해 상대적으로 다소 낮은 정확도에도 불구하고, 간단/신속 측정을 위한 잠재력이 크다고 여겨진다. 향후, 다양한 토양들에 대해 연구를 수행함으로써 보다 정확한 추출 계수를 정의하고, 실제 적용성을 검증하는 노력이 필요할 것으로 사료된다.