Introduction
Materials and Methods
토착미생물 분리 및 Auxin 생산균주의 선발
Auxin 생산균주의 질소 활성 검정
균주의 동정, 16S rDNA 염기서열 분석
시험토양 및 처리방법
토양 및 식물체 분석
오이 생육촉진 실험
통계분석
Results and Discussion
식물생장 촉진활성을 가진 균주 선발
염기서열 분석 및 생물학적 동정
토양 이화학성 변화
식물체 무기성분 변화
오이 생육 촉진 효과
Conclusion
Introduction
작물 재배 과정에서 생육 촉진과 병, 해충 및 잡초 방제를 목적으로 사용되는 비료와 농약은 생산성 향상 및 수확량 증대, 노동력 절감 등 고품질 농산물의 재배를 위하여 필수적으로 사용되는 농자재이다 (Ahn et al., 2013; Kim et al., 2018). 하지만 농약의 잠재적 인체 위해성에 대한 문제 제기는 꾸준히 이어지고 있으며, 비료의 경우 양분을 과다하게 사용하여 토양에 염류를 집적시켜 이온독성, 수분저해, 등 작물 생육을 저해할 뿐만 아니라 환경오염의 원인이 되기도 한다 (Lee et al., 2009; Noh et al., 2010). 우리나라에서는 2019년 1월 1일부터 PLS (Positive List System) 제도를 전면 시행하여 농산물에 잔류허용기준이 설정되지 않은 경우 0.01 mg kg-1 기준을 일률 적용하는 잔류농약 허용기준을 강화하고 있다 (Park et al., 2019). 식품의 안전성이 중요시되면서 소비자들은 친환경, 유기농산물에 대한 관심이 증가하고 있으며, 소득수준이 크게 향상됨에 따라 안전성과 친환경 웰빙 메뉴 및 식품 고려사항에 점차 큰 비중을 차지하고 있다고 있다 (Kim and Lee, 2017). 또한, 소비자의 친환경 농업에 대한 관심의 증가와 함께 농, 축산물 생산자의 입장에서 과도한 화학제품 사용에 대한 부작용을 우려하고 있으며, 이러한 상황에 대한 대체재로서 선호하여 농업미생물 수요량이 평균 12.5% 증가하고 있다 (Santoyo et al., 2012; Cho et al., 2019; Morder intelligence, 2020). 농업 분야에서의 미생물은 작물 병 방제 및 생장촉진 등으로 큰 잠재력을 가지고 있고, 환경오염에 대한 걱정이 적어 미생물을 활용하기 위한 연구가 활발한 추세이다 (Kang et al., 2018).
토양 미생물은 토양 환경 및 식물 생육에 직, 간접적으로 영향을 미치는 것으로 알려져 있다 (Santoro et al., 2015). 특히, 토양 미생물 가운데 식물 생장 촉진 근권 미생물 (plant growth promoting rhizobacteria, PGPR)은 식물의 뿌리를 직접 또는 간접 메커니즘에 의해 식물 성장을 자극할 수 있다고 알려져 있다 (Ahmad et al., 2008). PGPR의 작용은 무기원소와 수분 흡수 및 식물성장 촉진으로 수확량 증가, 식물 호르몬 분비, 병원균 감소, 생물적 또는 비생물적 식물 스트레스 감소 등 다양한 기능이 있다 (Adesemoye and Kloepper, 2009; Dodd et al., 2010). 또한, PGPR은 가축분뇨 및 비료와 함께 점점 더 많이 사용되고 있으며, 미생물 및 효소 활동을 통해 토양개량, 병해충 방제, 유해물질 분해, 제초 등 유용한 활성을 가진 PGPR을 선발하여 지속 가능한 농업환경을 조성하는데 기여하고 있다 (Mahanty et al., 2017; Hassen et al., 2018). 성장 촉진 외에도 농업에서 PGPR의 생물 방제 잠재력을 보고한 수많은 연구가 있다 (Adesemoye and Kloepper, 2009). 현재 PGPR을 장, 단기적으로 농업환경의 복원과 유지에 중점을 두는 친환경적인 방법으로 실제로 여러 농가에서 활발히 이용되고 있다. 이러한 유용미생물의 수요와 활용이 증가함에 따라 2016년 (134개 농업기술센터) → 2017년 (137개 농업기술센터) → 2018년 (139개 농업기술센터) → 2019년 (141개 농업기술센터) → 2020년에는 141개 전국 시, 군 농업기술센터에서 192개의 유용 미생물 배양소를 운영하여 농, 축산 농가에 보급하고 있다.
그러나 유용 미생물 배양소에서 사용하는 종균은 여러 대학, 연구기관과 계약하고 사용하는 곳도 있지만, 대부분의 경우 배지업체에 의존하여 배지 구입시 무상으로 제공되는 종균을 분양 받아 활용하고 있다 (Cho et al., 2019). 여러 대학, 연구기관과 종균을 계약하고 사용하는 곳도 있지만, 아직까지 배지업체에 의존하며 종균을 받아쓰는 곳이 대부분이다. 또한, 분양 받은 종균은 계대배양을 여러번 실시하여 농업 유용 활성이 떨어지며, 초저온냉동고 (-70°C)에 균주를 보관하지 않아 종균 보존이 어려운 실정이다. 최근 Cho et al. (2019)는 몇 개의 시, 군 유용 미생물 배양소에서는 목적에 맞는 미생물을 제대로 배양하지 못하고, 대량 배양기의 미숙한 관리 및 운영으로 인해 병원균으로 분류되는 황색포도상구균, Bacillus cereus 병원성 대장균 등 인체 유해한 미생물이 배양되고 있는 것으로 보고하였다. 앞서 기술한 여러가지 종균들의 문제점과 과학적으로 효과가 증명된 균일한 종균을 농가들이 쉽게 활용할 수 있는 방법이 절실하고 시급한 과제라고 할 수 있다. 특히 지자체에서 토착 및 특허 미생물 선발하여 활용하고 있는 시, 군 농업기술센터는 극히 미비하다. 자연환경 내 미생물들은 새로운 종의 미생물을 투입하더라도 토양은 되돌아가는 항상성을 가지고 있어 배양을 통해 얻어진 미생물은 토착 미생물들과 경쟁관계에 있을 수 있고, 특정 환경 내 적응력이 저하될 수 있다 (Coyne, 1999). 현재 배양 가능한 미생물의 기능만으로도 다양한 혜택을 누리고 있지만 아직 배양되지 않은 토착미생물의 잠재력은 엄청날 것으로 추정된다 (Patil et al., 2014).
가시오이는 군위군의 대표하는 작물이며, 경북 최대의 생산지역으로 2005년 161.7 ha의 면적에 32,809 ton의 오이를 생산하였다 (Lee et al., 2006). 특히 염류집적이 많은 시설하우스에 미생물이 많이 이용되고 있다. 아직까지 오이의 생장 촉진을 위한 다양한 농업 유용 활성을 가진 PGPR의 효과에 대한 정보는 거의 없으며, 오이 발생하는 노균병, 흰가루병 및 잿빛곰팡이병에 대한 미생물방제 효과를 검정하는 연구가 대부분이다 (Nam et al., 2010; Lee et al., 2010; Kim et al., 2011; Lee et al., 2013). 오이의 고품질 및 친환경 생산에 필요한 다양한 농업활성을 가진 미생물 제제가 필요한 실정이다.
따라서 본 연구를 통해 군위 다기능 PGPR토착미생물을 분리, 선발하고 이를 미생물제제로 개발하여 오이재배에 활용한다면 친환경적 재배가 가능하게 될 것이다. 전세계적인 친환경 흐름에 부응함과 동시에 화학비료 및 농약으로 인한 농민들의 경영비절감 효과를 가져올 수 있을 것이며, 시, 군 지자체에서 활용가능한 미생물 선발 방법 및 효과적인 토착미생물제제의 희석농도 등 현장 자료로서 활용하고자 수행하였다.
Materials and Methods
토착미생물 분리 및 Auxin 생산균주의 선발
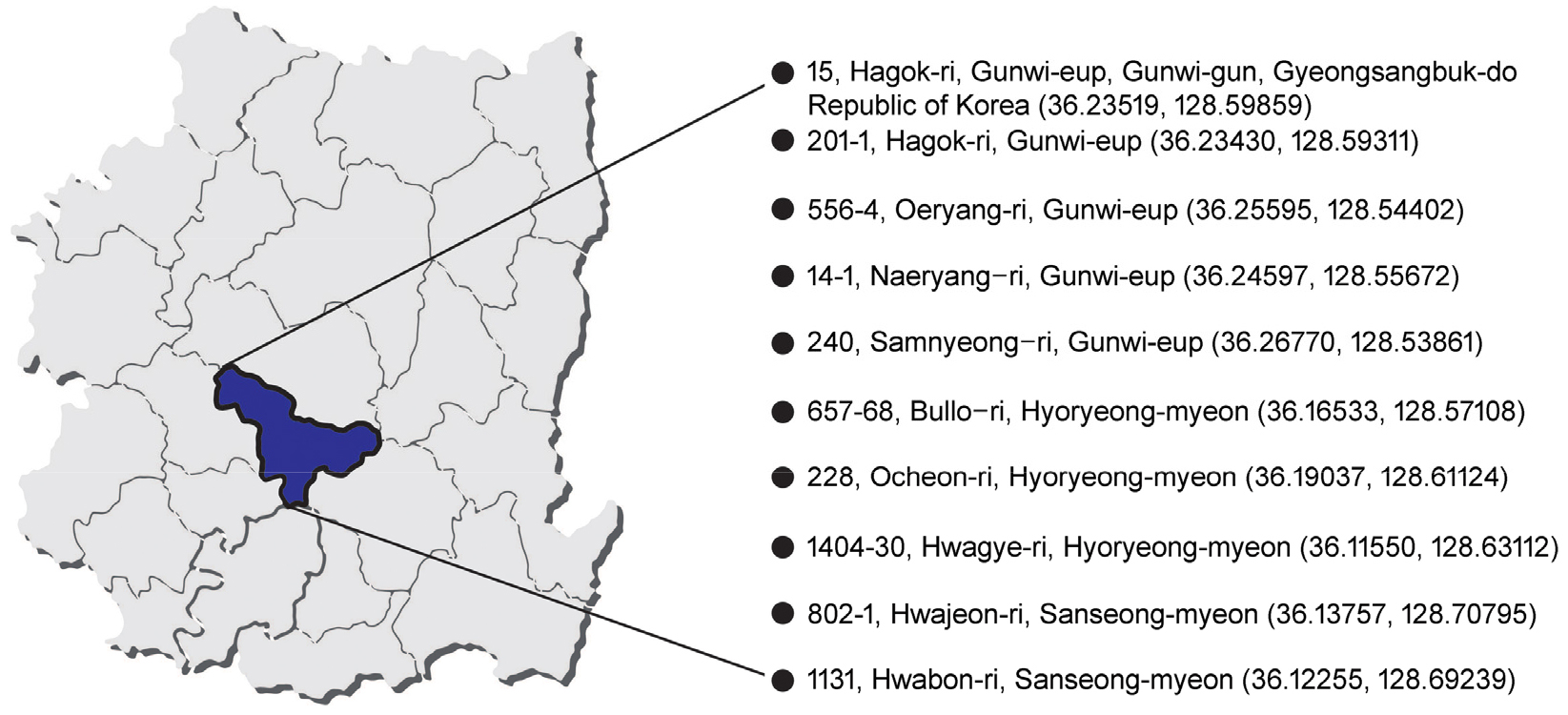
경상북도 군위군 군위읍, 효령면, 산성면에 위치하는 오이 선도농가 10곳의 15 cm 깊이에서 토양시료를 채취하였다 (Fig. 1). 토양시료 1 g과 멸균수 10 mL를 1 : 10 (w : v) 비율로 혼합하여 상온에서 30 분간 200 rpm 조건으로 shacking incubator (Jeiotech, KR/SK-600, Korea)로 교반하였고, 희석평판도말법을 이용하여 1/101 - 105 x의 농도로 희석한 현탁액을 각각 1/10ⅹ LB배지 (tryptone 1 g /L-1, Yeast extract 0.5 g L-1/L, Nacl 1 g L-1/L)에 도말한 뒤 30°C에서 배양하였다. 배양된 토양미생물은 순수 분리를 통해 single colony 1,000 점을 순수 분리하였다. 50% Glycerol을 사용하여 최종 25% 농도의 glycerol stock을 만들어 -70°C 냉동고에 보존한 후 본 연구에 사용하였다.
Auxin 생산균주의 선별은 아래와 같은 과정으로 수행하였다. 먼저, L-tryptophan이 0.3% 첨가된 1/10ⅹ LB broth 배지에 single colony를 접종하였으며 30°C에서 72시간 진탕 배양한 후 12,000 rpm에서 10분간 원심 분리하여 상등액을 확보하였다. Auxin 생성능 확인은 배양 상등액과 Salkowski reagent (5% perchloric acid100 mL, 0.05 M ferric chloride 2 mL)를 1:2 (v/v)로 혼합하고 암조건, 실온에서 30분간 반응시킨 후 색상이 분홍색으로 전환된 것을 auxin 생성능이 있는 것으로 선발하였다 (Thomas, et al., 1991). Auxin의 정량을 위한 표준 곡선 작성에서 표준 물질은 Indole-3-acetic acid (IAA) (Sigma, USA)를 사용하였다. 농도별 IAA 표준 용액으로 salkowski test를 실시하고 UV-vis spectrometer (UV-2401PC, Shimadzu corporation, Japan)를 이용하여 530 nm에서 표준 용액의 흡광도를 측정한 후 측정된 값들을 활용하여 표준 곡선을 작성하였다. 분리된 균주들을 대상으로 auxin 정량을 실시하였으며, auxin을 생산하는 균주를 1차 후보 균주로 선발하였다.
Auxin 생산균주의 질소 활성 검정
선발된 Auxin 생산 균주의 다양한 PGPR 기능을 가진 균주를 최종 선발을 하기 위해 요소 가용화 세균은 요소 가용화 활성 배지 (peptone 1 g, dextrose 1 g, NaCl 5 g, KH2PO4 2 g, urea 20 g, phenol red 0.012 g, pH 6.8 ± 0.1)로 조성된 평판배지를 이용하였다. 요소 가용화 활성 확인은 멸균된 8 mm paper disc (49005020dfsdfsdfsdf, ADVANTEC, Japan)를 배지 위에 올린 후 1차 후보 균주 배양액을 각 10 ㎕씩 30°C에서 3일 배양한 후 paper disc 주변에 pink circle을 확인하였다 (An et al., 2012). 대기중의 질소를 암모니아로 전환시키는 질소고정 활성은 질소 고정 활성 배지 (Sucrose 6 g, MgSO4·7H2O 0.2 g, Na2HPO4 13.9 g, KH2PO4 1.7 g, NaCl 2 g, FeCl3· 6H2O 8 mg, Na2MoO4·2H2O 3 mg, thiamin 1 mg, agar 13 g, pH 7.0) 배지를 사용하여 30°C에서 7일간 배양한 후 평판배지에서 확인하였다 (Becking, 1961). 암모니아 산화활성은 암모니아 산화 세균 배지 [(NH4)2SO4 0.5 g NaHCO3 7.5 g, NaCl 0.3 g, K2HPO4 1.0 g, MgSO4·7H2O 0.3 g, FeSO4·7H2O 0.03 g, pH 7.0]로 조성된 평판배지에 30°C, 7일간 배양하였고 (An et al., 2012), 아질산염 산화 활성은 아질산 산화세균 배지 (K2HPO4 1.0 g, NaNO2 6 mg, CaCl2 ·2H2O 0.3 g, FeSO4 ·7H2O 0.03 g, NaCl 0.3 g, NaHCO3 1.0 g, MgSO4 ·7H2O 0.1 g, pH 7.0)로 조성된 평판배지에 멸균된 8 mm paper disc를 배지 위에 올려 세균을 10㎕ 씩 접종하여 30°C, 7일간 배양하여 Griess-IIosvay시약과 반응시켜 발색되는 정도를 측정하였다 (An et al., 2012). 또한 토양 내 존재하는 아질산과 질산을 N2 gas로 탈질화 하는 탈질세균의 활성은 giltay배지로 medium A [KNO3 2.0 g, l-asparagine 2.0 g, and 1% bromothymolblue (BTB)]와 medium B (sodium citrate 17.0 g, MgSO4.7H2O 2.0 g, FeCl3.6H2O 0.1 g, KH2PO4 2.0 g, CaCl2.6H2O 0.4 g)를 혼합하여 pH 7.0로 조정하여 청색으로 발색 되는 탈질세균을 확인하였다 (Watanabe and Koga, 2009). 질소 활성 확인은 auxin 생성 활성을 가진 1차 후보 균주를 대상으로 시행하였으며, 질소활성 능력이 가장 우수한 균주를 최종적으로 선발하였다.
균주의 동정, 16S rDNA 염기서열 분석
최종 선발된 균주의 분류학적 동정은 GenotechCo.Ltd. Korea에 의뢰하였으며, 최종 선발된 균주의 16S rRNA gene 증폭에는 27F (5’-AGA GTT TGA TCC TGG CTC AG-3’)와 1492R (5’-GGT TAC CTT GTT ACG ACT T-3’) primer set을 사용하였다. 최종 선발된 균주의 16S rRNA gene을 활용한 미생물 동정에는 EzTaxon-e server (http://eztaxon-e.ezbiocloud.net/)를 활용하였으며, Eztaxon type strain 16S rRNA gene database에 등록된 염기서열과 비교하여 상동성을 조사하였다. 최종 선발 균주를 포함한 미생물 계통도는 Molecular Evolutionary Genetics Analysis (MEGA) version 8.0 software 사용하였으며, neighbor-joining method를 활용하여 미생물 간의 계통 발생학적 거리를 계산하였다. 또한, 계통도의 신뢰를 위해 bootstrap method를 사용하였으며 반복수는 1,000번 반복하여 계통도를 작성하였다.
시험토양 및 처리방법
본 연구에 사용된 토양시료의 경우 경상북도 군위군 위치한 오이 재배지 (36°14'41.7"N 128°33'15.6"E)에서 15cm 위치한 근권토양을 채취하여, 이 토양과 마사토 (7:3)비율로 실험에 사용하였다. 화학적 특성은 Table 1과 같다. EC, pH, 유기물 및 유효인산은 각각 8.35, 0.44 dS m-1, 22 g kg-1 및 485.37 mg kg-1 이었다. 상기의 정상지표 범위와 비교하였을 때 EC, 유기물 및 유효인산은 정상범위이나 pH가 8.35로 높았다. 전 NO3-N 함량은 38.05 g kg-1이며, 치환성 양이온은 K, Ca, Mg함량은 0.55, 9.52 및 1.70 cmolc kg-1이었다.
Table 1.
The chemical properties of soil used in this experiment.
토양 및 식물체 분석
본 연구에 사용된 토양시료는 3일 동안 음지에서 자연건조 후 2 mm 체로 고르게 하여 준비하였다. 공시 시료의 이화학적 분석 항목으로는 pH, EC, 유효인산, 유기물 함량, 양이온 함량 등을 측정하였다. 식물체 분석법과 토양화학분석법 (NIAST, 2010)에 준하여 처리구별 토양 및 식물체의 이화학적 특성 변화를 확인하였다. pH 와 EC는 1:5법으로 토양용액을 추출하여 측정하였다. 유기물은 Walkley-Black method를 사용하여 610 nm에서 흡광도를 측정하였으며, 유효인산은 몰리브덴 청법을 사용하여 660 nm에서 비색 정량하였다. 유기물 및 유효인산 측정은 UV-vis spectrometer (UV-2401PC, Shimadzu corporation, Japan)을 사용하였고, 치환성 양이온의 경우 1N NH4OAc (pH 7.0)의 용액으로 추출하여 ICP (Intergra XL, GBC, Australia)를 이용하여 분석하였다. 질산태 질소와 암모니아태 질소는 2M KCl 로 침출한 시료 액에서 암모니아를 제거한 후 켈달 분해 장치 (B-316, Buchi, Switzerland)로 증류한 후 0.01 N 황산 표준용액으로 적정하여 계산하였다. 식물체 무기성분 중 질소 측정은 식물체 시료 0.5 g을 황산염 혼합분말 (K2SO4와 CuSO4 = 9:1)과 농황산을 넣고 분해한 후 켈달 분해 장치 (B-316, Buchi, Switzerland)로 증류한 후 황산표준용액으로 적정 계산하였다. 인은 ammonium vanadate 법으로 UV-vis spectrometer (UV-2401PC, Shimadzu corporation, Japan)를 사용하여 정량하였고, 칼륨, 칼슘 및 마그네슘은 ICP (Intergra XL, GBC, Australia)로 측정하였다.
오이 생육촉진 실험
식물 실험재료로 오이 접목묘를 이용하였다. 오이 접목묘의 제작에서, 접수 품종은 오이 ‘낙동청장’ (Cucumissativus L. cv. nagdongcheongjang) 대목 품종은 ‘신토좌 호박’ (Cucurbita maxima × C. moschata)을 선정하였으며 파종 후 접수와 대목의 떡잎이 완전히 전개되었을 때, 단근합접 방법으로 접목하였으며 잎이 3옆일 때의 접목묘를 사용하였다. 생육 촉진 검정은 10 × 10 cm 비닐 포트에 군위 오이 재배토양과 마사토 (7:3)비율로 1 kg 충진하고 6 반복으로 오이 접목묘를 growth chamber (JSPC-420C, JSR corporation, Korea)에서 재배하였다. 오이 접목 유묘를 Pot에 정식한 후 주간 평균온도 28°C (16시간), 야간 평균온도 22°C의 (8시간) 습도 65%로 실시하였다. 오이 생장촉진을 위한 미생물 처리는 최종 선발된 균주의 배양액을 7일 간격으로 처리하였으며 1회 처리시, 1 × 10 9 CFU mL-1 농도의 미생물 배양액을 100배, 250배, 500배 희석하여 pot당 40 mL씩 처리하였다. 대조구는 동량의 증류수 및 각각 1/10ⅹLB broth media를 처리하였다. 식물 생육 조사는 농촌진흥청 농업과학기술 연구조사분석기준 (RDA, 2012)에 준하여 최종 수확 후 조사항목은 초장, 엽수, 경경, 엽록소 함량, 근장, 생체중 및 건물중 등을 측정하였다. 엽록소 함량의 경우 SPAD (SPAD 502 Plus, Minolta, Japan)를 활용하였으며 처리당 3회 측정한 평균치를 관측치로 이용하였다.
통계분석
토양 분석 및 식물 생장 조사 결과의 통계처리는 SPSS 프로그램 (SPSS Inc., Chicago, IL, USA)을 사용하였으며 Duncan’s Multiple Range Test (DMRT)를 활용하여 95% (p < 0.05) 신뢰수준에서 통계적 검정을 수행하였다.
Results and Discussion
식물생장 촉진활성을 가진 균주 선발
군위군 오이재배지역 토양에서 분리된 1,000 종의 균주를 배양하여 다양한 PGPR 특성을 조사하였다 (Table 2). PGPR 균주를 조사한 결과, urease, denitrification, ammonia oxidation, nitrogen fixation 등의 식물 생장 촉진 활성을 가진 4 종의 균주를 2차 선발하였다. 이중 옥신 함량이 가장 높은 GW320 균주를 최종적으로 우수 토착 균주로 선발하였다.
Table 2.
Plant growth-promoting capabilities of the isolates from cucumber caltivation soils.
| Strain |
Auxin (µM) |
Urea† (cm) |
Dinitrification† (cm) |
Nitrite oxidation† (cm) |
Nitrogen fixation‡ |
Ammonia oxidizing‡ |
| GW142 | 28 | ++ | +++ | + | ○ | ○ |
| GW320 | 43 | ++ | +++ | + | ○ | ○ |
| GW527 | 21 | + | +++ | + | ○ | ○ |
| GW729 | 11 | + | +++ | + | ○ | ○ |
염기서열 분석 및 생물학적 동정
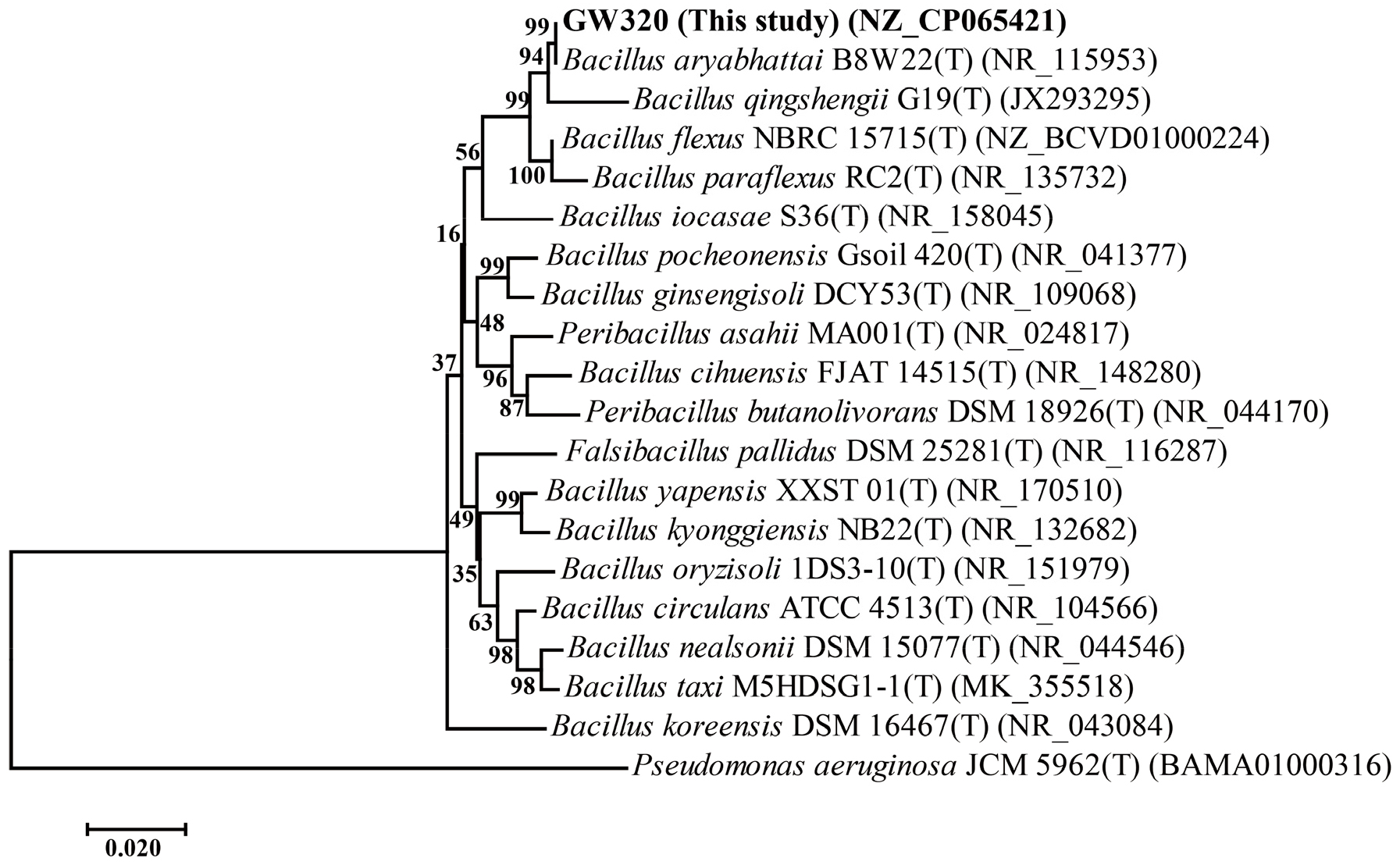
PGP 활성능력이 입증된 균주 4 종의 게놈 DNA를 추출하여 16S ribosomal RNA 유전자를 PCR로 증폭하여 약 1.4 kb의 DNA를 얻었으며, 이의 염기서열 분석을 통해 계통 분류를 진행하였다. 분자 생물학적 방법으로 얻어진 sequencing 결과를 EzTaxon 데이터베이스를 통해 비교, 분석한 결과, GW320의 균주는 Bacillus aryabhattai B8W22 (T) 균주와 99% 일치하는 것으로 나타났으며, 최종적으로 B. aryabhattai GW320으로 명명하였다 (Fig. 2).
토양 이화학성 변화
미생물 처리에 따른 토양의 이화학성분 변화는 Table 3과 같다. 토양의 pH는 양분 흡수와 밀접하게 관련되어 있으며, 대조구는 pH 8.25로 가장 높았고, B. aryabhattai GW320 균주를 100배 희석 처리한 pot에서 pH 8.13으로 가장 낮게 나타났다 (p < 0.05). 토양 유기물은 식물에게 영양원을 공급할 뿐만 아니라 토양 물리성을 개선하며, 토양 수분함량을 증가시킨다 (Kozlowski and Pallardy, 1999). 토양 미생물은 토양 유기물을 구성하는 일부분으로, 유기물의 분해를 조절하고 양분을 공급하여 기타 생물체가 이용하도록 하는 역할을 한다 (Choi et al., 2011). B. aryabhattai GW320 균주를 처리하였을 때, 유기물 함량은 대조구에서 10.47 g kg-1으로 가장 높았으며, GW320 균주 100배 희석처리구는 9.27 g kg-1, 250배 희석처리구는 9.60 g kg-1, 500배 희석처리구는 9.83 g kg-1로 GW320 균주를 처리하였을 때 유기물 함량이 더 낮아지는 것으로 확인되었다 (p < 0.05). 이러한 결과는 B. subtills, B. megaterium와 같이 섬유소 분해력이 있는 미생물에 의한 유기양분의 가용화가 발생되므로 대조구에 비해 유기물이 빨리 분해 된다는 Lee et al. (1997)의 선행연구 결과와 일치하였다 (Lee et al., 1997).
Table 3.
The chemical properties of soil at harvesting stage.
인산의 경우 토양 pH가 7.2보다 낮을 때 H2PO4-, 7.2보다 높을 때 HPO42-로 존재하며 이는 토양 용액에 많이 존재하는 Ca2+와 반응하여 불용성인 CaHPO4 상태가 되어 유효 인산의 농도가 낮아진다는 보고가 있다 (Lindsay, 1979). 본 연구에서는 대조구의 경우 유효 인산의 농도가 271.43 mg kg-1으로 가장 낮았으며, GW320 균주 500배 희석처리구 320.17 mg kg-1, 250배 희석처리구 358.63 mg kg-1, 100배 희석처리구에서 377.53 mg kg-1순으로 확인되어 유의적인 차이를 보였다 (p < 0.05). 토양 유기물 함량이 높고 유효 인산의 농도가 낮은 대조군의 결과는 유기물의 함량이 높을수록 유효 인산의 함량이 낮게 나타난다는 선행연구 결과와 유사하며 B. aryabhattai GW320 균주 처리에 의해 토양 유기물 함량이 낮아지고 유효 인산의 농도가 높아지는 결과는 유기물 분해에 관여하는 토양 미생물들의 영향으로 유효 인산의 함량이 증가한 것으로 사료된다 (Jeon et al., 2020).
질소는 작물생육 제한 인자로서 적정수량을 생산하는데 필수적으로 요구되는 원소이며 (Lee et al., 2016), 무기화, 생물학적 고정, 휘산, 등의 다양한 순환경로를 통해 복잡한 형태로 토양내에 존재한다 (Socolow, 1999). 식물의 뿌리가 흡수할 수 있는 질소의 형태는 주로 용해된 질산태 질소 (NO3--N)와 암모늄태 질소 (NH4+-N)로 알려져 있으며 시설 오이 토양의 질산태 질소 농도와 생산량은 밀접한 관계가 있다고 보고한 바 있다 (Li et al., 2013; Park et al., 2015). 대조구의 NO3--N는 4.29 mg kg-1이며, GW320 균주 처리구에서는 3.12 - 3.88 mg kg-1 인 것으로 확인되어 대조구보다 낮았다. 이는 다양한 질소 활성을 가진 GW320 균주 처리로 식물체로 흡수가 빨라 진 것으로 판단된다. 또한, 전체적으로 토양에 남아 있는 질산태 질소 (NO3--N)가 암모늄태 질소 (NH4+-N)보다 높은 값이 측정되었는데, 이는 무기화로 생성된 암모늄태 질소의 많은 부분이 질산태 질소로 산화되었다는 보고와 일치하였다 (Kim et al., 2020). 식물의 정식 전 토양 (pH 8.35)과 비교하여 모든 처리구에서 pH가 낮아졌으며 특히 GW320 균주를 처리한 오이 토양에서의 pH가 대조구에 비해 더 낮은 것으로 확인되었다. 그 이유는 무기화 과정 중 염기성인 암모니아 (NH3) 생성으로 인해 pH가 높아질 수 있지만, 암모늄태 질소가 질산태 질소로 질산화과정 (2NH4+ + 3O2 → 2NO3- + 8H+)을 거치면서 pH는 더욱 낮아질 수 있다고 하였다 (Escobar and Hue, 2008).
양이온 치환용량은 토양의 특성을 나타내며, 토양의 비옥도를 나타내는 지표로서 토양 완충능 향상, 양분의 보유 및 공급 등에 관여한다. 본 연구에서는 GW320 균주 100배 희석처리구에서 칼륨, 칼슘, 마그네슘 함량이 각각 0.41, 8.86, 1.56 cmolc kg-1 으로 대조구의 0.28, 7.24, 1.16 cmolc kg-1보다 증가한 경향을 보였다. 이는 미생물 시용으로 토양 입단을 형성하여 토양의 이화학성을 개선시켰다는 보고가 이를 뒷받침하고 있다 (Oh et al., 2001). 전체적으로 미생물 처리구는 무처리구에 비해 pH, EC, 유기물, NO3-N 함량이 낮아졌으며, 그 외 성분은 높은 경향이었다. Lee et al. (1997)에 의한 선행연구에 따르면, 식물 생육촉진 세균이 오이생육에 미치는 결과와 같았으며, 토양에 서식하는 토양미생물이 유기물 분해, 양분순환 및 토양의 입단화에 중요한 역할을 한다고 판단된다 (Burr et al., 1978; An et al., 2015).
식물체 무기성분 변화
식물체의 무기성분을 조사한 결과는 Table 4와 같다. 대조구에 비해 GW320 균주 처리구에서 질소, 인산, 칼륨, 칼슘, 마그네슘 성분이 높은 경향을 보였다 (p < 0.05). Montagu and Goh (1990)는 식물이 이용할 수 있는 무기 양분의 양이 높을 경우 작물 생육에 긍정적 영향을 끼칠 수 있다고 보고하였다. 이는 미생물 처리에 의해 식물체의 양분흡수가 더 원활해진 것으로 판단된다. 질소의 경우 대조구 (물)에서 1.46%, 대조구 (배지)에서 1.47%, GW320 균주 500배 희석 처리구 1.77%, 250배 희석 처리구 1.78%, 및 100배 희석 처리구 1.83%로 확인되어 100배 희석 처리구가 가장 높았다 (p < 0.05). B. aryabhattai GW320은 다양한 질소이용 활성을 가진 미생물로서 토양의 질소성분을 식물체가 흡수하기 용이하도록 하여 오이 잎의 질소성분이 대조구 보다 높게 측정되었다고 사료된다. 또한, Hong et al. (2010)의 선행연구 결과에 따르면, 질소의 경우 식물체가 이용할 수 없는 형태로 가장 많이 존재하여 이용률이 현저히 떨어지지만, plant growth promoting rhizobacteria (PGPR)을 이용하여 질소를 생물체가 이용할 수 있는 질소원을 제공한다고 보고하였다.
Table 4.
The chemical properties of before and after application of the microbial agent.
인산의 경우 대조구는 0.48 - 0.50%, GW320 균주 처리구에서는 0.53 - 0.58%로 대조구에 비해 높게 측정되었으며, GW320 균주 500배 희석 처리구 0.53%, 250배 희석 처리구 0.54%, 및 100배 희석 처리구 0.58%로 확인되어 100배 희석 처리구가 가장 높았다 (p < 0.05).
칼슘의 경우 미생물 처리구는 2.14 - 2.21%, 대조구의 경우 1.98 - 2.14%로 미생물 처리구가 높게 측정되었지만 적정 범위 3.73 ± 0.38%로 미생물 처리구는 40 - 42%, 대조구는 42 - 47%로 적정범위 보다 낮게 나타났다 (Lee et al., 2011). 특히, 식물체 무기성분 중 대조구와 미생물 처리구간의 인산과 칼슘 함량 흡수차이가 다른 무기성분보다 감소하였는데 이것은 pH 상승에 의해 칼슘과 인산의 결합에 의해 식물체내로의 흡수가 저해된 결과로 판단된다. 이것은 알칼리 용액에서 칼슘은 인산과 가장 잘 반응하는 이온이며, pH 7.0 이상에서 서로 결합하여 calcium-phosphate를 형성한다는 결과와 유사하다 (Da Silva Cerozi and Fitzsimmons, 2016).
이동성이 높은 칼륨의 경우 대조구에서 0.53 - 0.54%, GW320 균주 처리구에서는 0.72 - 0.76%로 측정되어 미생물 처리에 의해 칼륨이 식물체 내로 더 많이 흡수되었다. Lee et al. (2011)의 선행 연구결과와 비교하였을 때, 칼륨의 적정범위 (3.27 ± 0.53%)에 비해 대조구는 83%, GW320 균주 처리구는 76 - 77% 낮게 나온 것으로 확인되었다. 오이는 정식 후 50일경에는 각 성분의 50 - 60%가 흡수되며, 오이 암꽃의 과실이 비대하기 1개월 정도에 첫 웃거름을 주는 시기라 적정범위 보다 무기성분 함량이 낮게 측정되었다고 사료된다.
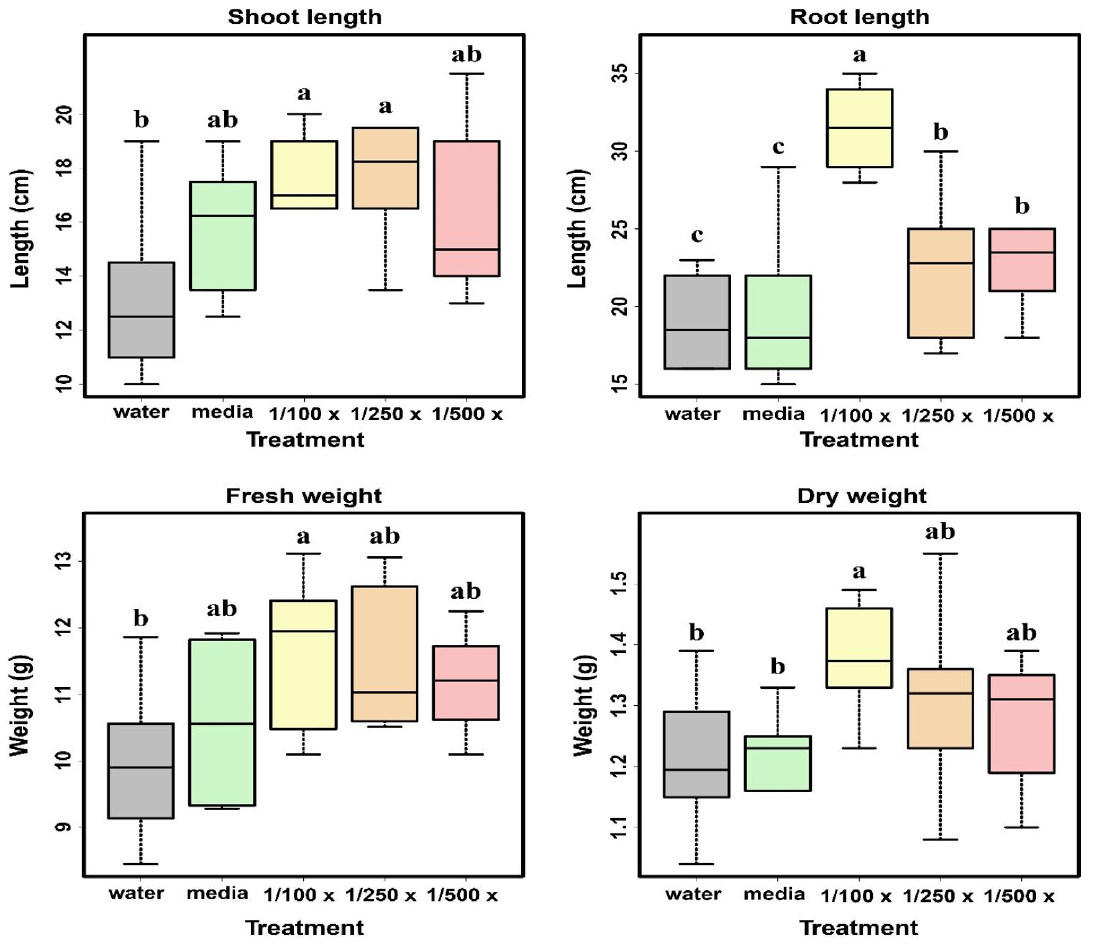
오이 생육 촉진 효과
식물 생장 촉진 활성을 검정하고자 정식 후 4주된 오이를 대상으로 초장, 근장, 엽록소 함량, 엽수, 경경, 생체량 및 건물중 등 식물의 생장 특성을 조사하였다 (Table 5). 오이 초장의 경우 미생물 100배 희석 처리구에서 17.67 cm으로 가장 높았으며 대조구는 13.25 cm으로 GW320 균주 100배 희석 처리구에서 33%, 500배 희석 처리구는 22%의 증진 효과를 보였다 (p < 0.05). 근장의 경우 미생물 100배 희석 처리구에서 31.5 cm으로 가장 높았고 대조구와 비교하였을 때 65%의 증진 효과를 보였다. 이러한 결과는 토양에 Azospirillum brasilense Sp7-S, B. amyloliquefaciens ppb12 균주를 오이에 처리하였을 때, 근장이 각각 75%, 65.63% 증가되었다는 Islam et al. (2016)와 Mangmang et al. (2015)의 결과와 일치하는 것으로 확인된다
Table 5.
Growth parameter of cucumber after 4 weeks according to treatment of Bacillus aryabhattai GW320.
이는 뿌리 박테리아에 의한 뿌리 성장 및 식물 성장 촉진과 연관이 있다 (Persello‐Cartieaux et al., 2003; Pérez-Montaño et al., 2014). 특히, 뿌리 표면적의 증가와 식물 성장 촉진 간에 높은 상관관계가 있으며 (Pacovsky, 1990), 그 이유로는 영양소의 흡수가 뿌리털 증가로 인해 촉진하기 때문인 것으로 사료된다 (Persello‐Cartieaux et al., 2003). 엽수의 경우에도 미생물 처리구에서 생육 촉진 효과를 보였으며, 특히 GW320 균주 100배 희석처리구에서 대조구 보다 14%로 증가함을 보였다 (p < 0.05). 엽폭, 엽장은 100배 희석 처리구, 500배 희석 처리구 순으로 생육이 우수하게 관찰되었다. 생체중과 건물중도 대조구에 비해 미생물 처리구에서 유의성 있게 높았다 (p < 0.05). 이는 옥신을 생산하는 미생물 처리로 기관의 신장 및 발달을 유도함으로써 엽수, 엽폭, 생체중, 건물중 등의 생육을 증진시킨다는 선행연구 결과와 일치하였다 (Ross et al., 2001; Depuydt and Hardtke, 2011). 경경의 경우 미생물 100배 희석 처리구에서 5.26 mm으로 대조구 4.61 mm로 14%의 생육 증진효과를 나타내었다 (p < 0.05).
식물생장 촉진 미생물들은 식물 생장 촉진 호르몬 생성 및 영양소의 가용화 작용으로 생장을 촉진하는 것으로 알려져 있다 (Santoro et al., 2015). 본 연구에 사용된 옥신 생성, 질소고정능, 및 암모니아 생성능이 있는 군위 토착 미생물 B. aryabhattai GW320 처리로 대조구에 비해 오이의 생육이 촉진된 것으로 확인된다. 특히 본 연구에서는 GW320 균주 처리구 중 100배 희석처리를 시행하였을 때 오이생육이 가장 유의미하게 높았다. Mangmang et al. (2015)의 선행연구에 의하면 오이를 대상으로 Azospirillum brasilense Sp7-S 균주를 농도별로 처리하였을 때 대조구에 비해 가장 좋은 생육 촉진 효과를 보인 미생물 처리 농도는 1.0 × 107 CFU ml-1 인 것으로 확인되었다. 본 연구에서 확인된 최적 미생물 농도인 1.0 × 107 CFU ml-1과 유사한 것으로 확인되었다.
또한, 오이와 같은 과채류에서는 영양생장과 생식생장이 동시에 일어나므로 많은 양분과 수분이 요구되는데, 미생물 처리에 의해 토양의 화학적 특성 및 근권 환경이 개선됨에 따라 양분과 수분의 흡수가 용이 해져 대조구에 비해 오이의 성장이 촉진되는 것으로 확인된다 (Lee et al., 1997). 또한, 지속가능한 친환경 농업에 관심증대로 미생물 비료와 생물 농약의 중요성이 대두되고 있으며, 다양한 미생물들이 보고되고 있다. 본 연구에서의 B. aryabhattai GW320 균주는 옥신 및 다양한 질소 이용 활성을 가지며 균주 처리에 의한 오이 생육 촉진과 최적 처리 농도를 확인하였다. 이러한 연구 결과는 효율적인 친환경 농법 구현을 위한 기초자료로써 활용될 수 있으며 현재 사용되는 농업 유용 미생물과 이의 처리에서 발생되는 문제점을 극복하는데 기여할 수 있을 것으로 사료된다.
Conclusion
본 연구는 군위군 오이 재배 근권 토양 내 존재하는 토착미생물 우수 균주를 통해 친환경재배를 할 수 있는 방안을 마련하기 위해 수행되었다. 오이 근권 토양에서 토양 미생물을 분리한 결과 총 1,000 종의 균주의 근권 세균들이 확인되었고, 식물 생장 촉진 활성을 측정한 결과 Bacillus aryabhattai GW320 균주를 최종 선발하였다. 최종 분리된 B. aryabhattai GW320 균주는 auxin 생합성, urease, denitrification, ammonia oxidation, nitrogen fixation 등의 식물 생장 촉진 활성을 보이는 것으로 확인되었다. 다기능성 식물 생장 촉진 효과를 보이는 B. aryabhattai GW320 균주를 활용한 오이 생장 촉진 효과를 시행한 결과 미생물 처리구에서 오이의 초장, 엽폭, 및 경경이 각각 22 - 33%, 7 - 9%, 및 9 - 14% 증대된 것을 확인하였으며 통계적으로 유의미하였다. 또한, GW320 균주 처리에 의해 오이 토양의 이, 화학성이 증대되었으며 GW320 균주 처리구 중 100배 희석액을 처리하였을 때 가장 좋은 오이 생육 및 토양 이, 화학성 결과를 확인하였다. 본 연구에서 군위군 오이 근권 토양에 존재하는 토착미생물의 작물생육 촉진 효과를 입증하였으며, 상기 결과는 미생물 처리의 효율적인 관리방안 확보 및 기초 자료로 사용될 수 있을 것으로 사료된다. 또한 군위군의 유용한 토착미생물 종균 개발로 오이 재배에 농작물을 안정적으로 재배, 생산할 수 있는 안전체계를 구축하여 지속 가능한 농업발전에 기여할 수 있을 것으로 사료된다.