Introduction
Materials and Methods
바이오차 비드 제조
폴리도파민 코팅
흡착실험
특성 분석
Results and Discussion
특성 분석
등온흡착특성
동적흡착특성
Conclusions
Introduction
중금속이란 비중이 4.0이상인 금속원소들을 뜻하며 대표적인 토양 내 중금속에는 수은, 납, 카드뮴, 구리 등이 있다. 이러한 중금속들은 군부대 내 사격장, 산업단지, 농업활동, 비료 및 살충제의 제조 및 사용 등 사람의 여러가지 활동에 의해 발생되어 환경으로 유입된다 (Babarinde et al., 2006; Argun et al., 2007; Ok et al., 2011; Ahmad et al., 2012; Ko and Kim, 2016; Hong et al., 2021; Jeong et al., 2023). 토양 및 지하수 등에 오염된 중금속은 생물학적으로 분해되지 않기 때문에 인간, 동물, 식물에 지속적인 피해를 발생시킨다 (Bolan et al., 2014; Kim, 2024). 이와 같은 중금속의 특징으로 중금속 오염에 대한 관심과 중금속 오염에 대한 해결책들이 지속적으로 연구되고 있다 (Goel et al., 2005; Han et al., 2006; Kumpiene et al., 2008; Ok et al., 2010; Almaroai et al., 2014).
중금속 처리 공정은 물리화학적 공정 (흡착, 이온 교환, 화학적 침전 및 막 여과), 전기화학적 공정 (전기응집 및 전기부유) 그리고 고급 산화공정 (광촉매)과 같이 3가지로 분류할 수 있다. 물리화학적 방법 중 흡착 공정은 저렴한 비용과 현장 적용이 쉽다는 장점이 있어 자주 사용되는 방법이다 (Lakherwal, 2014). 흡착 공정에서 사용되는 중금속 흡착제는 활성탄, 금속산화물, 점토광물, 슬러지 등을 예로 들 수 있다. 활성탄은 큰 비표면적, 다양한 기공분포를 갖는 물질로 수용액상의 오염물질 제거에 사용되고 있다 (Park et al., 2022). 하지만 제조 공정의 복잡함, 활성화 과정 내 화학물질 처리 등의 문제점으로 중금속 처리 공정보다는 주로 악취, 유기오염물질 처리에 활용되고 있다 (Cheng et al., 2021).
바이오차는 바이오매스를 열분해한 것으로 높은 pH, 넓은 표면적, 다공성 구조, 많은 활성 작용기 등의 특징이 있다 (Wu et al., 2012; Kang et al., 2023b). 바이오차는 활성탄의 유기물 제거에 대한 장점과 중금속에 대한 높은 흡착률을 갖는 흡착제로서, 바이오차를 활용한 많은 연구가 진행되고 있다 (Lehmann and Joseph, 2009; Kang et al., 2023a; Lee et al., 2023). 그러나 바이오차는 미세한 입자형태로 밀도가 낮아 현장에 적용할 경우 분진이 발생하고, 흡착 처리 후 오염물질과 흡착제 분리가 어렵기 때문에 환경에서의 적용이 미미한 실정이다 (Chia et al., 2015; Yan et al., 2015). 따라서 바이오차의 현장 활용도를 높이기 위해 분말 형태의 바이오차를 입자 형태로 가공하는 기술이 연구되고 있다.
Alginate는 바이오차와 같은 분말형태의 입자를 구형의 형태로 성형하는 대표적인 가교제로 2가의 양이온 (Ca2+, Mg2+)과 alginate의 carboxylate기가 반응하여 젤을 형성하며 Carboxylate로 인해 많은 결합 부위가 존재하기 때문에 가교성 및 오염물질 흡착능력을 보유하고 있다 (Burdick and Stevens, 2005; Ngomsik et al., 2009). 또한, 홍합의 족사에 존재하는 도파민으로부터 파생되는 폴리도파민 (polydopamine)은 염기성 수용액 (pH 8.5)의 환경에서 산화과정을 통해 표면에 코팅 되는 물질로서 코팅을 통해 표면의 성질을 변화시키는 표면 개질성이 있으며, 독성 유기 물질, 방사능 동위원소, 중금속 등의 오염물질 흡착능이 있어 흡착제로서의 활용 가능성이 보고되고 있다 (Lee et al., 2007; Lee et al., 2012).
본 연구에서는 환경적 적용에서 한계점이 있는 분말 형태의 바이오차를 입자 형태로 제형화하는 방법과 폴리도파민 코팅을 통한 흡착제의 중금속 흡착 효율성을 평가하였다.
Materials and Methods
바이오차 비드 제조
본 연구에 사용된 바이오차는 ㈜케이아그로에서 생산되는 바이오차를 사용하였으며, 비드를 제조하기 위해서 입자크기가 150 µm 이하인 것을 활용하였다.
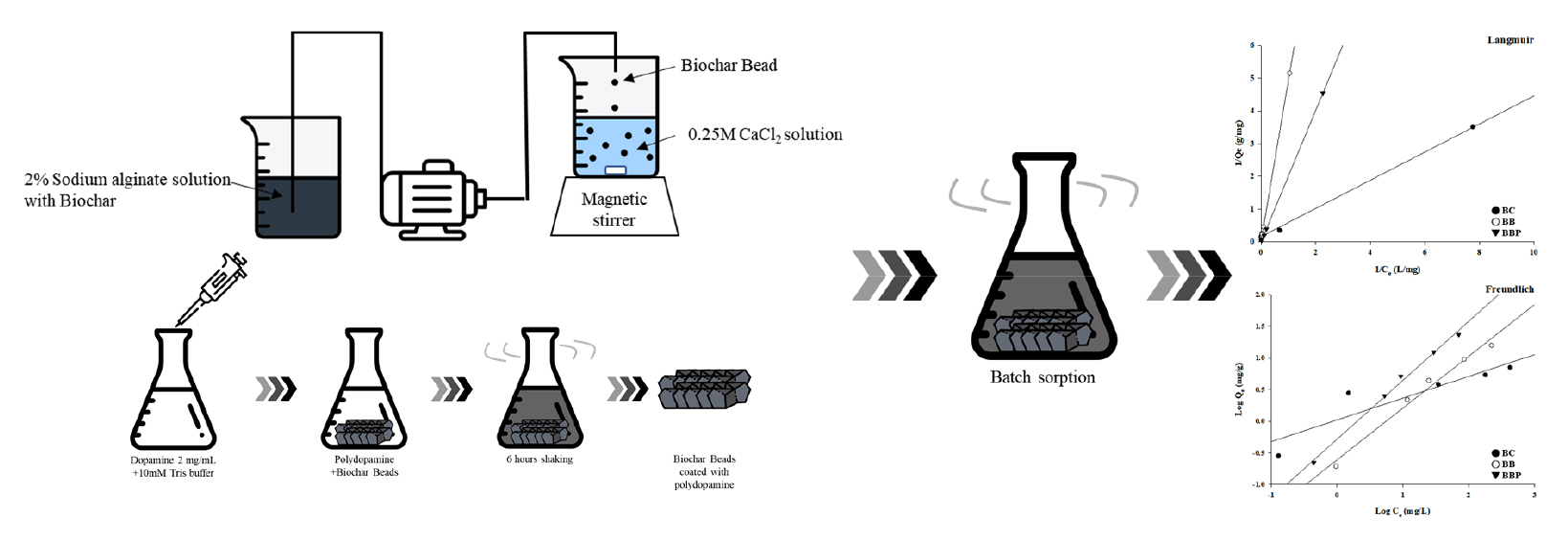
분말 형태의 바이오차를 바이오차 비드로 제형하는 과정은 Fig. 1과 같다. 바이오차 5%를 2% sodium alginate 용액에 혼합한 뒤 0.25 M CaCl2 용액에 떨어뜨려 alginate cross linkage 원리를 통해 균일한 형태로 제조하였다. 바이오차 비드는 0.25 M의 CaCl2 용액속에서 1시간 동안 경화과정을 거친 뒤 증류수로 세척, 건조기에서 30°C로 24시간 건조하였다.
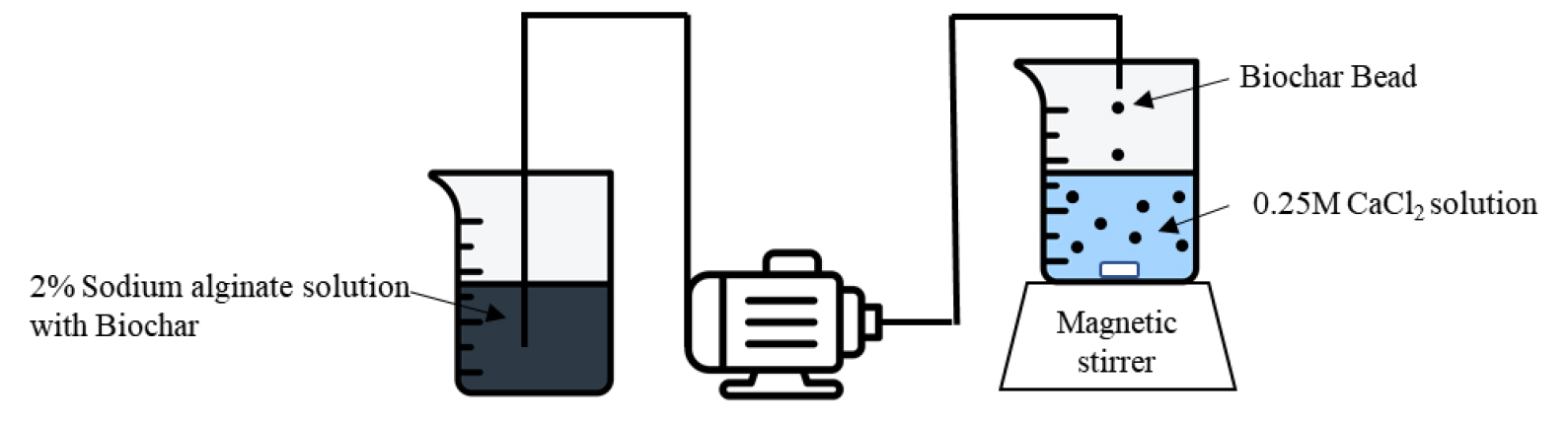
Fig. 1.
Schematic diagram of biochar bead manufacture process.
폴리도파민 코팅
10 mM의 tris buffer에 도파민을 2 mg mL-1 혼합하여 폴리도파민 용액을 제조한 뒤, 바이오차 비드를 넣어 6시간 자연적인 산화반응을 통한 코팅을 진행하였다. 6시간 뒤 코팅한 바이오차 비드를 증류수로 세척하여 건조한 뒤 실험에 사용하였다 (Fig. 2).
Fig. 2.
Schematic diagram of biochar bead coated with polydopamine manufacture process.
흡착실험
흡착제는 바이오차 (biochar, BC), 바이오차 비드 (biochar bead, BB), 폴리도파민 코팅 바이오차 (biochar bead coated with polydopamine, BBP) 3가지를 사용하였고 각 흡착제의 화학적 특성은 Table 1에 나타내었다. 중금속 수용액은 카드뮴 (CdCl2‧2.5H2O), 납 (Pb(NO3)2) 시약으로 500 mg L-1을 제조한 뒤 희석 후 사용하였다. 용액의 초기 설정 pH는 0.1 M HCl과 0.1 M NaOH로 조절하였다. 흡착제 1 g과 중금속 수용액 50 mL를 삼각플라스크에 넣어 진탕기 (JSOS-500, JSR, Tokyo, Japan)를 이용하여 150 rpm으로 진탕 후 여과하여 ICP-OES (iCAP PRO X ICP-OES Duo, Thermo Fisher Scientific, USA)로 농도를 측정하였다.
Table 1.
Chemical properties and heavy metal concentration of biochar (BC), biochar bead (BB), biochar bead coated with polydopamine (BBP).
| |
BC
|
BB
|
BBP
|
|
Parameters
|
Unit
|
Value
|
|
pH
|
(1:5)
0.01 M CaCl2 |
8.80 ± 0.03
|
5.82 ± 0.01
|
4.72 ± 0.01
|
|
Electrical conductivity
|
dS/m
|
5.21 ± 0.69
|
104.67 ± 0.23
|
33.30 ± 0.10
|
|
Total Carbon
|
%
|
71.40 ± 0.79
|
45.10 ± 0.16
|
49.98 ± 0.38
|
|
Total Hydrogen
|
%
|
1.64 ± 0.03
|
2.75 ± 0.02
|
2.45 ± 0.03
|
|
Total Nitrogen
|
%
|
0.36 ± 0.01
|
0.21 ± 0.00
|
0.42 ± 0.01
|
|
Total Oxygen
|
%
|
4.57 ± 0.41
|
6.36 ± 0.42
|
7.96 ± 0.42
|
|
C/N
|
Molar ratio
|
231.39
|
250.56
|
138.83
|
|
O/C
|
Molar ratio
|
0.05
|
0.11
|
0.12
|
|
H/C
|
Molar ratio
|
0.28
|
0.73
|
0.59
|
|
Cd
|
mg/kg
|
0.20 ± 0.00
|
0.12 ± 0.00
|
0.12 ± 0.00
|
|
Pb
|
mg/kg
|
1.75 ± 0.02
|
1.89 ± 0.00
|
2.28 ± 0.02
|
등온흡착실험은 각각의 중금속 수용액의 농도를 5, 50, 100, 250, 500 mg L-1로 제조하여 초기 pH를 5.0으로 조절한 뒤, 24시간 흡착시켜 농도를 측정하였다. 측정된 결과값은 Langmuir, Freundlich 등온흡착 모델식에 적용하였다. 각각의 모델식은 Eqs. 1 and 2와 같다.
q (mg g-1) : 흡착제 단위 g당 흡착된 오염물질의 양
Ce (mg L-1) : 평형상태에서 용액 중 남아있는 오염물질농도
qm (mg g-1) : 최대흡착용량
b : Langmuir 흡착 평형 상수
K : Freundlich 흡착 평형 상수
1/n : Freundlich 흡착강도 상수
동적흡착실험에서 사용한 중금속 수용액 농도는 Cd 4 mg L-1, Pb 200 mg L-1을 실험에 사용하였다. 중금속 수용액의 pH, 흡착제 투입량, 진탕 속도는 등온흡착실험과 같은 조건으로 실행하였다. 흡착 후 0.5, 1, 3, 6, 12, 24 시간 뒤 중금속 농도를 측정하였다. 동적흡착 결과는 유사일차반응식과 유사이차반응식에 적용하였다. 모델식은 Eqs. 3 and 4와 같다.
qe, qt (mg g-1): 평형상태와 𝑡 시간에서 흡착된 중금속의 양
K1 (1 h-1): pseudo-first order 반응속도상수
K2 (1 h-1): pseudo-second order 반응속도상수
특성 분석
바이오차, 바이오차 비드, 폴리도파민 코팅 바이오차 비드에 대한 pH 분석은 시료와 0.01 M CaCl2 용액을 1:5 비율로 혼합하고 1시간 동안 진탕한 뒤 pH meter (Orion StarTM A111, Thermo Fisher Scientific, Waltham, MA, USA)로 측정하였다. Electrical conductivity (EC)는 시료와 증류수를 1:10 비율로 혼합하고 1시간 동안 진탕한 뒤 여과하여 EC meter (SevenCompactTM Conductivity Meter S230, Mettler Toledo, Columbus, OH, USA)를 사용해 측정하였다. 흡착제의 C, H, O 및 N 함량은 원소분석기 (EA 1112, Thermo Fisher Scientific, USA)를 사용하여 분석하였다. 흡착제의 표면 전하를 측정하기 위해 0.01 M NaCl 용액을 제조하여 0.1 M NaOH와 0.1 M HCl을 사용하여 초기 용액의 pH를 3에서 12까지 제작하였다. 흡착제 0.5 g과 각 pH별 NaCl 용액을 20 mL 혼합하여 24시간 진탕한 뒤 pH meter로 pH변화를 계산하여 산출하였다. 표면 작용기 분석을 위해 FT-IR (VERTEX 80v, Bruker, GERMANY)을 사용하였다. SEM-EDS (SU7000, Hitachi, Japan)을 사용하여 표면 관찰 및 표면 원소 조성을 분석하였다.
Results and Discussion
특성 분석
pH는 흡착 과정에 관여되는 요인으로 용액의 pH에 따라 흡착제의 흡착용량에 영향을 미칠 수 있다 (Li et al., 2017). Fig. 3에서 ΔpH의 값이 0일 경우, 이를 points of zero charge (PZC)라고 하며 BC는 10.65, BBP는 5.46, BB는 5.03 값이 산출되었다. 흡착 과정이 주로 물리적인 흡착을 통해 일어나는 경우 PZC 값에 대해 흡착질의 pH가 높을 경우 양이온의 흡착이 잘 이루어지고, 흡착질의 pH가 낮을 경우 음이온의 흡착이 잘 이루어진다 (Faria et al., 2004; Nasiruddin Khan and Sarwar, 2007; Oh and Seo, 2016). 따라서 PZC 값만을 통해 중금속의 흡착 메커니즘을 추정해보면 BC의 경우 표면 음전하와 양이온 형태의 중금속 간의 이온결합이 주요 흡착 메커니즘으로 작용하며 BB와 BBP의 경우 제조과정에서 형성된 작용기 (carbonyl functional group)와 양이온 형태의 중금속의 결합에 의한 흡착이 이루어질 것으로 예상한다. 이를 확인하기 위해 BC, BB, BBP의 작용기 분석을 실시하였으며 결과는 Fig. 4와 같다. BC와 BB에서 차이를 보이는 작용기는 1,589 cm-1 부근에서의 카르보닐기(C = O)이며 이는 Sodium alginate로부터 비롯한 작용기라는 선행 연구 결과가 있다 (Zhao et al., 2021; He et al., 2022). 폴리도파민 코팅을 통한 작용기의 변화는 3669 cm-1에서의 N-H 및 O-H와 2980, 1069의 C-H를 확인할 수 있다 (Bartlett et al., 1992; Centeno and Shamir, 2008).
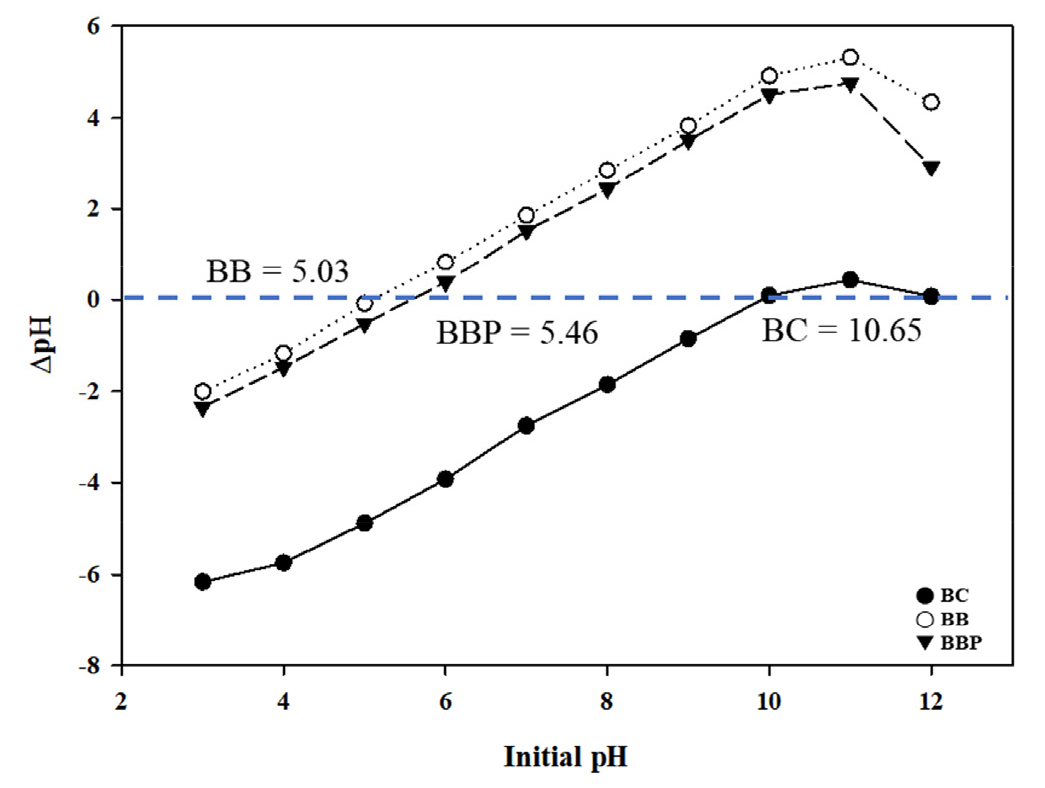
Fig. 3.
PZC results for biochar (BC), biochar bead (BB), biochar bead coated with polydopamine (BBP).
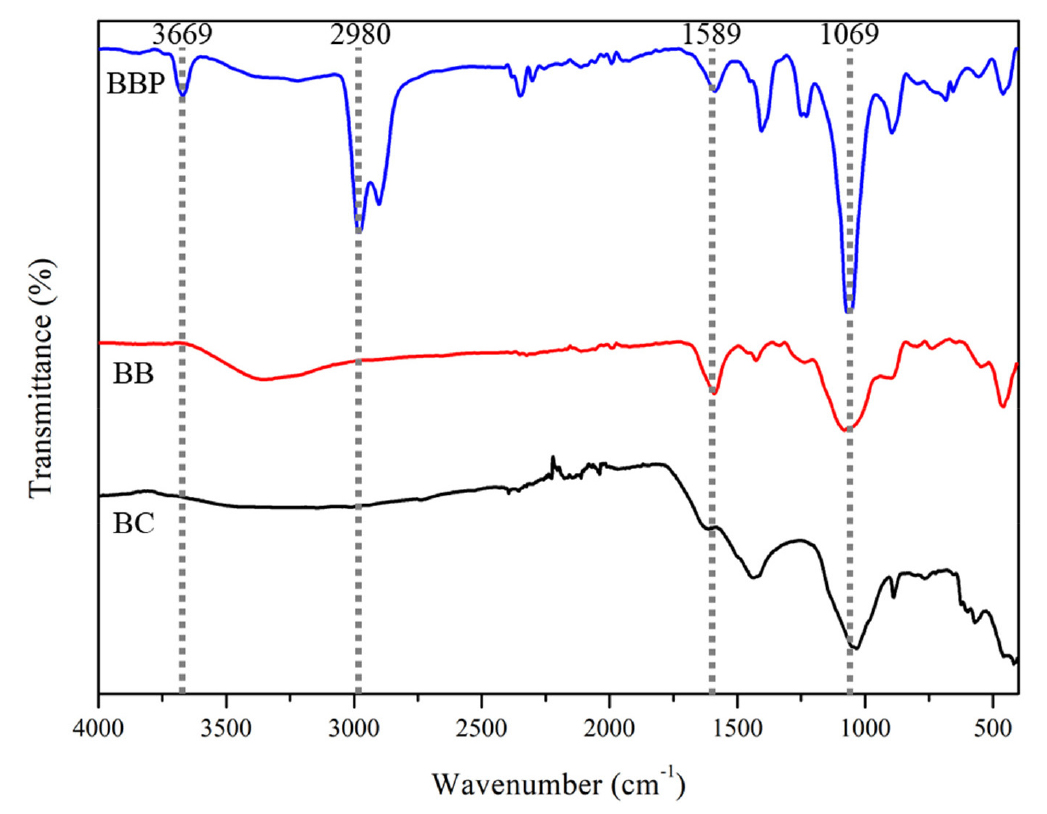
Fig. 4.
FT-IR spectrum of biochar (BC), biochar bead (BB), biochar bead coated with polydopamine (BBP).
Fig. 5는 500 mg L-1 농도의 Cd과 Pb에 대한 흡착제의 흡착률이다. 납의 경우 98 - 99%의 높은 흡착률을 나타내었으며, 카드뮴의 경우 BBP가 86.96%로 가장 높은 값을 나타내었으며, 그 다음으로 BB가 58.92%, BC가 25.05%를 나타내었다. 흡착제들에 존재하는 다양한 산소 함유 작용기 (-COOH, -OH, -C = O, C = N)는 중금속과의 결합 자리를 제공하며 중금속과 함께 안정한 착물을 형성한다 (Park et al., 2011; Tan et al., 2017). 착물화는 양하전을 띄는 금속과 -COO, -OH 리간드를 통해 발생할 수 있으며, 예로는 납 이온에서 카르복실기, 하이드록실기 그룹과의 착물화 그리고 납 이온과 산화 광물의 하이드록실 그룹과의 내부권 착물화가 있으며, Eqs. 5 and 6과 같다 (Cao et al., 2009; Lu et al., 2012).
중금속과 작용기와의 반응은 중금속 안정화의 주요 기작이며, 중금속 흡착에 대해 38.2 - 42.3%를 차지하기도 한다 (Lu et al., 2012).
Fig. 6는 BC, BB, 그리고 BBP에 대한 SEM 이미지이다. 표면 이미지를 비교하였을 때, Alginate를 통해 제형과정을 거친 BB와 BBP의 표면이 BC 보다 더 균질해진 것을 확인 할 수 있었다. 이러한 흡착제 표면의 구조적 변화는 중금속 흡착에 중요한 영향을 미친다 (Kang et al., 2006).
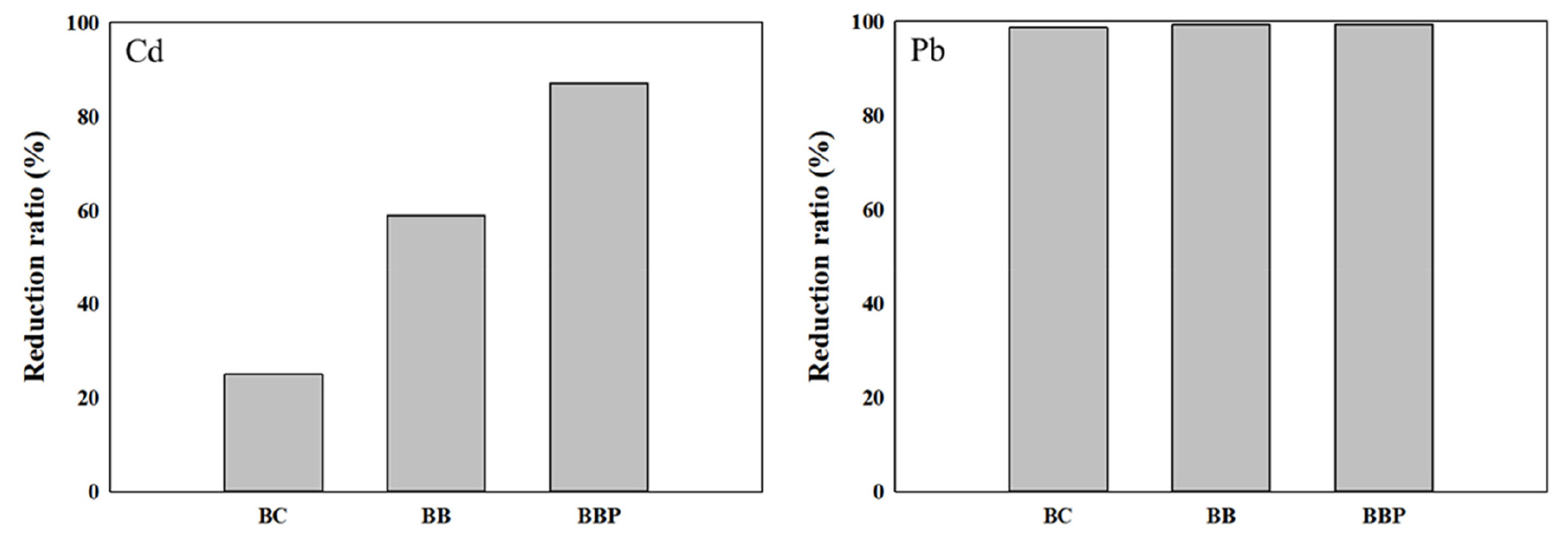
Fig. 5.
Results of reduction ratio with biochar (BC), biochar bead (BB), biochar bead coated with polydopamine (BBP) for heavy metal solution (Cd, Pb) 500 mg L-1.

Fig. 6.
SEM image of biochar (a), biochar bead (b), biochar bead coated with polydopamine (c).
등온흡착특성
두 종류의 중금속, Cd과 Pb에 대해 5 - 500 mg L-1 농도별로 흡착을 진행한 뒤, 결과를 Langmuir, Freundlich 식에 적용하였다. 등온흡착식에 대한 그래프와 상수는 Fig. 7 및 Table 2와 같다. Langmuir을 통해 최대흡착용량인 qm값을 산출할 수 있다. 카드뮴에서는 BBP (192.308) > BB (26.525) > BC (6.196) 값을 나타내었으며 납의 경우 BBP (63.694) > BC (58.480) > BB (40.984) 값을 나타내었다. 카드뮴과 납에 대한 바이오차와 바이오차 비드 흡착 관련 논문에서는 최대흡착용량 값이 카드뮴의 경우 BC (40.0), BB (227.1), 납의 경우 BC (81.3), BB (151.5)를 나타냈다 (Wang et al., 2018; Kim et al., 2024). 본 연구에서는 비교적 낮은 값이 측정되었으며, 관련 연구들과 마찬가지로 바이오차 비드 제작을 통해 중금속의 최대흡착용량이 증가하는 것을 확인하였다.
Freundlich 식에서 흡착강도를 나타내는 1/n 값은 0.1 - 0.5 사이의 값을 나타내면 흡착이 강하게 이루어지며, 2 이상의 값을 나타내면 흡착이 잘 되지 않는 것을 의미한다 (Na et al., 2011). 카드뮴에 대한 1/n값은 0.345 - 0.932 범위의 값을 나타내었으며, 납의 경우 1.091 - 1.111 범위 값을 나타내었다. 모두 2의 값을 넘지 않아 흡착이 이루어진다고 할 수 있으나 0.5보다 높은 값이 있어 강한 흡착은 이루어지지 않은 것으로 판단되었다.
흡착능에 대한 지표인 상수 k는 카드뮴에서 BC (1.050) > BBP (0.521) > BB (0.246) 순서로 값이 나타났으며 납의 경우에는 BBP (2.921) > BB (2.892) > BC (2.360) 값이 나타났다.
등온 흡착실험 결과를 Langmuir, Freundlich 각각의 적용식에 적용한 뒤 결정계수 (R2) 값 비교를 통해 Langmuir식에서의 적용이 더 적합하다는 것을 확인하였다. Langmuir 모델은 흡착제의 표면에 에너지 분포가 균일하며 흡착이 표면에 단분자층으로 이루어지는 흡착제에 적합하다 (Langmuir, 1918). 일반적인 바이오차의 중금속 흡착과 같이 본 실험 또한 이온교환을 통한 단분자층 흡착이 이루어짐을 확인하였다 (Hall et al., 1966).
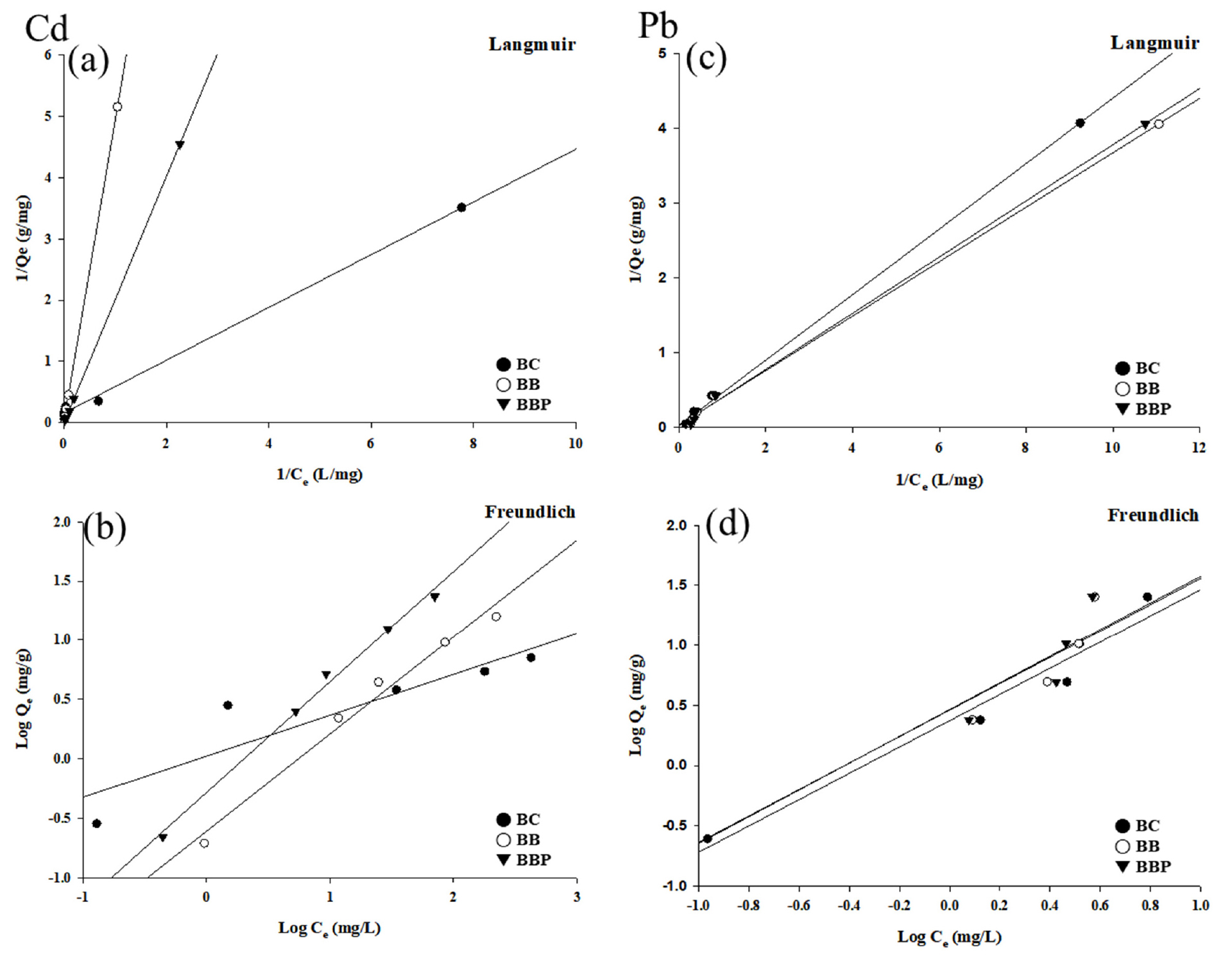
Fig. 7.
Langmuir (a, c) and Freundlich (b, d) isothermal adsorption models of biochar (BC), biochar bead (BB), biochar bead coated with polydopamine (BBP).
Table 2.
Adsorption parameters for the Langmuir and Freundlich isotherm models.
|
Elements
|
Absorbent1 |
Langmuir adsorption isotherm
|
Freundlich adsorption isotherm
|
|
qm |
b
|
R2 |
K
|
1/n
|
R2 |
|
Cd
|
BC
|
6.196
|
0.375
|
0.9979
|
1.050
|
0.345
|
0.8279
|
|
BB
|
26.525
|
0.008
|
0.9999
|
0.246
|
0.819
|
0.9827
|
|
BBP
|
192.308
|
0.003
|
0.9999
|
0.521
|
0.932
|
0.9937
|
|
Pb
|
BC
|
58.480
|
0.039
|
0.999
|
2.360
|
1.091
|
0.9605
|
|
BB
|
40.984
|
0.067
|
0.9985
|
2.892
|
1.098
|
0.9262
|
|
BBP
|
63.694
|
0.042
|
0.9985
|
2.921
|
1.111
|
0.9189
|
동적흡착특성
3가지의 흡착제에 대한 동적흡착특성을 알아보기 위해 카드뮴과 납에 대한 흡착시간별로의 결과를 유사일차반응식과 유사이차반응식에 적용하였다. 그래프 및 상수는 Fig. 8 및 Table 3와 같다. 카드뮴의 경우 흡착 6시간 후 모두 90%이상의 흡착률을 나타내었다. 결정계수 (R2) 값을 비교해보았을 때, 유사일차반응식(0.1809 - 0.6034) 보다 유사이차반응식 (0.9998 - 0.9999)이 더 적합한 것으로 확인하였다. 유사이차반응식에서의 K2값은 BBP (4.669) > BB (4.653) > BC (4.301) 순서로 나타났다. 납에 대한 3가지 흡착제의 흡착률은 6시간 후 모두 95%이상의 흡착률을 나타내었다. 납 또한 카드뮴과 마찬가지로 결정계수 (R2) 값을 비교한 결과 유사일차반응식 (0.3735 - 0.8674) 보다 유사이차반응식 (0.9999)이 더 적합한 것으로 나타났다. 납의 K2 값은 BBP (0.090) > BB (0.088) > BC (0.087)로 나타났다. 두 가지의 중금속에 대한 동적흡착특성이 결정계수의 비교를 통해서 유사이차반응식에 적합하다는 것을 확인하였다. 이는 흡착과정이 물리적 흡착보다 화학적 흡착이 더 우세하다는 것을 의미한다 (Ho and McKay, 1999; Pellera et al., 2012).
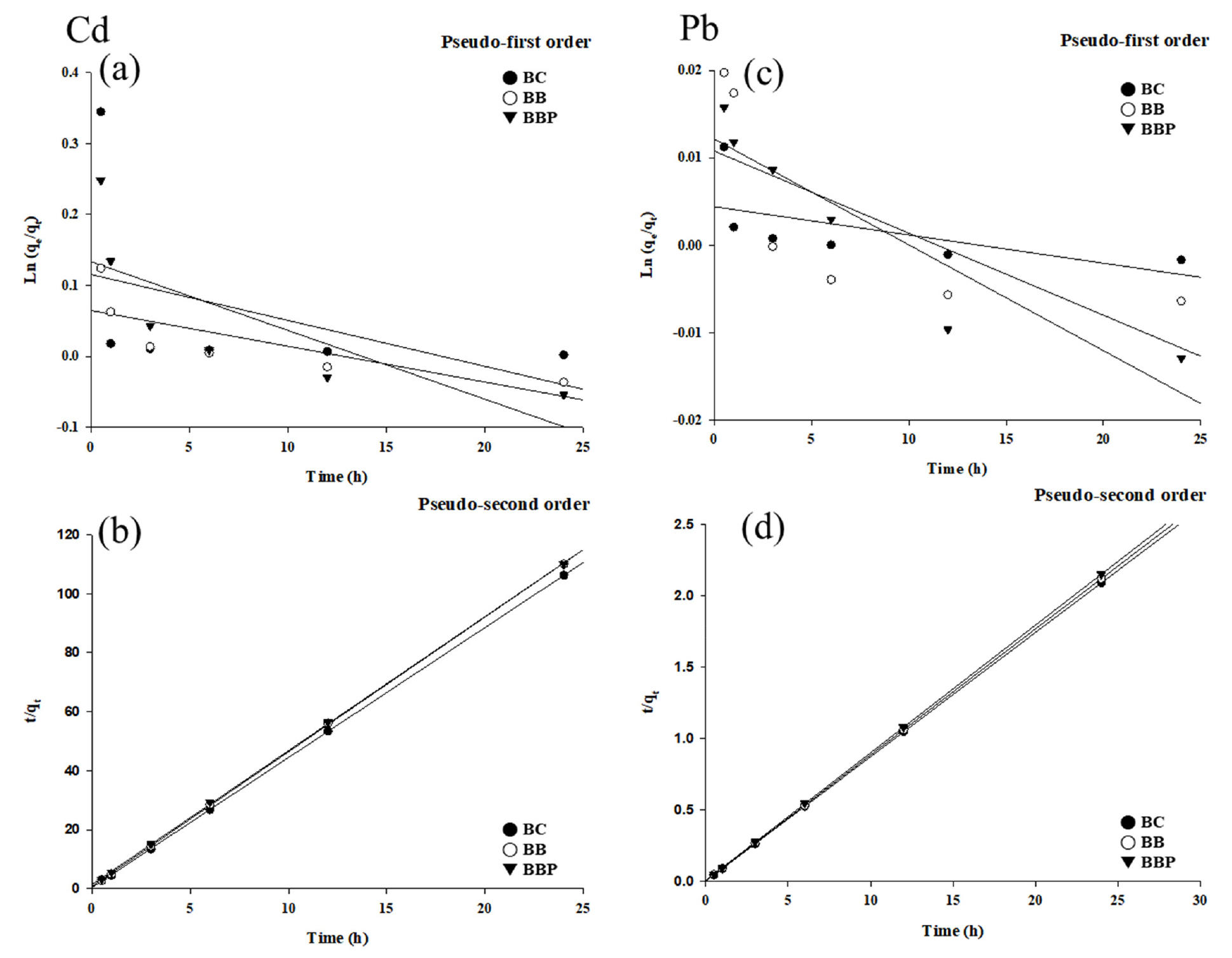
Fig. 8.
Pseudo-first order (a, c) and Pseudo-second kinetic models (b, d) of biochar (BC), biochar bead (BB), biochar bead coated with polydopamine (BBP).
Table 3.
Adsorption parameters for the Pseudo-first order and Pseudo-second kinetic models.
|
Elements
|
Absorbent1 |
Pseudo-first order
|
Pseudo-second order
|
|
K1 |
R2 |
K2 |
R2 |
|
Cd
|
BC
|
2.662
|
0.1809
|
4.301
|
0.9999
|
|
BB
|
4.109
|
0.603
|
4.653
|
0.9999
|
|
BBP
|
2.761
|
0.588
|
4.669
|
0.9999
|
|
Pb
|
BC
|
8.979
|
0.3735
|
0.087
|
0.9999
|
|
BB
|
7.802
|
0.5058
|
0.088
|
0.9999
|
|
BBP
|
8.270
|
0.8674
|
0.090
|
0.9999
|
Conclusions
최근 중금속 흡착 처리 공정에 흡착제로 연구되고 있는 BC는 낮은 밀도, 높은 유실 가능성, 처리 후 오염물질과 분리의 어려움 등의 문제로 환경에서의 적용이 미미한 실정이다. 이러한 문제점을 해결하기 위해 BC를 BB로 제조하였고, 비드의 흡착력을 증가시키기 위해 BBP를 제작하였다. 카드뮴과 납에 대한 흡착제들의 흡착 특성 평가 결과 Langmuir 등온흡착 모델식에서 산출한 최대 흡착량은 카드뮴에서 BBP (192.308 mg g-1) > BB (26.525 mg g-1) > BC (6.196 mg g-1) 순서로 높은 값을 나타내었으며, 납의 경우 BBP (63.694 mg g-1) > BC (58.480 mg g-1) > BB (40.984)의 순서로 두 가지의 중금속에서 BBP가 최대값을 나타냈다. 위 실험결과들을 종합해보았을 때 BBP는 BC의 문제점을 해결하고 중금속에 대한 흡착률을 향상시키는 것으로 확인하였다. 비드 제작 및 코팅 과정에서의 경제성을 고려한 연구가 더 진행된다면 BBP는 중금속 흡착에 효율적인 흡착제라고 판단된다.
Funding
This study was carried out with the support of the “Cooperative Research Program for Agriculture Science and Technology Development (Project No. RS-2023-00232247)” of the Rural Development Administration of the Republic of Korea.
Conflict of Interest
The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper.
Author Contribution
Lee DJ: Conceptualization, Formal analysis, Data curation, Writing-original draft, Visualization, Lee KM, Hong YK, Kim JW: Validation, Resources, Conceptualization, Kim SC: Conceptualization, Supervision, Writing-review & editing.
Data Availability
Data will be provided on reasonable request.
Acknowledgements
The authors thanks RDA for providing experimental materials.
References
Ahmad M, Lee SS, Yang JE, Ro HM, Lee YH, Ok YS. 2012. Effects of soil dilution and amendments (mussel shell, cow bone, and biochar) on Pb availability and phytotoxicity in military shooting range soil. Ecotoxicol. Environ. Saf. 79:225-231. https://doi.org/10.1016/j.ecoenv.2012.01.003
10.1016/j.ecoenv.2012.01.00322266035Almaroai YA, Vithanage M, Rajapaksha AU, Lee SS, Dou X, Lee YH, Sung JK, OK YS. 2014. Natural and synthesised iron-rich amendments for As and Pb immobilisation in agricultural soil. Chem. Ecol. 30:267-279.
10.1080/02757540.2013.861826Argun ME, Dursun S, Ozdemir C, Karatas M. 2007. Heavy metal adsorption by modified oak sawdust: thermodynamics and kinetics. J. Hazard. Mater. 141:77-85. https://doi.org/10.1016/j.jhazmat.2006.06.095
10.1016/j.jhazmat.2006.06.09516879919Babarinde NA, Babalola JO, Sanni RA. 2006. Biosorption of lead ions from aqueous solution by maize leaf. Int. J. Phys. Sci. 1:23-26.
Bartlett PN, Dawson DH, Farrington J. 1992. Electrochemically polymerised films of 5-carboxyinodele. Preparation and properties. J. Chem. Soc. Faraday Trans. 88:2685-2695.
10.1039/ft9928802685Bolan N, Kunhikrishnan A, Thangarajan R, Kumpiene J, Park J, Makino T, Kirkham MB, Scheckel K. 2014. Remediation of heavy metal(loid)s contaminated soils--to mobilize or to immobilize? J. Hazard. Mater. 266:141-166. https://doi.org/10.1016/j.jhazmat.2013.12.018
10.1016/j.jhazmat.2013.12.01824394669Burdick JA, Stevens MM. 2005. Biomedical hydrogels, Biomaterials, artificial organs and tissue engineering. Elsevier, Amsterdam, Netherlands. pp. 107-115.
10.1533/9781845690861.2.10715975767Cao X, Ma L, Gao B, Harris W. 2009. Dairy-manure derived biochar effectively sorbs lead and atrazine. Environ. Sci. Technol. 43:3285-3291.
10.1021/es803092k19534148Centeno SA, Shamir J. 2008. Surface enhanced Raman scattering (SERS) and FTIR characterization of the sepia melanin pigment used in works of art. J. Mol. Struct. 873:149-159.
10.1016/j.molstruc.2007.03.026Cheng N, Wang B, Wu P, Lee X, Xing Y, Chen M, Gao B. 2021. Adsorption of emerging contaminants from water and wastewater by modified biochar: A review. Environ. Pollut. 273:116448. https://doi.org/10.1016/j.envpol.2021.116448.
10.1016/j.envpol.2021.11644833486256Chia CH, Downie A, Munroe P. 2015. Characteristics of biochar: Physical and structural properties, Biochar for environmental management. Routledge, London, United Kingdom. pp. 89-109.
Faria PCC, Orfao JJM, Pereira MFR. 2004. Adsorption of anionic and cationic dyes on activated carbons with different surface chemistries. Water Res. 38:2043-2052.
10.1016/j.watres.2004.01.03415087185Goel J, Kadirvelu K, Rajagopal C, Garg VK. 2005. Removal of lead (II) by adsorption using treated granular activated carbon: batch and column studies. J. Hazard. Mater. 125:211-220. https://doi.org/10.1016/j.jhazmat.2005.05.032
10.1016/j.jhazmat.2005.05.03216019141Hall KR, Eagleton LC, Acrivos A, Vermeulen T. 1966. Pore-and solid-diffusion kinetics in fixed-bed adsorption under constant-pattern conditions. Ind. Eng. Chem. Res. 5:212-223.
10.1021/i160018a011Han R, Lu Z, Zou W, Daotong W, Shi J, Jiujun Y. 2006. Removal of copper (II) and lead (II) from aqueous solution by manganese oxide coated sand II. Equilibrium study and competitive adsorption. J. Hazard. Mater. 137:480-488. https://doi.org/10.1016/j.jhazmat.2006.02.018
10.1016/j.jhazmat.2006.02.01816631305He Y, Chen J, Lv J, Huang Y, Zhou S, Li W, Hu G. 2022. Separable amino-functionalized biochar/alginate beads for efficient removal of Cr (VI) from original electroplating wastewater at room temperature. J. Clean. Prod. 373:133790.
10.1016/j.jclepro.2022.133790Ho YS, McKay G. 1999. Pseudo-second order model for sorption processes. Process Biochem. 34:451-465.
10.1016/S0032-9592(98)00112-5Hong YK, Kim JW, Kim SC. 2021. Comparing heavy metal pollution in agricultural field located at the industrial complex with calculation of pollution index. Korean J. Soil Sci. Fert. 54:10-19.
10.7745/KJSSF.2021.54.1.010Jeong MS, Lee M, Lwin CS, Kim, KR. 2023. Investigating Heavy Metal Contamination Extent of Soil and Plant from Urban Gardens in Jinju. Korean J. Soil Sci. Fert. 56:127-138.
10.7745/KJSSF.2023.56.2.127Kang KC, Kwon SH, Kim SS, Choi JW, Chun KS. 2006. Adsorption of heavy metal ions onto a surface treated with granular activated carbon and activated carbon fibers. Anal. Sci. Technol. 19:285-289.
Kang YG, Lee JH, Lee JY, Kim JH, Oh TK. 2023a. Effects of biochar-based fertilizer on ammonia volatilization under controlled conditions. Korean J. Agric. Sci. 50:437-446.
10.7744/kjoas.500313Kang YG, Lee JH, Oh TK. 2023b. Effects of application rate and pH of carbonized rice husk on the reduction of NH3 volatilization and soil quality. Korean J. Agric. Sci. 50:231-239.
10.7744/kjoas.20230018Kim HS, Lee YK, Park BJ, Lee JE, Jeong SS, Kim KR, Kim SC, Kirkham MB, Yang JE, Kim KH, et al. 2024. Alginate-encapsulated biochar as an effective soil ameliorant for reducing Pb phytoavailability to lettuce (Lactuca sativa L.). Environ. Sci. Pollut. Res. 31:22802-22813.
10.1007/s11356-024-32594-638411914Kim KR. 2024. Transitioning agricultural soil heavy metal management policies to phytoavailability concept. Korean J. Soil Sci. Fert. 57:124-129.
10.7745/KJSSF.2024.57.2.124Ko HJ, Kim KY. 2016. Heavy metals contents and chemical characteristics in compost from animal manures. J Korean Soc Occup Environ Hyg. 26:170-177.
10.15269/JKSOEH.2016.26.2.170Kumpiene J, Lagerkvist A, Maurice C. 2008. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments--a review. Waste Manag. 28:215-225. https://doi.org/10.1016/j.wasman.2006.12.012
10.1016/j.wasman.2006.12.01217320367Lakherwal D. 2014. Adsorption of heavy metals: a review. Environ. Res. J. 4:41-48.
Langmuir I. 1918. The adsorption of gases on plane surfaces of glass, mica and platinum. J. Am. Chem. Soc. 40:1361-1403.
10.1021/ja02242a004Lee H, Dellatore SM, Miller WM, Messersmith PB. 2007. Mussel-inspired surface chemistry for multifunctional coatings. Sci. 318:426-430.
10.1126/science.114724117947576PMC2601629Lee JY, Kang YG, Kim JH, Oh TK, Yun YU. 2023. Effects of nutrient-coated biochar amendments on the growth and elemental composition of leafy vegetables. Korean J. Agric. Sci. 50:967-976.
10.7744/kjoas.500430Lee M, Rho J, Lee DE, Hong S, Choi SJ, Messersmith PB, Lee H. 2012. Water detoxification by a substrate-bound catecholamine adsorbent. ChemPlusChem. 77:987.
10.1002/cplu.20120020923745174PMC3670806Lehmann JS, Joseph S. 2009. Biochar for environmental management Earthscan.
Li, H., X. Dong, E.B. da Silva, L.M. de Oliveira, Y. Chen, L.Q. Ma. 2017. Mechanisms of metal sorption by biochars: Biochar characteristics and modifications. Chemosphere. 178:466-478.
10.1016/j.chemosphere.2017.03.07228342995Lu H, Zhang W, Yang Y, Huang X, Wang S, Qiu R. 2012. Relative distribution of Pb2+ sorption mechanisms by sludge-derived biochar. Water Res. 46:854-862. https://doi.org/10.1016/j.watres.2011.11.058
10.1016/j.watres.2011.11.05822189294Na CK, Han MY, Park HJ. 2011. Applicability of theoretical adsorption models for studies on adsorption properties of adsorbents (1). J. Korean Soc. Environ. Eng. 33:606-616.
10.4491/KSEE.2011.33.8.606Nasiruddin Khan M, Sarwar A. 2007. Determination of points of zero charge of natural and treated adsorbents. Surf. Rev. Lett. 14:461-469.
10.1142/S0218625X07009517Ngomsik AF, Bee A, Siaugue JM, Talbot D, Cabuil V, Cote G. 2009. Co (II) removal by magnetic alginate beads containing Cyanex 272®. J. Hazard. Mater. 166:1043-1049.
10.1016/j.jhazmat.2008.11.10919157703Oh SY, Seo YD. 2016. Sorption of halogenated phenols and pharmaceuticals to biochar: affecting factors and mechanisms. Environ. Sci. Pollut. Res. 23:951-961.
10.1007/s11356-015-4201-825687609Ok YS, Oh Se, Ahmad M, Hyun S, Kim KR, Moon DH, Lee SS, Lim KJ, Jeon WT, Yang JE. 2010. Effects of natural and calcined oyster shells on Cd and Pb immobilization in contaminated soils. Environ. Earth Sci. 61:1301-1308.
10.1007/s12665-010-0674-4Ok YS, Usman AR, Lee SS, Abd El-Azeem SA, Choi B, Hashimoto Y, Yang JE. 2011. Effects of rapeseed residue on lead and cadmium availability and uptake by rice plants in heavy metal contaminated paddy soil. Chemosphere. 85:677-682. https://doi.org/10.1016/j.chemosphere.2011.06.073
10.1016/j.chemosphere.2011.06.07321764102Park JH, Choppala GK, Bolan NS, Chung JW, Chuasavathi T. 2011. Biochar reduces the bioavailability and phytotoxicity of heavy metals. Plant Soil. 348:439-451.
10.1007/s11104-011-0948-yPark Y, Jung S, Jung E, Shin YJ, Lee EJ, Lee JW. 2022. Adsorption of water pollution by biochar produced from biomass. Trends Agric. Life Sci. 60:39-49.
10.29335/tals.2022.60.39Pellera FM, Giannis A, Kalderis D, Anastasiadou K, Stegmann R, Wang JY, Gidarakos, E. 2012. Adsorption of Cu (II) ions from aqueous solutions on biochars prepared from agricultural by-products. J. Environ. Manag. 96:35-42.
10.1016/j.jenvman.2011.10.01022208396Tan Z, Wang Y, Zhang L, Huang Q. 2017. Study of the mechanism of remediation of Cd-contaminated soil by novel biochars. Environ. Sci. Pollut. Res. 24:24844-24855.
10.1007/s11356-017-0109-928914413Wang B, Gao B, Wan Y. 2018. Entrapment of ball-milled biochar in Ca-alginate beads for the removal of aqueous Cd (II). J. Ind. Eng. Chem. 61:161-168.
10.1016/j.jiec.2017.12.01330828252PMC6391885Wu N, Wei H, Zhang L. 2012. Efficient removal of heavy metal ions with biopolymer template synthesized mesoporous titania beads of hundreds of micrometers size. Environ. Sci. Technol. 46:419-425. https://doi.org/10.1021/es202043u
10.1021/es202043u22129207Yan L, Kong L, Qu Z, Li L, Shen G. 2015. Magnetic biochar decorated with ZnS nanocrytals for Pb (II) removal. ACS Sustain. Chem. Eng. 3:125-132.
10.1021/sc500619rZhao X, Wang X, Lou T. 2021. Preparation of fibrous chitosan/sodium alginate composite foams for the adsorption of cationic and anionic dyes. J. Hazard. Mater. 403:124054.
10.1016/j.jhazmat.2020.12405433265059