Introduction
온도 상승에 따른 토양 유기물 분해 속도 변화는 온난 기후 조건에서 토양 유기물 동역학 연구는 물론 지구 탄소 순환 모형에서 중요하게 고려되는 요소이다 (Lindsey et al., 2000; Raich et al., 1992). 토양 유기물 분해 속도는 토양 호흡을 통해 발생되는 이산화탄소 (CO2) 플럭스를 측정하여 계산하는데, CO2 플럭스는 가스크로마토그래피 (Gas chromatography, GC)나 적외선 분석기 (Infrared analyzer, IR)를 이용하여 가스상의 CO2를 직접 측정하거나 (Müller et al., 2010), 발생된 CO2를 알칼리 용액 (예를 들면, NaOH)과 반응시켜 중탄산 (CO32-)형태로 안정화 시킨 후 남은 알칼리를 산으로 역적정하여 분석할 수 있다 (Haney et al., 2008; Rottmann et al., 2009). 분석 방법별로 CO2 플럭스를 비교하면, NaOH 방법과 GC의 회수율이 97~102%임에 반해, IR 방법은 104~114%로 다소 과대 평가되지만 밀폐와 같은 인위적인 요인을 제거할 수 있다는 장점이 있다 (Rottmann and Joergensen, 2011).
NaOH 방법은 고가의 장비가 필요 없어 실험실내 항온 배양 실험에서 토양 호흡량을 측정하는 데 가장 빈번하게 이용되지만, 항온 배양 기간 동안 용기를 밀폐시켜야 하기 때문에 토양 미생물에 필요한 산소 공급이 제한적일 수 있다는 단점이 있다 (Lucretia et al., 2012; Rottmann and Joergensen, 2011). 이와 같은 단점에도 불구하고, 특정 처리에 따른 미생물 호흡량 비교 연구에서는 큰 문제 없이 사용된다 (Lim et al., 2012, 2017). 또한, NaOH 방법으로 토양으로부터 방출되는 CO2를 100% 포집할 수 있다는 장점이 있어 CO2의 탄소동위원소비 (δ13C) 분석을 위한 전처리 방법으로도 활용된다 (Harris et al., 1997; Jeon et al., 2017). 토양 호흡 CO2의 δ13C를 측정하면 C3 식물과 C4 식물 유래 유기물의 분해 특성을 비교할 수 있다는 장점이 있다 (Boutton, 1996; Bruno, 2005).
하지만, 온도 상승에 따른 토양 호흡 변화 연구에 NaOH 방법을 이용할 경우 CO2 가스 용해도가 온도에 반비례하기 때문에 고온 조건에서 CO2의 흡수 효율이 낮아 토양 호흡량을 과소평가할 수 있는 우려가 있다 (Fang and Moncrieff, 2001). 1기압에서 CO2의 용해도는 온도가 증가함에 따라 0°C, 1.8 cm3 CO2 g-1 water에서 20°C, 0.88 cm3 CO2 g-1 water 및 40°C, 0.65 cm3 CO2 g-1 water로 감소한다 (Shell Internationale Petroleum Maatschappij BV, 1978). 이와 같은 온도에 따른 CO2의 용해도 감소는 CO2가 순수한 물과 반응하여 탄산(H2CO3)이 생성되고, 약산인 탄산이 이온화 되어 중탄산이온 (HCO3-)과 탄산이온 (CO32-)이 생성되는 탄산 평형 시스템의 결과이다(Reid et al., 1987).
CO2 + H2O ↔ H2CO3 (Eq. 1)
H2CO3 ↔ HCO3- + H+ (pKa1 = 6.37 at 25°C) (Eq. 2)
HCO3- ↔ CO32- + H+ (pKa2 = 10.25 at 25°C) (Eq. 3)
탄산해리상수 (pKa)를 고려하면, 강알칼리성 NaOH 용액에서 정반응이 우세하게 되고, 용액의 pH가 12 이상인 조건에서는 대부분 CO32-로 존재하여 온도 상승시에도 안정적으로 존재할 수 있다 (David, 1990, 1991). 하지만, 온도 상승에 따른 NaOH 용액의 CO2 흡수 효율에 대한 연구 결과가 없어 NaOH 방법으로 온도 변화에 따른 토양 호흡량 (CO2 발생량) 변화 측정시 결과의 신뢰도에 의문이 제기 되고 있다. 따라서, 본 연구에서는 이와 같은 의문을 해소하기 위해 온도 변화에 따른 NaOH 용액의 CO2 흡수량을 정량하기 위해 1) 온도 상승에 따라 NaOH 용액에서 CO2의 용해도가 감소하여 고온 조건에서 CO2의 흡수량이 감소하거나, 2) NaOH 용액은 순수한 물과 달리 탄산 평형에서 정반응이 우세하기 때문에 온도에 따른 CO2 흡수량에 차이가 없을 것이라는 두 가지의 상반된 가설을 세워 실험을 실시하였다.
Materials and Methods
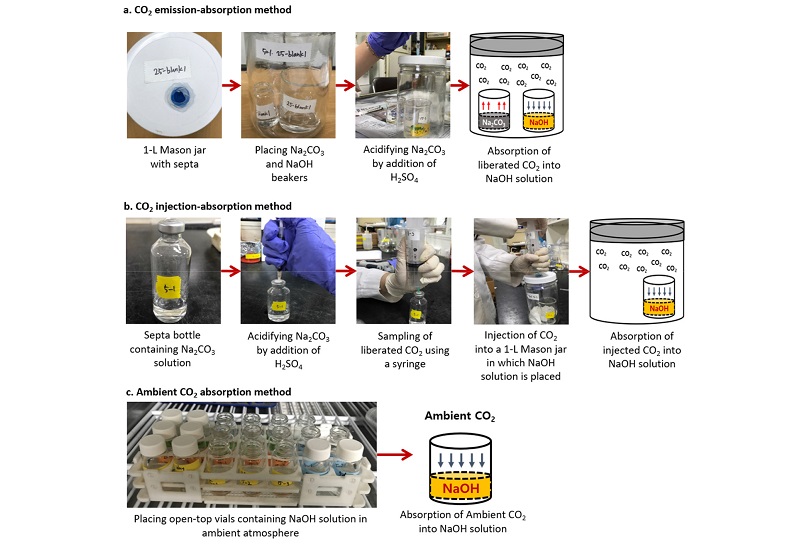
실험 개요 본 연구에서는 CO2 방출-흡수, CO2 주입-흡수, 외기 CO2 흡수 등 세 가지 실험을 수행하였다 (Table 1). 각 실험은 5, 15, 25, 35°C에서 5반복 수행하였다. CO2 방출-흡수 실험에서는 밀폐 용기에 각각 Na2CO3 용액과 NaOH 용액이 담긴 비이커를 넣고 황산으로 Na2CO3 용액을 산성화 시켜 CO2를 방출 시키고, 방출된 CO2가 NaOH에 흡수되도록 하였다 (Fig. 1(a)). 하지만, CO2 방출-흡수 실험에서는 NaOH 용액에서의 CO2 용해도 뿐만 아니라, Na2CO3 용액에서의 CO2 용해도도 온도 민감성을 나타낼 수 있다. 따라서, Na2CO3 용액에서의 CO2 발생 속도에 대한 온도의 영향을 배제하고 NaOH 용액에서의 CO2 용해도의 온도 민감성을 독립적으로 조사하기 위해 CO2 주입-흡수 실험을 추가하였다. CO2 주입-흡수 실험에서는 별도의 septa 병에 Na2CO3 용액을 넣고 황산으로 산성화 시킨 후 발생된 CO2를 주사기로 포집하여 NaOH 용액이 담긴 별도 용기에 주입하여 NaOH 용액의 CO2 흡수 효율을 조사하였다 (Fig. 1(b)). 마지막으로, 외기 CO2 흡수 실험에서는 인위적인 CO2 발생이나 주입 없이 NaOH 용액을 외기에 노출시켜 NaOH 용액의 CO2 흡수 효율을 조사하였다 (Fig. 1(c)).
CO2 방출-흡수 실험 1 L Mason 병 뚜껑에 구멍을 뚫고 septa cap을 실리콘으로 고정하였다. 6.25% Na2CO3 용액 20 mL (CO2 55 mg, 0.5 N NaOH 10 mL가 포집할 수 있는 CO2의 50%에 해당)가 담긴 비이커와 0.5 N NaOH 용액 10 mL가 담긴 바이얼을 Mason 병에 넣고 밀봉한 후 각각의 온도 (5, 15, 25, 35°C)가 설정된 항온배양기에 미리 넣어 용액의 온도를 항온 배양 온도와 평형을 이루도록 하였다. 1시간 후 1 mL 주사기로 진한 황산 0.1 mL를 septa cap을 통해 주입하여 Eq. 1~3의 탄산 평형의 역반응에 의해 CO32-가 CO2로 방출되도록 하였다 (Fig. 1(a)). 0.5 N NaOH에 포집된 CO2는 반응 6시간, 1일, 2일, 3일, 5일째에 0.5 N HCl로 적정하여 정량하였다. 각 반응시간별로 별도의 Mason 병을 준비하여 실험하였다.
CO2 주입-흡수 실험50 mL septa 바이얼에 0.25 N Na2CO3 용액 10 mL를 넣고, septa를 끼우고 클램프를 이용해 밀봉한 후 50 mL 주사기로 바이얼 내부 공기를 제거하였다. 1 mL 주사기로 진한 황산 0.1 mL를 주입하여 CO2를 발생시켰고, 1시간 후에 50 mL 주사기로 CO2를 포집하였다. 포집된 CO2의 NaOH 흡수량을 조사하기 위해, Mason 병에 0.5 N NaOH 용액 10 mL를 담은 비이커를 넣고 CO2 방출-흡수 실험에 사용한 septa cap이 장착된 뚜껑을 닫았다. CO2 방출-흡수 실험과 동일하게 NaOH 용액의 온도 평형을 위해 Mason 병을 항온배양기에 미리 넣었다. 1시간 후 50 mL 주사기로 Mason 병 안의 공기를 제거하여, 주사기로 포집한 CO2 가스를 주입하였다 (Fig. 1(b)). 0.5 N NaOH에 포집된 CO2는 반응 6시간, 1일, 2일, 3일, 5일째에 0.5 N HCl로 적정하여 정량하였다. 각 반응시간별로 별도의 Mason 병을 준비하여 실험하였다.
외기 CO2 흡수 실험 25 mL 바이얼에 0.5 N NaOH 10 mL를 담고 뚜껑을 닫은 상태로 각각의 온도가 설정된 항온배양기에 넣어 NaOH 용액의 온도가 항온 배양 온도와 동일하도록 하였다. 1시간 후 외기 CO2가 NaOH에 흡수되도록 바이얼의 뚜껑을 제거하였고, 반응 6시간, 1일, 2일, 3일, 5일째에 0.5 N HCl로 적정하여 정량하였다 (Fig. 1(c)). 각 반응시간별로 별도의 바이얼을 준비하여 실험하였다.
계산 및 통계분석 CO2 농도는 다음의 식으로 계산하였다.
CO2 = (B-S) × N × E (Eq. 4)
여기서, B는 Blank 적정 시 들어간 HCl 양 (ml)으로 본 연구에서는 2반복 하여 평균값을 사용하였다. S는 시료 (Sample) 적정 시 소비된 HCl 양 (mL)이며, N은 적정 시약 (HCl)의 노르말 농도 (0.5 N), E는 CO2의 당량 (22 mg)이다.
모든 분석 결과는 Shapiro-Wilkt 검정과 Levene's 검정으로 정규성 및 등분산성을 검정하였다. 모든 분석 값이 정규성을 보이며 이질성이 나타나지 않아 데이터 변환은 하지 않았다. 항온배양기간 중 온도에 따른 CO2 흡수량 차이는 SPSS 21.0 (SPSS Inc., Chicago)의 일반선형모형을 이용하여 ANOVA로 평가하였으며, 처리 효과가 인정될 경우 Duncan의 다중 비교를 통해 처리 간 차이를 비교하였다. 모든 통계분석은 95% 수준에서 유의성을 검토하였다.
Results and Discussion
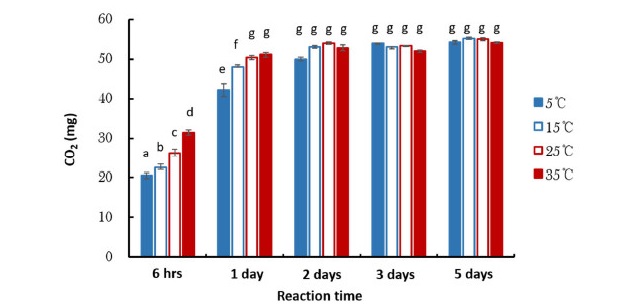
CO2 방출-흡수 실험에 의하면 반응 초기에 해당하는 6시간과 1일째에는 온도가 상승함에 따라 CO2 흡수량이 증가하였다 (P < 0.001) (Fig. 2(a), Table 2). 구체적으로 반응 6시간째에는 5°C에서 Na2CO3의 형태로 투입된 CO2 (55 mg)의 37%, 35°C에서는 57%가 흡수되었고, 반응 1일째에는 5°C에서 77%, 35°C에서 93%가 흡수되었다. 이와 같은 경향은 온도 상승에 의해 CO2의 용해도가 감소하여 NaOH 용액의 CO2 흡수능이 감소할 수 있다는 가설 그리고 고온 조건에서 알칼리 용액의 CO2 흡수능이 급격하게 감소한다는 Edwards and Sollins (1973)의 보고와 상반된다. 이와 같은 온도 상승에 따른 NaOH 용액의 CO2 흡수능 증가는 CO2 주입-흡수 실험의 반응 6시간째 (Fig. 2(b))와 외기 CO2 흡수 실험의 전체 반응 시간에서도 관찰 되었다 (Fig. 2(c)). 비록 CO2 주입-흡수 실험의 반응 1일째 5°C를 제외한 온도 구간에서 온도가 상승함에 따라 CO2 흡수량이 감소하는 경향이 나타났지만, 통계적으로 유의하지 않았다 (P > 0.05) (Fig. 2(b), Table 2).
Table 2. F statistics and P values for CO2 absorption of NaOH with temperature during different reaction times in three experiment; CO2 emission-absorption, CO2 injection-absorption, and ambient CO2 absorption†.
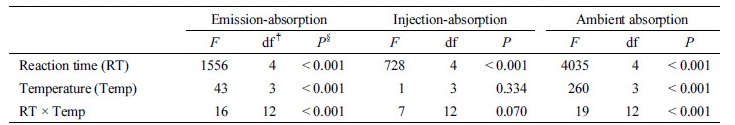
†Details of the experiment are described in Table 1 and Fig. 1.
‡df is the degree of freedom used in the derivation of the F and P statistics.
§The bold indicates that the effects are significant at α= 0.05.
CO2 방출-흡수 실험에서 이와 같은 온도 상승에 따른 NaOH 흡수량 증가는 일차적으로 온도가 상승함에 Na2CO3 용액에서의 CO2 용해도가 감소하여 CO2 방출 속도가 빨라졌기 때문으로 판단된다 (Fig. 2(a)). 즉, NaOH 용액의 CO2 흡수능이 온도와 무관하다 하더라도 Na2CO3 용액에서의 CO2 방출 속도가 증가하면 더 많은 CO2가 NaOH 용액에 흡수될 수 있기 때문이다. 하지만, 가스상 CO2를 직접 주입한 CO2 주입-용해 실험 (Fig. 2(b))과 NaOH 용액을 외기 CO2에 노출시킨 실험에서도 (Fig. 2(c)) 유사한 경향이 나타났기 때문에 온도 상승에 의한 Na2CO3 용액에서의 CO2 용해도 감소만으로 결과를 설명하기에는 제한이 있다. CO2 가스는 확산에 의해 NaOH 용액으로 이동되어 일련의 탄산평형과정을 통해 최종적으로 CO32-로 안정화되는데, 가스의 확산 속도는 온도에 비례하기 때문에 상승 온도 조건에서 NaOH 용액의 CO2 흡수량이 증가할 수 있다 (Belgodere et al., 2015; Cadogan et al., 2014). 예를 들면, Maharajh and Walkley (1972)는 CO2의 확산 계수 (105 cm2 s-1)가 5°C 0.085, 15°C 1.09, 25°C 1.44, 그리고 35°C 1.82로 온도에 따라 증가한다고 하였다. 따라서, 이상의 결과에 의해 온도가 상승함에 따라 CO2의 용해도가 감소하여 NaOH 용액의 CO2 흡수능이 감소하지 않고 오히려 CO2 분자의 확산 속도가 증가하여 NaOH 용액의 CO2 흡수능이 높아졌다.

Fig. 2.
Changes in the CO2 absorption amount of NaOH solution trap with temperature measured using a. CO2 emission-absorption method, b. CO2 injection-absorption method, and c. ambient CO2 absorption method. Standard error bars are provided and some bars are not depicted due to small error. Different letters on the data bars indicate significant (P<0.05) difference among the treatments (temperature and reaction time). .
한편, CO2 방출-흡수 실험에서 반응 2일째부터는 투입한 CO2의 95% 이상이 흡수되어 NaOH 용액의 CO2 흡수 효율이 높은 것으로 나타났다. Lim et al. (2017)도 퇴비화 기간 동안 방출된 CO2를 NaOH 용액으로 포집하여 정량한 결과, 포집된 탄소의 양이 퇴비화 기간 동안 손실된 탄소의 양과 동일함을 확인하여 NaOH 용액의 CO2 포집능이 우수함을 보여준 바 있다. 이와 같은 결과는, 토양 호흡에서 발생된 CO2의 δ13C 분석시 NaOH 용액을 이용한 CO2 포집 방법의 타당성을 간접적으로 제시한다.
Conclusions
온도 변화에 따른 토양 호흡량 (CO2 발생량) 변화 측정시 NaOH 용액의 CO2 흡수능 변화를 조사한 결과, 온도가 높아짐에 따라 CO2의 용해도가 감소한다는 이론과는 달리 온도 상승에 따라 NaOH의 CO2 흡수량이 많아졌다. 이는 온도가 상승함에 따라 CO2의 확산 속도가 증가하여 NaOH 용액에 의한 CO2 흡수가 빠르게 일어났기 때문으로 해석되었다. 따라서, 일부의 우려와 달리 NaOH 용액을 이용하여 온도 상승에 따른 토양 호흡량 변화 연구시 온도 상승에 의한 CO2의 용해도 감소가 연구 결과에 영향을 미치지 않을 것으로 판단된다. 하지만, 일반적으로 알려지고 있는 온도 상승에 따른 토양 호흡량 증가 경향이 단순히 유기물 분해 속도 증가만을 반영하지 않고, 생성된 CO2의 확산 속도 증가도 함께 반영할 수도 있기 때문에 이에 대한 추가적인 검토가 필요하다.