Introduction
Materials and Methods
수질 시료 채취 및 분석 방법
보관 온도 및 기간 설정
수질 시료의 N2O 계산 및 통계분석
Results and Discussion
Conclusions
Introduction
농업부문에서 발생하는 온실가스 중 아산화질소 (Nitrous Oxide; N2O)는 2020년 기준 약 9.2백만ton CO2-eq이며, 이 중 약 60% (5.6백만ton CO2-eq)는 농경지에 투입된 질소원 (요소, 유안, 퇴비 등)의 질산화 및 탈질 과정을 통해 배출된다 (Coopper et al., 2017; Qin et al., 2019). 그 중 수계유출 및 유출된 질소가 대기 휘산되는 간접 배출량은 총 1.8백만 ton CO2-eq로 농업 분야 N2O 총 배출량의 약 30%를 차지한다 (GIR, 2022). 간접배출은 계수 (EF5)로 산정되며, 3개로 구분된다 (Moiser et al., 1998; Hiscock et al., 2003; IPCC, 2019): 1) EF5g(groundwater): 농경지 지표 유출수, 지하침투수, 강상류, 2) EF5r(rivers): 강하류, 저수지, 3) EFe(estuaries): 강어귀이다. 특히, EF5g는 농경지 직접적 관련이 크기 때문에 토양에 투입하는 질소 및 유출에 큰 영향을 받는다. 따라서, 농업부문의 정확한 N2O 배출량을 산정하기 위해서 EF5g의 구성요소인 N2O와 NO3-의 정확한 분석이 필요하다. 수질 시료 채취 후, 바로 분석이 어려운 경우 동결의 방법이 관행적으로 사용되고 있으나 (Wissmar et al., 1997; Mitchell and Lamberti, 2005), Fellman et al. (2008)에 따르면, 7일간 동결한 시료의 용존탄소, 질소, 인의 함량이 감소하였다는 연구 결과가 제시되었다. 이와 같은 수질 시료의 분석 오차 발생 가능성을 고려하여 국내에서는 환경부 수질오염공정시험기준 (2018)을 따르고 있으며, 특히 무기태 질소 (NH4+, NO3-) 분석 시료는 4°C로 냉장 보관 및 48시간 이내에 분석하도록 고시되어있다. 하지만, 수질 시료의 N2O 분석 시 시료의 보관 기간 및 방법에 관한 국내 연구는 부족한 실정이다. 따라서, 본 연구는 농경지 인근 하천수 시료의 보관 기간 및 방법에 따른 N2O 배출량을 평가하였다.
Materials and Methods
수질 시료 채취 및 분석 방법
본 연구는 2023년 12월에서 2024년 1월에 2 - 3주 간격으로 총 3회 전라북도 임실군과 장수군의 농경지 인근 하천에서 6점의 수질 시료를 채취하였다 (Table 1). 수질 시료의 pH, TN (total nitrogen), PO4-P를 수질오염공정기준법에 제시된 방법으로 전처리하여 분석하였다 (Ministry of Environment, 2018). 이때, TN과 PO4-P는 분광광도계 (QVIS5000 UV-VIS, Cmac, Republic of Korea)로 분석하였다(Table 2). 수질 시료의 N2O 배출량을 측정하기 위해 US EPA (2004)와 Kim et al. (2011)의 선행연구를 참고하여 Headspace법으로 수행하였다. 실험실 여건에 따라 진공 펌프 (DOA-P704-AC, Gast, USA)를 이용하여 바이얼 (110 mL) 내부 잔류 기체 제거 후 고순도 N2 가스 (<99.999%)를 주입하였다. 전처리한 바이얼에 시료 40 mL 주입 후, 항온기 25°C에서 2시간 보관하여 바이알 내부 Headspace의 N2O와 수질시료의 N2O 농도 간 평형이 이루어지도록 하였다 (Butler and Elkins, 1991; Walter et al., 2006). 이후, 60 mL syringe를 이용하여 바이얼 내부의 N2O를 채취하였다. Rust et al. (2000)은 25°C가 질소 탈질이 일어나는 최적의 온도라고 하였으며, 본 연구에서는 탈질 과정에서 발생하는 중간산물로 N2O가 발생할 수 있다고 판단하였다. 따라서, 본 연구에서는 선행연구를 바탕으로 평형시간 및 온도를 설정하였다.
Table 1.
The coordinates and landuse of water samples investigated in this study.
| Water sample code | Coordinates | Land use type1 | |
| W1 | 127°19′30″E | 35°30′28″N | Paddy, Livestock feedlot |
| W2 | 127°19′37″E | 35°32′13″N | Forest, Residential |
| W3 | 127°18′49″E | 35°32′50″N | Paddy |
| W4 | 127°22′39″E | 35°34′29″N | Paddy |
| W5 | 127°23′15″E | 35°34′50″N | Paddy |
| W6 | 127°23′13″E | 35°34′49″N | Paddy |
Table 2.
The concentration of various nutrient in water samples immediately after sampling (<48 hrs), used for experiments under different storage temperatures.
보관 온도 및 기간 설정
수질 시료는 Fellman et al. (2008)에서 제시한 용존 질소가 감소한 기간인 7일을 기준으로 시료 채취 직후 및 냉장과 동결 상태에서 5, 7일이 경과하였을 때 보관 온도 및 기간에 따른 N2O 배출량을 시료 채취 후 즉시 분석 (0일)한 결과와 비교하였다. 동결 시료의 경우 실험 전날 냉장 (4°C)에 보관하여 해동하였다. 모든 시료는 실험 전 상온에 방치하여 시료의 온도를 동일하게 한 후 실험을 진행하였다. 냉장 보관 온도는 수질오염공정시험기준 중 질소 항목에 제시되어있는 4°C로, 동결 시료의 온도는 Fellman et al. (2008)을 참고하여 -16°C로 설정하였다 (Ministry of Environment, 2018). 냉장에 보관한 시료는 채취한 시료를 각각 300 mL 플라스틱 bottle에 옮겨 담아 0, 5, 7일의 간격으로 분석하였다. 동결 시료의 경우 해동 시 보관 초자 파손 우려 및 추후 분석을 위하여 재냉각 시 질소 등의 손실 우려가 있을 것으로 판단하였다 (Takenaka et al., 1992; Corriveau et al., 2008). 따라서, 동결 시료는 2 - 3주 간격으로 채취한 시료를 각각 다른 시기에 채취하여 채취 직후 (0일)와 동결하였을 때 N2O 배출량을 비교 분석하였다 (Exp 1: 2023. 12. 04 시료 채취, 0일 vs 5일; Exp 2: 2023. 12. 18 시료 채취, 0일 vs 7일).
수질 시료의 N2O 계산 및 통계분석
보관 기간에 따른 N2O 배출량의 감소를 판단하기 위하여 가스크로마토그래피 (7890B, Agilent Technologies, USA)로 기상 (N2OHS), 액상(N2ODIS)를 나누어 분석하여 전체 (N2OTOT)를 산정하였으며, 계산은 Eq. 1와 같다 (US EPA, 2004).
N2OHS는 시료의 내부 평형을 통하여 배출된 기상 (headspace)의 N2O 농도, N2ODIS는 액상중 N2O 농도로 이는 바탕시료 (바이얼 내 N2가스 농도)에서 N2OHS를 빼준 값을 의미한다. N2OTOT는 시료 전체의 N2O 농도를 말한다. 보관 기간에 따른 N2O 배출량 변화는 다음과 같이 계산하였다.
N2Ochange는 시료 보관기간에 따른 N2O 배출량 변화를 백분율로 환산한 값, N2Os는 보관기간 (5, 7일)에 따른 N2O 배출량, N2Oi는 시료 채취 후 즉시 (0일) 분석하였을 때 배출량이다. 수질시료의 보관 기간에 따른 N2O 배출 특성은 IBM SPSS 28을 사용하여 통계처리하였다. 냉장 시료의 보관기간별 N2O는 일반선형모형을 이용한 ANOVA 분석 후, DMRT (duncan’s multiple range test)로 처리간 평균에 대한 사후검정을 유의수준 5%로 실시하였다. 동결 시료의 N2O는 대응표본 T-test 검정을 진행하였다.
Results and Discussion
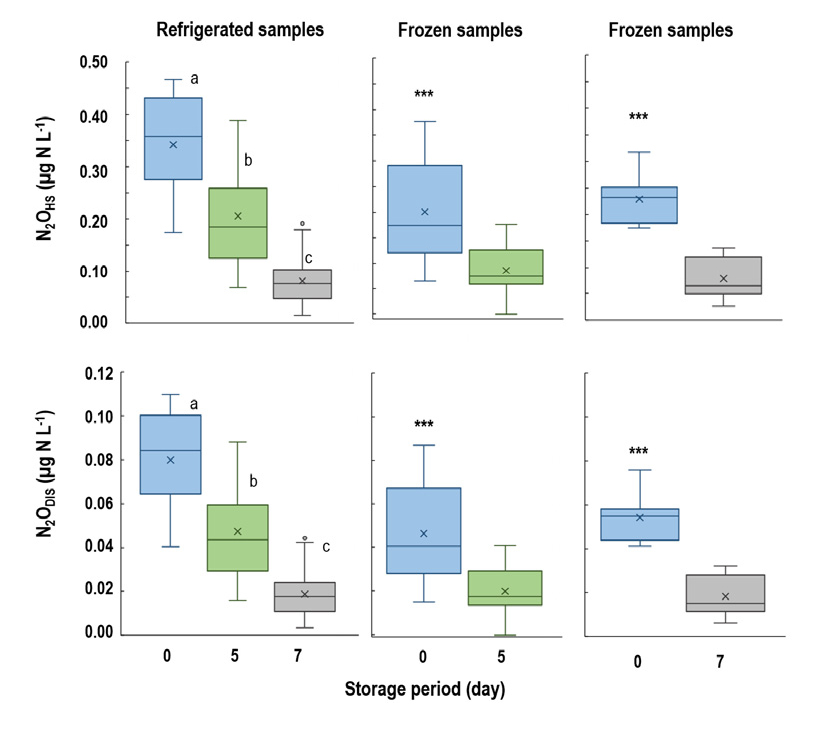
냉장 시료의 N2OTOT 평균은 0일 0.42 µg N L-1, 5일 0.25 µg N L-1, 7일 0.09 µg N L-1로 감소하였다 (P < 0.001) (Table 3). 동결 시료의 경우에도 exp. 1의 N2OTOT는 0일에 0.23 µg N L-1 였으나 5일 후 0.10 µg N L-1로 감소하였으며 (P < 0.001), exp. 2 또한 0일에 0.30 µg N L-1, 7일 후 0.09 µg N L-1로 N2O 농도가 감소하였다 (P < 0.001) (Table 3). N2OHS와 N2ODIS 분석 결과, 모든 보관 온도에서 시료 채취 직후에 비하여 기간이 지남에 따라 N2O 농도가 감소하였다 (Figs. 1 - 2) (P < 0.001). N2Ochange는 냉장 시료의 경우, 5일 후 약 -41%, 7일 후 약 -78%였으며, 동결 시료의 경우 5일 후 약 -60%, 7일 후에는 약 -66%였다(Table 3). APHA (1995)와 Nollet (2000)의 연구 결과에 따르면, 수질 시료를 4°C 혹은 동결 상태로 보관하였을 때 질소 손실을 억제한다고 하였으나, 본 연구 결과 40 - 78% N2O 농도가 감소하였다. 또한, 수질 시료를 5일간 보관하였을 때 동결 시료의 N2Ochange가 냉장 시료보다 높은 경향을 보였다. 이와 같은 결과는 시료 보관 및 해동 과정에서 질소의 화학적 변화가 발생하기 때문으로 판단된다. Corriveau et al. (2008)에 따르면, 1) 시료의 동결 및 해동 과정에서 무기태 질소 (NO3-, NO2-, NH4+)의 산화 및 분해가 발생, 2) pH 5 이상, PO4-P가 포함된 수질 시료의 동결 및 해동 시 NO2- 분해를 촉진한다고 하였다 (Goyal and Hafez, 1995). 본 연구에서 사용한 시료는 농경지 인근 하천수로 pH는 7.7 - 9.2, PO4-P가 0.01 - 0.06 mg L-1로 (Table 2), 시료 채취 후 초반에 무기태 질소의 분해가 활발하게 이루어졌을 가능성이 높다. 따라서, 보관 기간이 지남에 따라 질소 함량이 감소하여 총 N2O 배출량 또한 감소하였을 것으로 판단된다. 특히, 수질 시료에 존재하는 암모니아성 질소 (NH4+, NH3)는 pH가 8 이상일 때 NH3 형태로 휘산되기 쉬우며, pH가 낮아질수록 NH4+의 안정한 형태로 존재하게 된다 (APHA, 1998). 따라서, 시료 채취 직후에 바로 분석이 이루어지지 못할 경우, 산 처리를 통해 pH를 낮추고 시료를 냉장 혹은 동결하여 질소의 화학적 반응을 방지해야할 것으로 판단된다 (Corriveau et al., 2008; Jeong et al., 2022).
Table 3.
Mean and range of total N2O concentrations for different storage periods at each temperature.
|
Storage temperature |
Storage period (day) | N2OTOT1 | |||
| µg N L-1 |
N2Ochange (%) | P value2 | |||
| Mean | Range | ||||
| 4°C | 0 | 0.42 | 0.26 - 0.57 | NA3 | <0.001 |
| 5 | 0.25 | 0.12 - 0.43 | -40.5 | ||
| 7 | 0.09 | 0.03 - 0.21 | -77.9 | ||
| -16°C | 0 | 0.23 | 0.09 - 0.46 | NA | <0.001 |
| 5 | 0.10 | 0.05 - 0.21 | -60.4 | ||
| 0 | 0.30 | 0.19 - 0.37 | NA | <0.001 | |
| 7 | 0.09 | 0.06 - 0.16 | -66.4 | ||
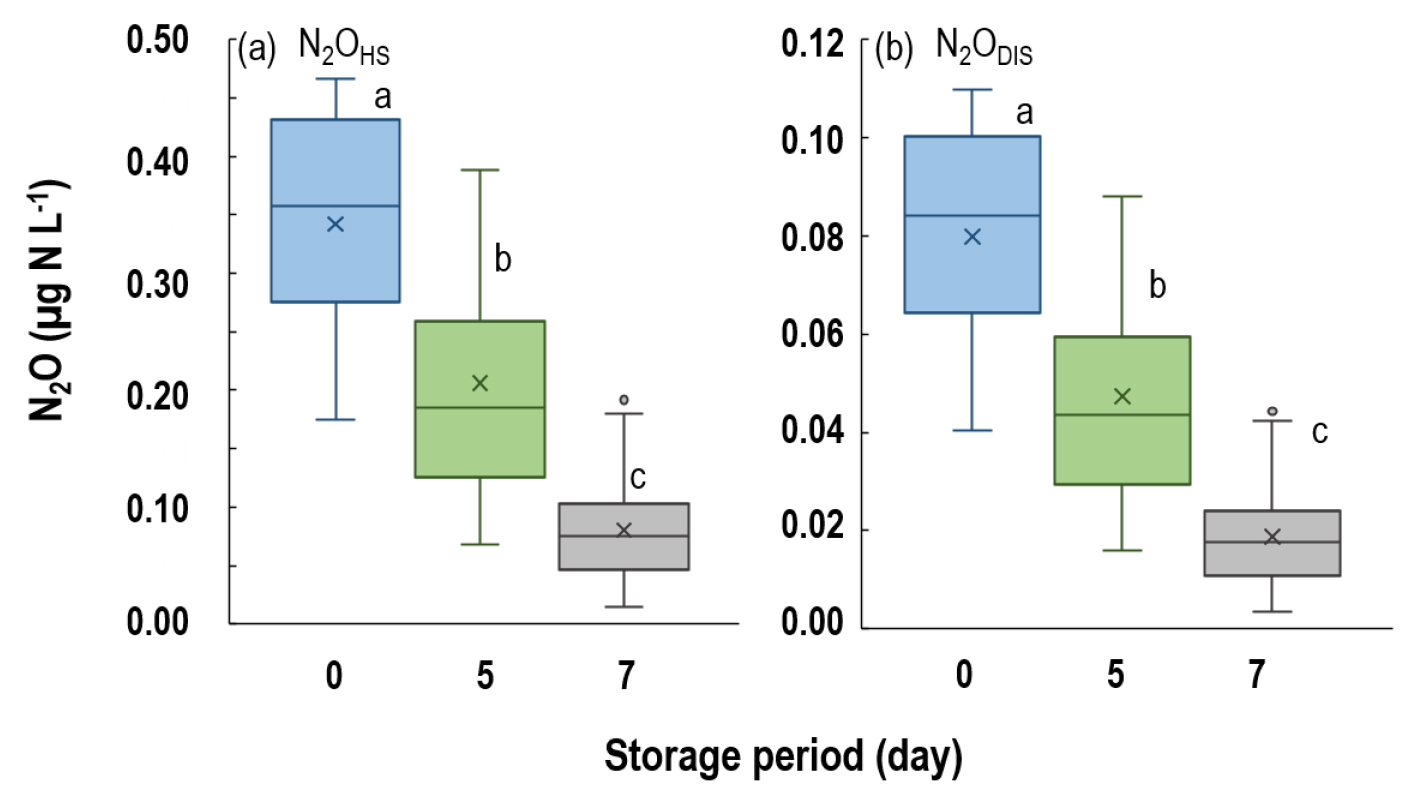
Fig. 1.
Changes in headspace and dissolved N2O concentration in water samples during storage at 4°C. (a) N2OHS: aqueous gas concentration in headspace after equilibrium (n = 18), (b) N2ODIS: aqueous gas concentration in water after equilibrium (n = 18). Statistical difference (P < 0.05) was indicated above boxes with different letters. The boxes represent interquartile range (IQRs) the first quartile (Q1) to the third quartile (Q3), and vertical lines within boxes indicate median values. “×” is average values, and “○” is outlier values. Upper and lower whiskers indicate.
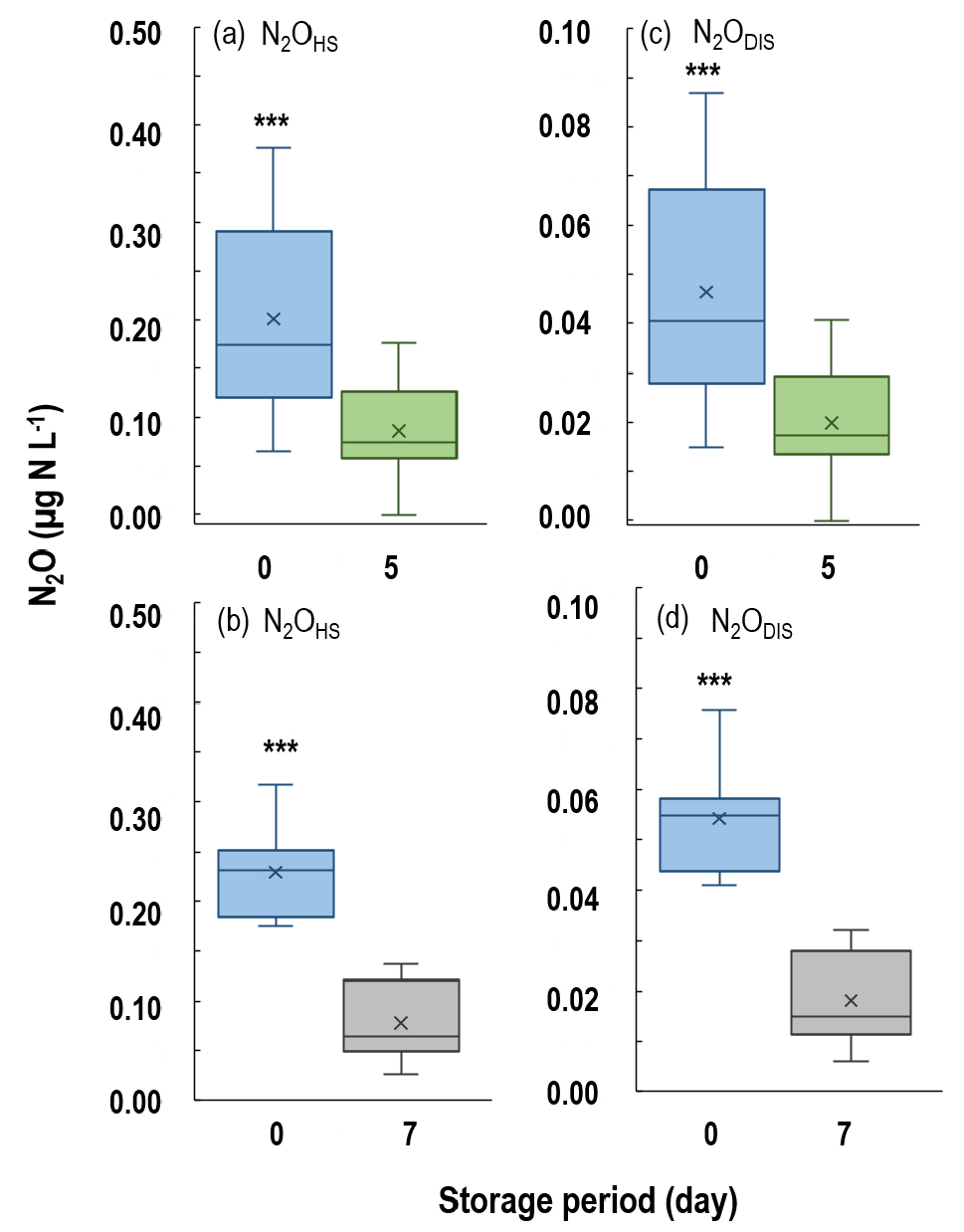
Fig. 2.
Changes in headspace and dissolved N2O concentrations in water samples during storage at –16°C. (a),(b): N2OHS, aqueous gas concentration in headspace after equilibrium (n = 18), (c),(d): N2ODIS, aqueous gas concentration in water after equilibrium (n = 18). The significance of the effect of the storage period was indicated above boxes with *** (P < 0.001). The boxes represent interquartile range (IQRs) the first quartile (Q1) to the third quartile (Q3), and vertical lines within boxes indicate median values. “×” is average values, and “○” is outlier values. Upper and lower whiskers indicate.
Conclusions
본 연구는 농경지 인근 수질 시료의 보관 온도 및 기간이 N2O 배출량에 미치는 영향을 평가하였다. 본 연구 결과, 냉장 및 동결하여 시료를 보관할 경우 시간이 지남에 따라 N2O 배출량이 유의미하게 감소하였음을 확인하였다. 특히, 수질 시료를 냉장 보관 시 7일 동안 최대 78%까지, 동결 보관 시 최대 66%까지 N2O 배출량이 감소하였다. 이러한 결과는 시료 보관 중 질소 손실을 최소화하는 것이 정확한 N2O 배출량 평가에 필수적임을 시사한다. 본 연구 결과를 바탕으로 N2O 배출량 감소 원인을 파악하기 위한 NH4+, NO2-, NO3- 등의 무기태 질소의 시계열적 연구 및 산 처리 및 5일 이내 보관 시 온도에 따른 N2O 배출량 비교평가에 관한 추가 연구가 필요할 것으로 판단된다.