Introduction
Materials and Methods
조사지역 선정 및 토양 시료 채취
화학적 특성 분석
생물학적 특성 분석
통계 분석
Results and Discussion
토지 이용별 화학적 특성
토지 이용별 생물학적 특성
화학적, 생물학적 특성 상관관계
Conclusion
Introduction
토양의 생물학적 특성은 토양의 다양한 기능에 대한 정보를 제공하고, 인위적인 관리 (농업 및 임업) 또는 토양 오염의 정도를 확인할 수 있는 지표로 사용될 수 있기 때문에 이와 관련된 많은 연구가 진행되고 있다. 생물학적 특성을 활용한 연구에는 지렁이와 같은 지표 생물을 이용한 독성 평가 (Dorn et al., 1998), 식물 독성 (Jones et al., 2012; Stohlgren et al., 1999) 그리고 미생물을 이용한 방법 (Jordan et al., 1995; Filip, 2002)등이 있다. 미생물은 생태계의 기본적인 구성요소이면서 분해자로서의 중요한 기능을 담당하고 있으며, 따라서 토양 질과 건강성 등은 토양 내 미생물 활성 측정을 통해 평가 할 수 있다.
토양의 미생물 활동은 생태계 안정성과 비옥도에 직접적인 영향을 미치며 토양 건강을 유지하기 위해서는 좋은 수준의 미생물 활동이 필수적이라는 것이 널리 알려져 있다. 토양 미생물 활동 즉, 토양 호흡 및 효소 활동은 비옥도를 증진시키며, 토양 생태계에서 영양소 전달 과정과 에너지 순환 등에 중요한 역할을 한다 (Weaver et al., 1994; Doran and Zeiss, 2000; Nwachukwu and Pulford, 2011). 토양 내 미생물은 자연적인 요인과 인위적인 요인에 모두 민감하게 반응하여 환경 스트레스 또는 토양의 질 또는 건강성 변화에 효과적인 지표로 간주되고 있다 (Weaver et al., 1994). 이로 인해 다른 토양 특성에 대한 데이터와 함께 특정 효소 활성은 환경, 오염물질 등의 스트레스에 대한 미생물의 반응을 나타내는 유용한 지표로 활용된다 (Doran, 1994; Unger et al., 2013; Liu et al., 2014, 2015; Ma et al., 2016).
토양 효소는 주로 토양 미생물, 동물, 식물 분비물 및 잔류물의 분해에서 발생하는 특별한 촉매 역할을 수행한다 (Gil-Sotres et al., 2005; Hammesfahr et al., 2011). Arylsulfatase (ASF)는 유기 황 에스테르의 가수분해를 촉매하고 유기적으로 결합된 황을 토양 용액으로 방출시키며, 토양 내 황 순환에 중요한 역할을 한다 (Turner et al., 2016). Gil-Sotres et al. (2005)에 따르면 dehydrogenase (DHA)는 토양의 환경 및 미생물 활동 상태를 나타내며, 토양질에 미치는 영향 및 토양의 회복된 정도를 평가하는데 사용 될 수 있다. β-Glucosidase (GLU)는 토양에 널리 분포되어 있는 효소로 토양 내 탄소(C) 순환에 영향을 미치며, 토양질 지표로 가장 많이 사용되고 있다 (Bandick and Dick, 1999; Utobo and Tewari, 2015; Chae et al., 2017). Phosphatase (PHA)는 식물과 미생물 모두 인 (P) 공급원으로써 토양 내 인 (P) 순환에 중요한 역할로써 알려졌다 (Turner and Wright, 2014). 토양에서 Urease (URE)는 토양 내 질소 (N) 순환에 영향을 미치며, 유기물 및 미사 (silts)와 밀접한 관련이 있다고 Alef 와 Nannipieri (1995)에 의해 보고된 바 있다.
국내에서 토지 이용에 따른 토양 특성을 평가한 선행 연구로는 농경지, 주거지, 또는 산림에 대한 단일 토지 이용에 따른 토양의 특성만을 평가하였다 (Lee et al., 2010; Kim et al., 2011; Cho et al., 2012; Joa et al., 2013; Lee et al., 2020). 토양 건강성에 대한 평가를 위해서는 토양 이용에 따른 비교 평가도 필요하다고 판단된다.
따라서 본 연구에서는 다양한 토지 분류(산림, 농경지, 주거지, 정화토)에 따른 토양의 화학적 특성과 생물학적 특성을 평가하고, 이를 통해 토지 분류에 따른 특성을 파악하고 토양 건강성을 평가하기 위한 기초 자료로 활용되기 위해 실시되었다.
Materials and Methods
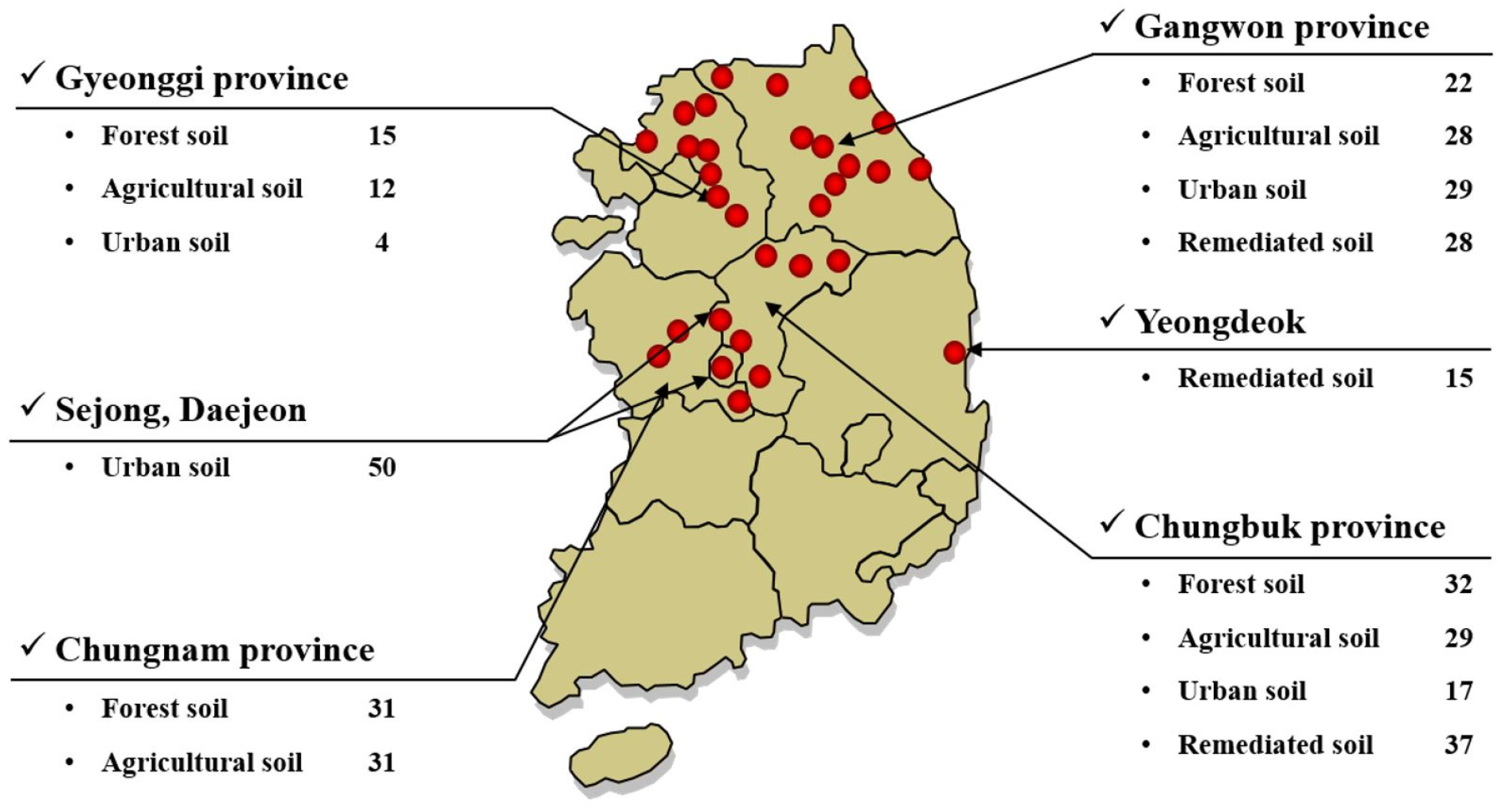
조사지역 선정 및 토양 시료 채취
토지 이용별 시료 채취는 산림, 농경지, 주거지, 정화토로 구분하여 각 100지점씩 8 - 9월에 채취하였다 (Fig. 1). 산림 및 농경지 시료는 환경부의 환경 측정망 지점과 국립농업과학원의 농업변동조사 지점을 포함하여 선정하였다. 주거지의 경우 대전 및 세종, 충북, 강원도에 위치한 공원을 대상으로 하였으며 정화토의 경우 휴·폐광산으로 인해 중금속으로 오염된 농경지에 대해 복원사업이 진행된 지역을 선정하여 표토 (0 – 15 cm)를 채취하였다. 시료 채취 방법은 토양오염공정시험법과 토양화학분석법을 참고하였으며, 시료의 균질화를 위해 hand auger를 사용하여 한 필지에서 최소 5 - 10개를 채취 후 혼합하여 사용하였다. 생물학적 특성인 토양 호흡 및 효소 측정을 위해 시료 채취 후 ICE BOX에 보관하여 이동하였으며, 분석까지 최대 4주 동안 냉장 (4°C) 보관 후 분석에 사용하였습니다.
화학적 특성 분석
토양의 화학적 특성은 농촌진흥청 토양 화학 분석법에 준하여 분석하였다 (NAAS, 2010). 채취한 시료를 풍건 후 2 mm (10mesh) Sieve로 체거름 한 것을 사용하였다. 시료의 pH와 전기전도도 (EC)는 1:5 H2O법을 이용하여 pH meter (MP220, METTLER TOLEDO)와 EC meter (Conductivity Meter S230, METTLER TOLEDO)를 이용하여 측정하였다. 토양유기물함량 (SOM)은 Walkley & Black법으로 하였고, 유효 인산 (Available P2O5)은 Bray No.1 방법으로 추출하여 몰리브덴 청법으로 정량하였으며 Spectrophotometer (UV-1800, SHIMADZU)로 측정하였다. 양이온교환용량 (Cation exchange capacity, CEC)은 1M CH3COONH4 (pH 7.0)를 이용하여 추출 후 ICP-OES (Optima 3200XL, Perkin Elmer, USA)로 분석하였으며, 전 질소 함량 (Total nitrogen)은 Kjeldahl 분해 장치를 이용하여 실시하였다.
생물학적 특성 분석
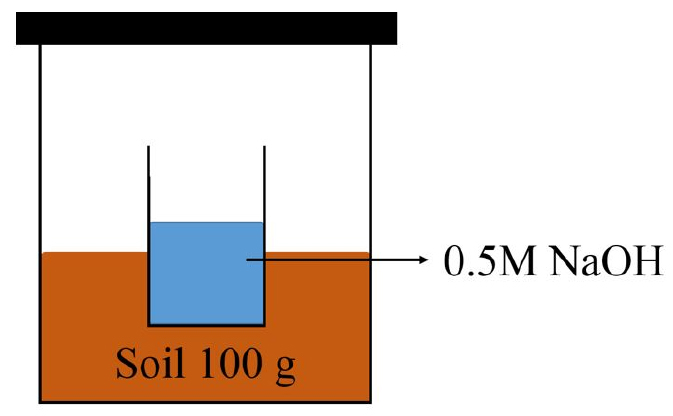
토양의 생물학적 특성은 토양 호흡 및 토양 효소 활성도를 분석하였다. 토양 호흡 및 효소 활성 측정에 습토를 사용하기 위해 시료 채취 후 4°C에서 냉장 보관하였으며, 토양미생물실험법 (2002)과 Methods of Soil Analysis, Part 2: Microbiological and Biochemical properties (Weaver et al., 1994)를 참고하여 수행하였다. 토양 호흡 분석은 300 mL bottle에 습토 100g을 취한 후, 0.5 M NaOH를 Vial에 넣어 bottle 안에 넣어준 후 밀봉하여 25°C에서 72시간 배양하였다 (Fig. 2). 배양 후 0.5 M NaOH 을 비커에 옮긴 후 phenolphthalein 을 지시약으로 1.0 M HCl을 활용하여 보라색에서 무색으로 변할 때까지 적정 하였고, Bromocresol green을 지시약으로 0.2 M HCl로 푸른색에서 노란색으로 변할 때까지 적정한 후 소모된 양을 CO2 발생량으로 환산하였다 (Eq. 1).
M = Hydrochloric acid concentration (0.2 mol L-1)
T = Titrate volume (mL)
44 = CO2 molecular weight (g mol-1)
S = Soil weight (g)
토양 효소 활성은 총 5개 항목: Aryl sulfatase (ASF), Dehydrogenase (DHA), ß-Glucosidase (GLU), Phosphatase (PHA), Urease (URE) 을 분석하였으며, ASF, GLU, PHA 효소의 경우 서로 다른 기질 (p-nitrophenly sulfate, p-nitrophenyl-ß-Glucopyranoside, sodium-p-nitrophenyl phosphate)이 생성물인 p-nitrophenol (PNP)로 전환되어 비색정량하는 방법으로 분석하였다 (Tabatabai and Bremner, 1969, 1970; Eivazi and Tabatabai, 1988). ASF의 경우 토양에 toluene, 0.5 M acetate buffer (pH 5.8), p-nitrophenly sulfate 용액을 넣어 혼합 후 밀봉하여 배양기에서 37°C 1시간 배양하였다. 배양 후 0.5 M CaCl2, 0.5 M NaOH를 가하여 흔들어 여과 후 UV/Vis Spectrophotometer를 이용하여 400 nm에서 측정하였다. Glu의 경우 토양 시료에 toulene, 증류수, 구연산-인산완충용액 (pH 4.9), 0.05 M p-nitrophenyl D-Glucoside (PNG)를 넣고, PHA의 경우 토양 시료에 toluene, 0.025 M p-nitrophenyl phosphate (pNPP)와 0.5M trishydroxymethyl aminimetane (Tris) (pH 6.5)를 첨가한 후 혼합, 30°C에서 1 시간 배양하였다. 배양 후 에탄올을 넣고 30초 교반 후 여과하여 여과액에 2 M Tris 넣어 발색시킨 후 UV/vis spectrophotometer를 활용하여 400nm에서 측정하였다. DHA의 경우 2,3,5-triphenyltetrazolium chloride (TTC)가 triphenly formazan (TPF)으로 환원되는 것을 활용하여 분석하였다 (Casida et al., 1964). 토양시료에 CaCO3를 혼합 후 TTC와 증류수를 첨가하여 섞은 후 밀봉하여 37°C에서 24시간 배양하였다. 배양 후 Methanol을 첨가하여 탈지면으로 막은 Funnel에 혼합물을 탈지면의 붉은색이 없어질 때까지 지속적으로 Methanol을 첨가해주며 여과한다. 100mL 표선까지 methanol을 채운 후 485nm에서 측정하여 정량한다. Urease 활성 측정은 100 mL 삼각 플라스크에 토양 5g, 79.9 mM Urease 2.5 mL를 넣고 37°C에서 2시간 배양 후, 증류수 2.5 mL, KCl 30.0 mL 를 첨가하여 30분간 교반 후 여과한다. 대조구는 기질용액 대신 증류수를 첨가하여 진행한다. 여과액 1.0mL에 4.0mL 증류수로 희석 후 0.3 M NaOH, sodium salicylate solution, 증류수로 만든 시약 5.0 mL 넣은 후 30분 교반 후 발색시켜 690 nm에서 측정하였다 (Kandeler and Gerber, 1988).
통계 분석
화학적 분석 결과값을 box plot으로 나타냈으며, 생물학적 분석 결과는 평균과 표준편차로 나타내었다. 토지 이용별 화학적, 생물학적 특성 결과에 대한 분산 및 정규성의 동질성을 확인하기 위해 ANOVA 분석을 실시하였으며 결과값의 차이를 추가로 설명하기 위해 사후 Duncan’s test를 활용하였다. 화학적, 생물학적 특성 간의 상관관계는 Pearson’s correlation 분석을 활용하여 평가하였으며 모든 통계 분석은 SPSS 26.0 (Statistical package for social science, IBM)를 활용하여 실시하였다.
Results and Discussion
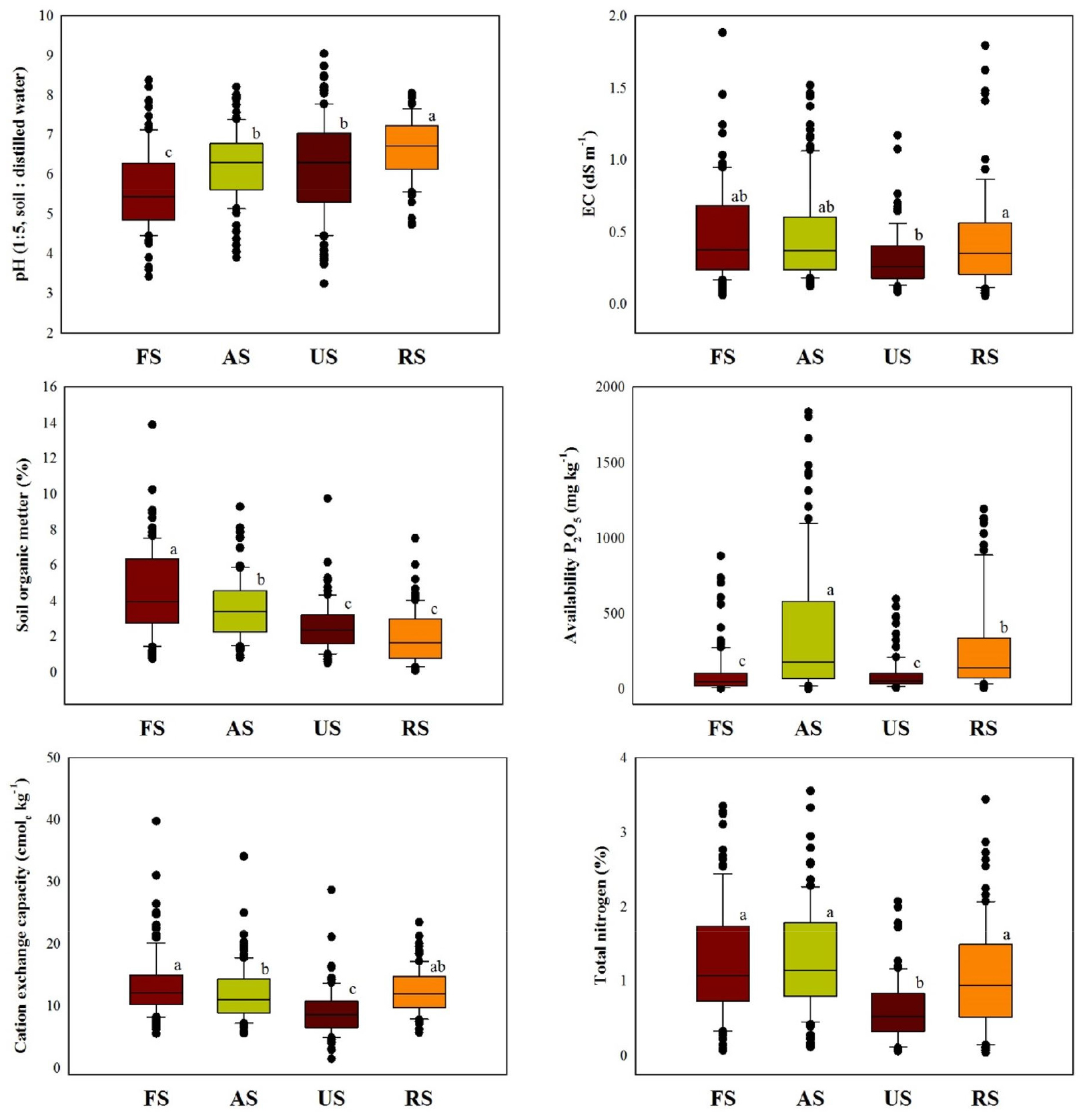
토지 이용별 화학적 특성
산림 토양의 경우 pH (5.59)와 유효 인산 (104.3 mg kg-1)의 측정값은 농경지, 정화토보다 통계적으로 유의하게 낮았으며 EC (0.47 dS m-1)와, 유기물 함량 (4.68%), 그리고 CEC (13.3 cmolc kg-1)는 통계적으로 농경지와 주거지 토양보다 유의미하게 높게 측정되었다 (Fig. 3). 반면 T-N (1.14%) 함량은 다른 토지 이용 토양과 유의미한 차이가 없었다. 국내 산림 토양을 분석한 선행 연구 결과에서 pH의 경우 평균 4.30 - 5.48로 약산성의 특성을 나타냈으며, 이는 부식층의 발달이나 모암, 토양의 질산화율, 토양 내 수소이온과 치환성 양이온의 교환 등으로 인해 산성화 될 수 있다고 보고하였다 (Jeong et al., 2002; Rigueiro-Rodríguez et al., 2012; Lee and Koo, 2020).
농경지 토양의 화학적 분석 결과 (Fig. 3) pH 6.20, EC 0.48 dS m-1, 토양 유기물 함량 3.58%, 유효 인산 487.6 mg kg-1, CEC 11.9 cmolc kg-1, T-N 함량 1.43%로 나타났으며, 이는 밭 토양 적정 범위 (pH 6.0 - 7.0; EC ≤ 2.00 dS m-1; OM 2.0 - 3.0%; 유효인산 300 - 550 mg kg-1; CEC 10 - 15 cmolc kg-1)에 속하였다. 1999년부터 2011년에 조사한 선행연구 결과와 비교하였을 경우 본 연구에서 조사한 농경지의 화학적 특성은 국내 논토양 및 밭토양의 화학적 특성과 통계적 유의성이 없었다 (Kang et al., 2012; Kim et al., 2019).
주거지 토양의 화학적 특성은 pH 6.23, EC 0.35 dS m-1, 유기물함량 2.53%, 유효 인산 96.2 mg kg-1, CEC 9.0 cmolc kg-1, T-N 함량은 0.72%로 나타났다. pH는 농경지와 통계적인 유의성이 없는 반면 산림 토양에 비해서는 통계적으로 유의하게 높았으며 정화토에 비해서는 통계적으로 유의하게 낮았다 (Fig. 3). 선행연구와 비교하였을 경우 주거지 토양의 pH는 토지 이용에 따라 5.4 - 6.4의 범위를 나타내며 공원의 경우 다른 토지 이용에 비해 pH값이 높은 것으로 보고 되었다 (Kong and Cho, 2000; Pouyat et al., 2007). 일반적으로 거주지에서 건축물의 시멘트와 동절기 제설제로 쓰이는 염화칼슘에 의해 주변 지역보다 pH가 높을 수 있다 (Gilbert, 1989; Jim, 1998). 본 연구의 주거지 토양 시료 채취의 경우 85%가 공원이며, 선행 연구의 토양 pH와 비교하였을 경우 비슷한 수준을 나타내었다. 주거지 토양의 유기물 함량은 산림 토양과 농경지 토양에 비해서는 통계적으로 유의하게 낮았다. 산림 토양과 농경지 토양의 경우 낙엽에 의한 부식토와 퇴비 공급에 의한 주기적인 유기물이 공급되는 반면 주거지의 경우 별도의 유기물 공급이 없으며, 인간의 교란 활동으로 인해 유기물이 제거되어 산림이나 농경지 토양에 비해 유기물 함량이 낮은 것으로 판단된다.
국내 중금속 오염 농경지 복원사례에서는 중금속 오염 농경지에 대한 복원방법으로 토양개량제를 활용한 안정화 공법 및 양질의 토양을 객 (복)토하는 토양개량 공법을 사용하고 있다 (Kim et al., 2012; Oh et al., 2012). 주로 복토, 환토, 객토 공법을 적용하고 보완적으로 안정화공법을 적용하고 있다 (Hwang et al., 2017). 본 연구에서 채취한 정화토 시료도 두 가지 방법을 혼합하여 복원한 지역으로 안정화 (석회) 처리 후 객 (복)토이거나 복토, 환토로 복원한 지역이다. 이로 인해 정화토에서 일반농경지보다 CEC값이 높은 원인은 안정화제로 사용한 석회에서 기인한 것으로 판단된다. Yun et al. (2010)의 연구에 의하면 무처리보다 석회처리구에서 CEC 값이 높았으며 이는 토양의 pH 상승에도 기인한 것으로 보고되었다.
토지 이용별 생물학적 특성
토양 호흡의 경우 산림 토양에서 71.0 CO2 mg kg-1day-1로 다른 토지 이용의 토양 호흡량보다 통계적으로 유의하게 높았으며, 농경지 (56.1 CO2 mg kg-1day-1), 주거지 (75.2 CO2 mg kg-1day-1), 정화토 (45.9 CO2 mg kg-1day-1)간에는 유의미한 차이를 보이진 않았다 (Fig. 4-a). 국내외 주거지 토양의 토양 호흡 측정 연구는 밀폐상법을 기초로 하여 이산화탄소 방출량 측정하는 적외선 가스분석기로 측정하는 방식으로 이루어진다 (Chen et al., 2013; Kim et al., 2014; Ye et al., 2018; Lee et al., 2020). 이로 인해 적정법을 활용한 본 연구 결과와 비교 평가하기 어려우나, Han et al. (2014)이 실시한 주거지 내 녹지 지역의 토양 호흡량이 무등산, 지리산, 월악산 소나무림의 토양 호흡과 비교하였을 때 차이가 나지 않는 연구 결과를 통해 본 연구 결과에서도 주거지 토양의 토양 호흡이 농경지와 농업활동이 이루어지고 있는 정화토와 차이가 없는 것으로 판단된다.
토양 효소 중 ASF 분석 결과 (Fig. 4-b) 산림토양에서 1,965.6 µg PNP g-1로 농경지, 거주지보다 통계적으로 유의미하게 높게 나타났으며, 정화토 1,857.6 µg PNP g-1, 농경지 1,202.7 µg PNP g-1, 주거지 1,227.0 µg PNP g-1 순으로 측정되었으며, 통계적으로 유의미한 차이는 나타나지 않았다. ASF는 토양에서 에스테르 황산염의 무기화에 관여한다고 알려져 있다 (Spencer, 1958; Weaver et al., 1994). 토양 내 황은 pH 3.0에서 황산염이 흡착될 때까지 pH가 감소함에 따라 황의 함량이 증가하는 것으로 보고되었다 (Scott, 1976). 이를 통해 산림 토양의 pH의 경우 5.59로 다른 토지 이용별 토양의 pH보다 유의적으로 낮게 측정된 것으로 인해 산림 토양 내 ASF 활성이 높게 나타난 것으로 판단된다. ASF의 활성의 경우 여름 기간 동안 농업 토양에서 활성이 감소하며 (Cooper, 1972; Castellano and Dick, 1990), Deng and Tabatabai (1997) 연구에서 유기 탄소 함량의 감소로 인해 활성이 감소된다고 보고 된 바 있다. 이러한 이유로 농경지, 주거지, 정화토의 토양 유기물 함량이 산림토양보다 낮으며, 농경지 및 주거지 토양의 시료 중 지표면에 직사광선이 직접으로 닿아 지면 온도가 증가하여 활성이 낮은 것으로 판단된다.
DHA 활성 분석 결과 (Fig. 4-c) 산림 36.0 > 주거지 30.9 > 농경지 23.3 > 정화토 11.9 µg TPF g-1 순으로 평가되었다. Skujinš (1967)는 오래 전에 DHA 활성이 항상 미생물 활성과 관련이 있다는 것은 아니라고 보고한 바 있으며, Howard (1972) 또한 산소 소비가 DHA와 밀접한 관련이 없다고 보고 된 바 있다. 그러나 DHA는 토양 유기물 산화의 초기단계에서 필수적인 역할을 하며 (Ross, 1971), 최근 연구 결과에서도 DHA는 토양 호흡 활동과 관련이 있어 미생물 산화 활성의 지표로 간주된다고 보고되었다 (Kumar et al., 2013; Nannipieri et al., 2018). 따라서 토양 호흡 분석 결과 산림을 제외하고 통계적으로 유의한 차이는 없으나, 평균 값이 산림 > 주거지 > 농경지 > 정화토 순으로 측정되었으며, 이로 인한 차이로 DHA 측정 결과도 비슷한 경향을 나타낸 것으로 판단된다.
GLU 활성 분석결과 (Fig. 4-d) 산림 483.5 > 농경지 403.8 > 주거지 315.7 > 정화토 292.8 µg PNP g-1 순으로 평가되었으며, 통계적으로 유의한 차이가 나타났다. β-glucosidase는 lycosidases 중 α-glucosidase 와 α-, β-galactosidase 와 같이 토양에 널리 분포되어 있는 효소로써, β-glucosidase는 maltose와 cellobiose를 가수분해 시키며, 토양질 지표로 가장 많이 사용되고 있다 (Bandick and Dick, 1999; Utobo and Tewari, 2015; Chae et al., 2017). 여러 연구에서 토양 깊이에 따른 GLU 활성 감소가 있는 것으로 보고 되었으나, 이는 기질 공급에 크게 의존하며 효소를 생산하는 미생물이 주로 표토에서 활동하기 때문으로 인한 것으로 보고되었다 (Acosta-Martínez et al., 2003; Xiao-Chang and Qin, 2006). 하지만 본 연구는 시료 채취 시 표토 (0 - 15 cm)를 채취하여 GLU 활성 차이가 깊이에 따른 활성 감소는 아닌 것으로 사료된다. GLU 활성은 토양 pH가 증가함에 따라 감소하는 것으로 알려져 있으며 (Eivazi and Tabatabai, 1990; Xiao-Chang and Qin, 2006), pH 분석 결과 정화토 (6.64) > 주거지 (6.23) > 농경지 (6.20) > 산림 (5.59) 순으로 pH 차이로 인해 산림토양에서 GLU 활성이 통계적으로 유의하게 높게 나타난 것으로 판단된다.
PHA 의 분석결과 평균값이 산림 (2607.1) > 농경지 (1969.6) > 주거지 (1956.3) > 정화토 (1447.5 µg PNP g-1) 순으로 평가되었다 (Fig. 4-e). PHA는 토양 내 인산의 에스테르 및 무수물의 가수분해를 촉매하는 효소로 인 (P) 순환에 중요한 역할을 하며, 특히 식물과 미생물에 인 (P) 공급원으로써 역할을 한다 (Condron et al., 2005; Turner and Wright, 2014; Yokoyama et al., 2017). PHA의 경우 토양 내 양분이 제한될 때 인 (P)의 가용량을 증가시키기 위해 활성이 증가하며, 유기물 함량이 적은 토양에서 효소의 활성이 증가하였다 (Piotrowska-Dlugosz and Wilczewski, 2014; Bautista-Cruz and Ortiz-Hernanadez, 2015). 그러나 본 연구 결과에서는 유기물, 유효 인산 및 T-N 함량이 증가할수록 PHA 활성의 증가하는 것으로 나타났으나, 토양 pH가 정화토 (6.64) > 주거지 (6.23) > 농경지 (6.20) > 산림 (5.59) 순으로 Dick et al. (2000)에 따르면 토양 효소 활성은 pH에 민감하게 반응하기 때문에 PHA 활성 차이는 토양 pH에 기인한 것으로 판단된다.
URE는 산림과 농경지가 각각 평균 138.2, 121.4 µg NH4-N g-1 2h-1로 통계적으로 차이가 없었으나, 주거지, 정화토에 보다 높게 나타났으며, 주거지 평균 91.9 µg NH4-N g-1 2h-1로 정화토 (96.5 µg NH4-N g-1 2h-1)보다 통계적으로 높게 나타났다 (Fig. 4-f). Blonska et al. (2017)이 실시한 산림, 경작지, 목초지에 따른 효소 활성 비교 결과 URE의 경우 산림에서 높은 활성도를 보였으며, 이는 나무의 작은 뿌리와 관련된 균근이 세포 외 효소를 배출하고 효소 활성을 증가시키는 것으로 보고되었다 (Colpaert and Laere, 1996). Yang et al. (2006)은 Cd, Zn, Pb이 URE 활성에 미치는 영향에 대한 연구 결과에 따르면, 중금속 농도에 대한 URE 활성의 높은 민감성이 보고 된 바 있다. 따라서, 본 연구에서도 중금속 오염 농경지를 복원한 정화토에서 URE 활성이 낮은 것으로 판단된다.
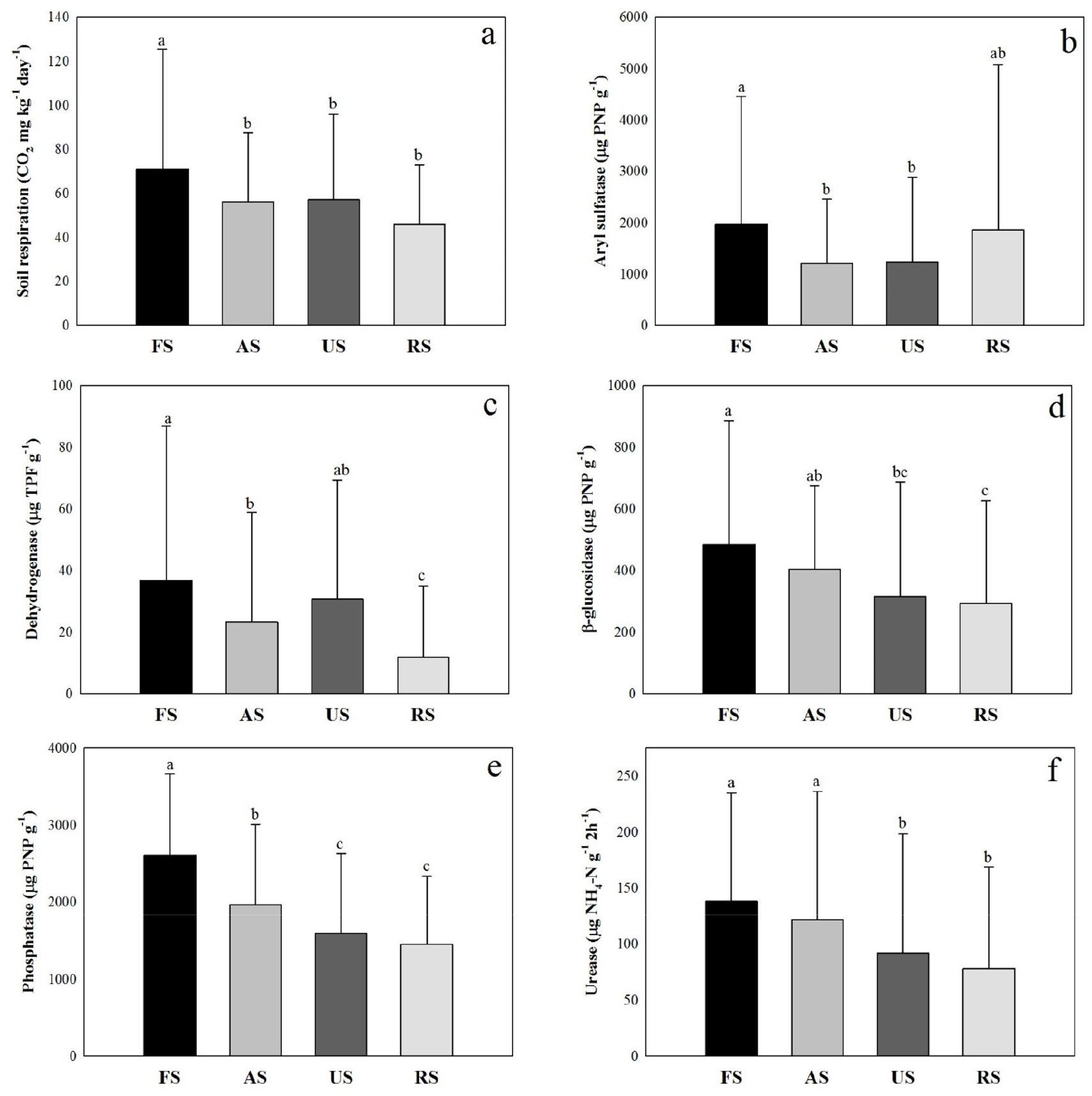
Fig. 4
Result of soil biological properties depending on varied land use. Different superscripts indicate significant differences at p < 0.05 (FS, forest soil; AS, agricultural soil; US, urban soil; RS, remediated soil; a, soil respiration; b, arylsulfatase; c, dehydrogenase; d, beta-glucosidase; e, phosphatase; f, urease).
토지 이용별 생물학적 특성 분석 결과 산림 토양의 호흡 및 5가지 효소 활성에서 다른 토지 이용별 토양보다 통계적으로 유의하게 높게 나타났으며, 생물학적 특성 전체적으로 산림 > 농경지 > 주거지 > 정화토 순의 경향을 보였다. 이는 토양 효소 활성에 관여하는 다양한 요인이 있으나, ASF, DHA, GLU, PHA, URE 효소 모두 유기물 함량과 밀접한 관련이 있는 것으로 보고되었으며 (Mohammadi, 2011; Kumar et al., 2013; Adetunji et al., 2017; Mori et al., 2020), 유기물 함량이 산림 > 농경지 > 주거지 > 정화토 순으로 높게 측정된 것과 관련이 있다고 판단된다.
화학적, 생물학적 특성 상관관계
토지 이용별 (산림, 농경지, 주거지, 정화토) 화학적 및 생물학적 특성에 대해 상관관계를 Table 1에 정리하였다. 토양 호흡의 경우 EC, 유기물 함량, CEC, T-N가 각각 0.191, 0.457, 0.320, 0.413 (p < 0.01)로 양의 상관관계를 나타냈으며, pH, 유효인산은 명확한 상관관계 나타나지 않았다. ARS와 DHA 의 경우 유효 인산이 각각 -0.107 (p < 0.05), -0.138 (p < 0.01)로 음의 상관관계를 나타냈으며, PHA는 pH가 -0.273 (p < 0.05)로 음의 상관관계로 나타났다. Tan et al. (2008)에 의해 산림토양의 경우 pH와 PHA간의 음의 상관관계가 나타나는 것으로 보고 된 바 있어 본 연구에서도 산림토양 영향인 것으로 판단된다. 모든 생물학적 특성에서 유기물, CEC, T-N과의 상관관계는 양의 상관관계를 나타냈다 (p < 0.01). pH는 DHA, GLU, URE, EC는 ARS, DHA, 유효인산은 GLU의 활성과 명확한 상관관계가 나타나지 않았다.
Table 1.
Correlation between chemical and biological properties of soil examined in this study.
Conclusion
토지이용에 따른 토양의 특성을 파악하기 위해 산림, 농경지, 주거지, 정화토 네 지역으로 나누어 샘플 채취 후 화학적, 생물학적 특성을 분석하여 비교 평가하였다. 화학적 분석 결과 평균값의 대해 pH의 경우 정화토 > 주거지 > 농경지 > 산림 순으로 나타났으며, 유기물의 경우 산림 > 농경지 > 주거지 > 정화토 순으로 나타났다. 유효인산은 농경지 > 정화토 > 산림 > 주거지 순으로 나타났으며, T-N 함량은 농경지 > 산림 > 정화토 > 주거지 순으로 평가되었으며, 정화토의 경우 시료 채취 장소가 농경지로 활용되고 있어 산림, 주거지보다 높은 유효인산 함량을 보인 것으로 판단된다. 생물학적 특성 분석 결과 산림 토양에서 토양 호흡 및 5가지 효소 활성이 다른 토지이용별 토양보다 통계적으로 유의하게 높게 나타났으며, 결과가 전체적으로 산림 > 농경지 > 주거지 > 정화토 순의 경향을 보였다. 이는 토양 효소 활성에 관여하는 다양한 요인이 있으나, ASF, DHA, GLU, PHA, URE 효소 모두 유기물 함량과 밀접한 관련이 있는 것으로 보고되었으며 유기물 함량이 산림 > 농경지 > 주거지 > 정화토 순으로 높게 측정된 것과 관련이 있다고 판단된다. 화학적, 생물학적 특성 간의 상관관계 분석 결과 유기물 함량과 T-N은 토양 호흡 및 5가지 효소 활성에 대해 양의 상관관계를 나타냈으며, 이는 토양 호흡은 미생물 호흡에 인한 것이며, 효소의 경우 다양한 요인 중에서 양분에 의한 영향도 있기 때문에 나타난 결과라고 사료된다. 본 연구 결과를 통해서 토지이용에 따른 토양의 화학적, 생물학적 특성을 파악하였으며, 이를 통해 토지이용에 따른 토양 건강성을 평가 및 기초자료로 활용될 수 있을 것으로 판단된다.