Introduction
Materials and Methods
연구 지역 및 시료 채취
토양 정화 방법
토양 이화학성 분석
토양 효소 활성 분석
통계 분석
Results and Discussion
토양 이화학성 분석 결과
토양 효소 활성 분석 결과
Conclusions
Introduction
석유는 현대 사회의 산업 발전에 있어서 인류에게 가장 중요한 원료로 사용되어왔다. 하지만 석유의 유출로 인한 토양 오염은 전 세계적으로 우려되는 문제이다 (Nadim et al., 2000). 토양으로 유입된 가솔린이나 디젤과 같은 석유계 탄화수소는 토양 심층부 및 지하수층까지 분포하면서 토양과 지하수를 오염시키며 이는 농업 생태계 파괴 및 생산성 감소로 이어질 수 있다 (Jung, 2003; Nwankwegu and Onwosi, 2017). 이에 현재 유류로 인해 오염된 토양 정화를 위해 토양 세척 (soil washing), 열탈착 (thermal desorption), 토양 증기 추출 (soil vapor extraction), 토양 경작 (landfarming), 바이오 파일 (biopiles), 식물정화 (phytoremediation) 같은 다양한 이화학적 및 생물학적 정화 방법이 이용되어지고 있다 (Khan et al., 2004; O’Brien et al., 2017). 특히 토양 세척과 토양 경작법은 공정이 단순하고 높은 비용효율성 (cost-effective)으로 석유계 탄화수소로 오염된 토양의 정화법으로 널리 이용되어지고 있다 (Mann, 1999; Besalatpour et al., 2011).
이처럼 토양 세척 및 토양 경작 과정의 오염 물질 제거 효율 및 토양 특성의 변화에 대한 많은 연구가 수행되었지만 이는 주로 정화 토양의 이화학적 특성 변화 등에 대한 연구가 대부분이며, 토양 효소 활성과 같은 생물학적 변화 특성에 대한 연구는 부족한 실정이다. 토양 효소는 토양 내 생화학적 반응을 촉진시키며, 토양 내 질소 (N), 인 (P), 황 (S)과 같은 영양분의 순환에 매우 중요한 역할을 한다 (Bandick and Dick, 1999). 또한 토양 효소 활성은 토양질의 생물학적 및 생화학적 지표로써 널리 이용되어지고 있다 (Dick, 1994; Alkorta et al., 2003).
본 연구의 목적은 토양의 이화학적 특성 분석뿐만 아니라 토양 효소 활성 측정을 통해 TPH로 오염된 토양 및 정화 토양에서 종합적인 토양 특성의 변화를 파악하는 데 있다.
Materials and Methods
연구 지역 및 시료 채취
본 연구를 위해 유류 오염 정화 사업이 진행되고 있는 경기도 동두천시 소재 군부대 지역에서 수행되었다. 이 지역의 정화 방법으로는 토양 세척과 토양 경작 방법이 적용되었으며, 토양 시료는 TPH로 오염되어 있지 않은 대조구 토양 (control), TPH 오염 토양 (contaminated soil, CS)과, 토양 세척 (soil washing, SW) 및 토양 경작 (landfarming, LF) 등의 총 4종류의 그룹을 선정하였으며, 동일한 시료를 2021년 4월과 7월 2번 채취하였다. 대조구 (control)는 군부대에서 2.0 km 이상 떨어진 TPH로 오염되지 않은 지역에서 채취하였으며, CS는 정화 과정에 들어가기 전 오염된 토양을 SW는 토양 세척 이후의 슬러지를 채취하였으며, LF는 토양 경작 과정이 끝난 정화된 토양을 채취하였다. 수집된 토양은 풍건 후 2 mm 표준체로 거른 뒤 토양 화학성 분석에 사용하였으며, 토양 효소 활성 분석에는 습토를 2 mm 표준체로 거른 뒤 사용하였다.
토양 정화 방법
본 연구 지역의 토양 세척 용량은 25 m3 h-1이며 공정 단계는 건식 선별, 습식 선별, 미세토 분급, 세척 폐수 처리, 슬러지 탈수의 5개 단계로 구성되어 있다. 오염 물질의 탈착을 거친 후 최종적으로 입자 직경 0.075 mm 미만의 미세토는 하이드로싸이클론 (hydrocyclone)으로 분리되었으며, 세척 폐수는 처리 후 재순환 되었다. 토양 경작 과정은 오염 토양에 미생물 제제와 영양분 및 수분을 투입하여 토양 미생물의 호기성 생분해를 촉진시켜 TPH를 저감 시켰으며, 경작 주기는 주 2회로, 오염 토양 내 목표 미생물 수는 1 × 106 CFU g-1로 하였다. 또한 미생물 제제는 컨소시엄사 자체 생산 미생물을 이용하였으며, 경작 과정에서 양분, 수분 및 미생물 제제 살포의 효율을 높이기 위해 주 2회 채바가지 장착 굴삭기를 이용한 선별 경운과 스테빌라이저 장착 굴삭기를 이용한 파쇄 경운을 실시하였다.
토양 이화학성 분석
토성 (soil texture) 분석은 비중계법을 이용하여 토양 내 모래와 점토 함량을 계산하였으며, 미국 농무부 (United States Department of Agriculture, USDA)의 토성삼각도표 (soil texture triangle)를 이용하여 토성을 결정하였다. 토양 pH와 전기전도도 (electrical conductivity, EC)는 토양과 초순수의 비를 1:5한 뒤 진탕기를 이용하여 30분간 진탕한 후 각각 pH meter (Orion Star™ A111, Thermo Fisher Scientific, Waltham, MA, USA)와 EC meter (SevenCompact™ Conductivity Meter S230, Mettler Toledo, Columbus, OH, USA)를 이용하여 측정하였다. 토양 유기물 함량 (soil organic matter, SOM)은 Walkley and Black법 (Walkley and Black, 1934)을 이용하여 추출한 뒤 UV spectrophotometer (Uvmini-1240, Shimadzu, Kyoto, Japan)로 정량하였다. 석유계총탄화수소 (total petroleum hydrocarbon, TPH)는 토양오염 공정시험기준 (KSTM ES 07552)에 따라 dichloromethane으로 추출하였으며, GC-FID (gas chromatograph-flame ionization detector, 7890A, Agilent, Santa Clara, CA, USA)를 이용하여 분석하였다.
토양 효소 활성 분석
토양 내 arylsulfatase의 활성도 측정은 Tabatabai and Bremner (1970)의 분석법을 참고하여 수행되었다. 먼저 토양 시료 1.0 g를 centrifuge tube에 담은 뒤 toluene 0.25 mL, 0.5 M acetate buffer (pH 5.8) 4.0 mL, ρ-nitrophenyl sulfate 1.0 mL를 첨가한 뒤 혼합 후 밀봉하여 배양기에서 37°C에서 1시간 동안 배양하였다. 배양 후 centrifuge tube에 1.0 mL의 0.5 M CaCl2와 4.0 mL의 0.5 M NaOH를 가한 뒤 교반 후 여과하였으며 최종적으로 생성되는 ρ-nitrophenol (PNP)의 농도에 대해 UV/Vis Spectrophotometer (Uvmini-1240, Shimadzu, Kyoto, Japan)를 이용하여 400 nm 파장에서 비색 정량 하여 arylsulfatase의 활성도를 측정하였다.
Beta-glucosidase의 활성도를 측정하기 위하여 Eivazi and Tabatabai (1988)의 분석법을 참고하였다. 토양 시료 0.5 g을 centrifuge tube에 담은 뒤, 0.1 mL의 toluene, 1.5 mL의 citric phosphate buffer (pH 4.9)와 0.9 mL의 초순수 및 0.6 mL의 50 mM ρ-nitrophenyl-nitrophenyl-D-glucopyranoside (PNG)를 첨가하였다. 이후 배양기를 이용하여 30°C에서 1시간 배양하였으며, 배양이 완료된 뒤 이후 UV/Vis Spectrophotometer를 이용하여 400 nm 파장에서 비색 정량 하였다.
Urease의 활성도는 Kandeler and Gerber (1988)의 분석법을 참고하였다. 먼저 100 mL 삼각 플라스크에 토양 5.0 g을 넣은 뒤 79.9 mM Urea 2.5 mL를 가하여 37°C에서 2시간 동안 배양하였다. 이후 초순수 2.5 mL, KCl 30.0 mL를 첨가한 뒤 30분간 교반 후 여과하였으며, 여과액 1.0 mL에 초순수 4.0 mL를 첨가하여 희석한 뒤 0.3 M NaOH, sodium salicylate solution 및 초순수를 혼합하여 조제한 시약을 5.0 mL 넣은 후 30분 동안 교반 하여 690 nm 파장에서 비색 정량하였다.
통계 분석
토양 화학성 및 효소 활성 분석 시 모든 실험은 3회 반복 수행하여 평균과 표준편차 값으로 표시하였다. 이때 토양 그룹별 데이터의 비교를 위해 Statistical package for social science (SPSS) version 26.0 (SPSS Inc., Chicago, IL, USA)을 이용하여 일원분산분석 (one-way ANOVA) 및 사후검정 (Duncan’s test, p < 0.05)을 실시하였다.
Results and Discussion
토양 이화학성 분석 결과
토양 그룹별 (control, CS, SW, LF) 화학적 특성을 Table 1에 정리하였다. 토성 분석 결과 4월과 7월 시료 모두 SW는 양질사토 (loamy sand)였으며, 나머지 control, CS, LF는 식양토 (clay loam)로 나타났다. 이러한 결과처럼 토양 내 TPH 오염 및 토양 경작 과정은 토성을 크게 변화시키지 않는 것으로 나타났다. 그러나 SW에서는 미사와 점토 함량은 감소한 반면에 모래 함량은 80.3%까지 증가하였다. 일반적으로 토양 세척 과정에서는 유기 오염 물질이 주로 흡착되어 있는 미세토의 분리 및 침전 과정이 진행되며 (Kuhlman and Greenfield, 1999; Feng et al., 2001), 이 때문에 토양 세척 과정이 완료된 토양인 SW에서 미사 및 점토 함량이 감소한 것으로 판단된다.
Table 1.
The result of physicochemical properties and TPH concentration in four soil groups collected in April and July 2021 (mean ± SD†).
토양 내 TPH 농도 분석 결과 4월 시료가 625.3 mg kg-1, 7월 시료가 4,233.2 mg kg-1으로 7월 토양에서 높은 수준의 TPH 오염을 확인하였다. 이후 토양 세척을 거친 SW에서는 TPH 농도가 4월과 7월 각각 438.2 mg kg-1, 331.7 mg kg-1로, 토양 경작 과정을 거친 LF에서는 4월과 7월 각각 372.2 mg kg-1, 274.1 mg kg-1로 나타나 모든 정화 토양에서 토양환경보전법의 1지역 우려 기준 (500 mg kg-1) 이하 수준의 TPH의 농도를 보였다.
토양 pH는 4월 시료가 7.12 - 8.17의 범위, 7월 시료는 7.01 - 8.41의 범위로 나타났으며, EC는 4월과 7월 각각 0.35 - 0.57 dS m-1, 0.21 - 0.45 dS m-1의 범위로, 유기물 함량은 4월과 7월 각각 6.6 - 13.0 g kg-1, 5.5 - 15.6 g kg-1의 범위로 나타났다. 토양 그룹별로는, TPH 오염 토양인 CS와 비교하였을 때 토양 세척 후 토양 pH는 4월에는 pH 7.29에서 8.17로, 7월은 pH 7.01에서 8.41로 크게 증가하였다. 유류 오염 토양의 토양 세척을 이용한 정화 과정에서는 보통 계면활성제나 산성 또는 알칼리 용액으로 구성된 세척액 (soil washing solution)이 사용되며 (Mao et al., 2015), 선행 연구 결과에서는 이러한 세척액으로 인해 정화 토양에서 화학성의 변화가 나타난다고 보고하였다 (Im et al., 2015). 이처럼 본 연구에서도 SW에서의 pH의 상승은 세척 과정 중 사용된 알칼리 용액으로 인한 것으로 판단된다. 반면에 토양 경작 과정은 토양 pH를 크게 변화시키지 않는 것으로 나타났다. 토양 EC는 그룹 간 큰 차이가 나타나지 않았으며, 모든 토양 시료에서 2 dS m-1 이하로 적정 수준이었다.
토양 유기물 함량의 경우 control, CS, LF에서는 모두 10.0 g kg-1 이상으로 분석되었지만, SW에서는 4월과 7월 각각 6.6 g kg-1, 5.5 g kg-1로 다른 토양 그룹에 비해 낮은 수치를 보였다. 이는 토양 세척 과정에서 유기물이 다량 흡착되어 있는 미세토의 분리 및 침전 과정 때문인 것으로 보이며, An et al. (2020)의 연구에서도 토양 세척 이후 토양 유기물 함량의 감소를 보고하였다.
토양 효소 활성 분석 결과
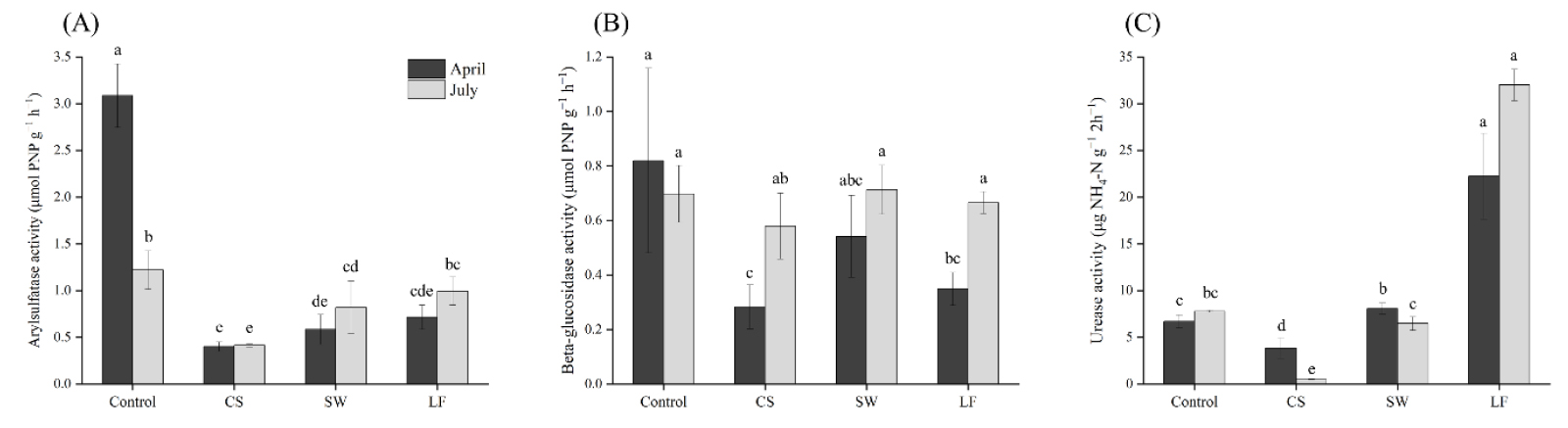
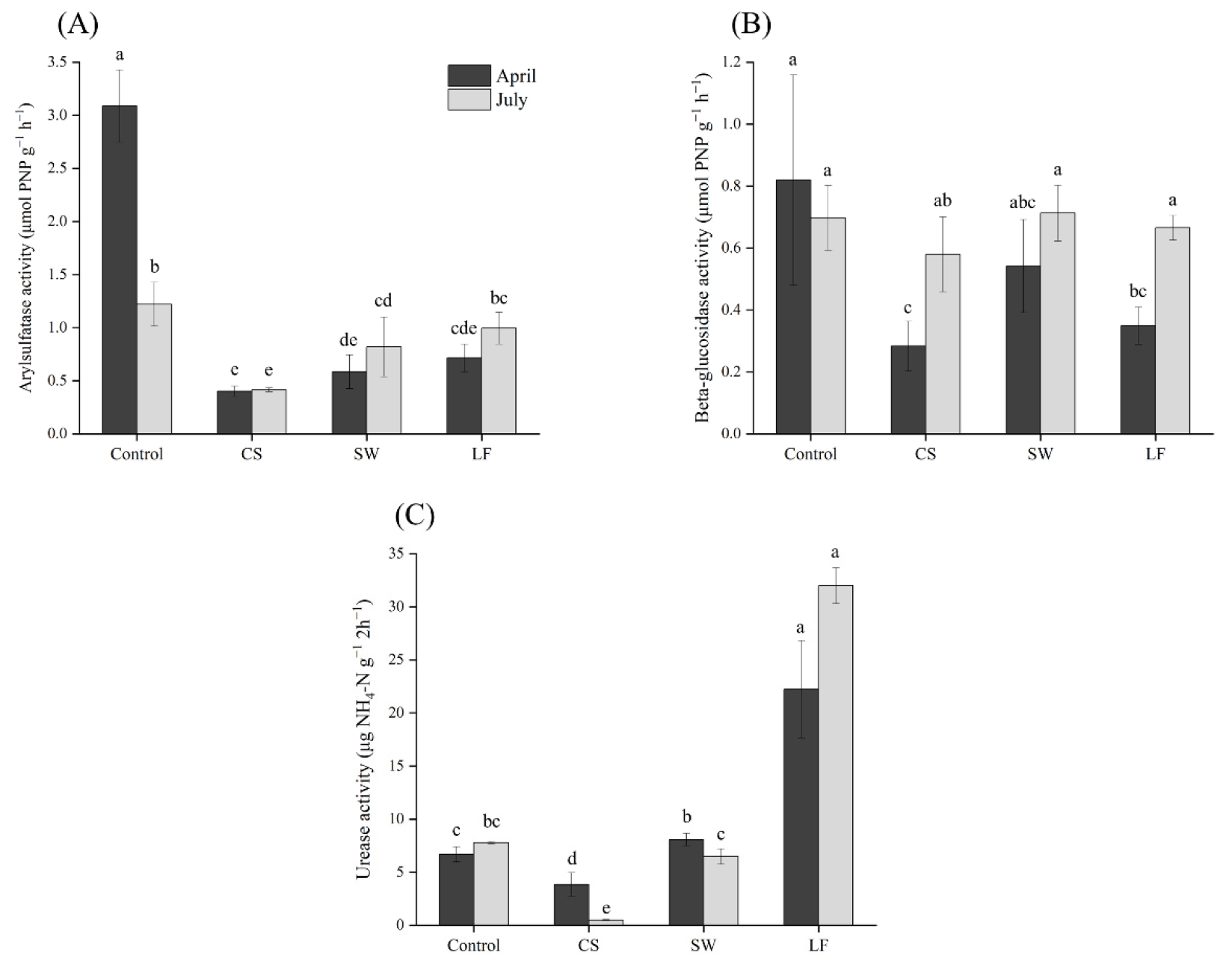
본 연구에서는 토양 내 arylsulfatase, beta-glucosidase, urease의 활성을 분석하였으며 그 결과는 Fig. 1과 같다. 토양 내 황 (S)은 주로 유기 황산염 에스터 (organic sulfate ester)의 형태로 존재하는데, arylsulfatase는 이러한 유기 황의 가수분해를 촉매하는 효소이며, 작물의 황 이용성에 중요한 역할을 한다 (Skujiņš and Burns, 1976; Nannipieri et al., 2002). 본 연구에서의 토양 내 arylsulfatase의 활성은 4월 채취 시료에서 0.40 - 3.09 µmol PNP g-1, 7월 시료에서 0.42 - 1.22 µmol PNP g-1의 범위로 나타났다. 토양 그룹별로는 비 오염토양인 control에서 가장 높게 나타났으며, TPH 오염 토양인 CS에서 가장 낮게 분석되었다. 또한 토양 정화 과정을 거친 이후 토양인 SW와 LF에서는 TPH 오염 토양에 비해 arylsulfatase 활성의 증가를 보였지만, control 수준에는 못 미치는 것으로 나타났다. 토양 내 beta-glucosidase는 일반적으로 식물의 셀룰로스 (cellulose)의 효소적 분해에 관여하며 토양 내 유기물 분해 및 양분 순환에 큰 역할을 한다 (Turner et al., 2002). 4가지 그룹의 토양에서 beta-glucosidase 활성 측정 결과 4월과 7월 시료에서는 각각 0.28 - 0.82 µmol PNP g-1, 0.58 - 0.71 µmol PNP g-1의 범위로 나타났다. Control 토양과 비교하였을 때 CS에서 beta-glucosidase의 활성은 4월과 7월 각각 0.28 µmol PNP g-1, 0.58 µmol PNP g-1로 감소하였다. Dindar et al. (2015)의 연구에서는 유류로 오염된 토양에서 비 오염 토양보다 더 높은 beta-glucosidase 활성을 보였으며, 유류 오염이 beta-glucosidase 활성을 저해시키지 않는다고 보고하였다. 또한 beta-glucosidase 활성도는 SW와 LF에서 큰 차이가 나타나지 않았으며, 이는 토양 정화 공정별로 beta-glucosidase의 활성도 차이가 크지 않다는 Yi et al. (2013)의 연구와 유사하다.
마지막으로 토양 urease 활성의 경우 control에 비해 CS에서 감소하는 경향을 보였으며, 특히 7월 시료에서는 7.79 µg NH4-N g-1 2h-1에서 0.49 µg NH4-N g-1 2h-1까지의 활성도 감소를 나타내었다. Hui et al. (2007)은 토양 내 urease의 활성은 디젤 등과 같은 유류 오염으로 인해 감소될 수 있으며, 이는 urease 활성도를 토양 내 TPH 오염의 생화학적 지표로 이용할 수 있다고 보고하였다. 토양 정화 과정은 urease의 활성도를 증가시키는 것으로 나타났다. 토양 세척을 거친 SW에서는 6.48 - 8.80 µg NH4-N g-1 2h-1의 범위로 나타났으며, 토양 경작을 거친 LF에서는 22.24 - 32.01 µg NH4-N g-1 2h-1 까지의 높은 urease 활성의 증가를 보였다.
Conclusions
본 연구에서는 TPH 오염 토양과 정화 토양에서 이화학적 특성 및 토양 효소 활성의 변화 특성을 평가하고자 하였다. 토성 분석 결과 토양 세척 과정은 토양 내 미사나 점토와 같은 미세토의 함량을 감소시키는 것으로 나타났으며 이는 SW에서 토양 유기물 함량의 감소로 이어졌다. 또한 토양 세척 공정에서 사용된 세척액으로 인해 SW에서 pH의 증가를 보였으며, EC는 토양 그룹 간 큰 차이를 보이지 않았다. 토양 효소 분석 결과 토양 내 TPH는 arylsulfatase, urease의 활성도를 감소시켰으며 beta-glucosidase는 토양 정화 그룹 간 큰 차이를 나타내지 않았다. 또한 토양 정화 과정은 arylsulfatase, urease의 활성도를 증가시켰으며, 특히 미생물을 이용한 토양 경작 과정 이후 urease 활성도의 큰 증가를 보였다. 이러한 결과들로 보았을 때 토양 정화 과정 이후 토양 효소 활성의 측정은 토양의 이화학적 특성과 더불어 종합적인 토양 질 평가를 가능하게 할 것이라고 판단된다.