Introduction
Materials and Methods
킬레이트제의 토양양분 가용화 평가 위한 항온실험
수박재배 포트 실험
토양 및 식물체 분석
통계분석
Results and Discussion
항온조건에서 킬레이트제 처리에 따른 토양의 수용성 양분 변화
포트재배 시 킬레이트제 처리농도별 수박 생육량 및 흡수량 영향
수박 포트재배 시 킬레이트제 처리가 토양유효양분에 미치는 영향
Conclusions
Introduction
시설재배지에 염류집적으로 생육이 부진하거나, 수량이 감소하는 등의 피해가 발생하므로 염류를 경감하는 농업적인 관리방법이 필요하다 (Kim et al., 2012; Kim, 2014). 시설재배지 토양의 화학성 변동을 4년 1주기로 조사한 결과, 토양의 전기전도도 (EC)는 1996년에 2.90 dS m-1이었으나, 24년이 경과된 2020년도에는 4.00 dS m-1로 약 1.4배 상승하였고, 2020년도의 토양 중 유효인산 (Avail. P2O5)은 농촌진흥청에서 추천한 적정범위 (300 - 550 mg kg-1)보다 3배, 교환성 양이온인 칼륨 (K), 칼슘 (Ca), 마그네슘 (Mg) 함량은 적정범위 (K 0.50 - 0.80 cmolc kg-1; Ca 5.0 - 6.0 cmolc kg-1; Mg 1.5 - 2.0 cmolc kg-1) 보다 2배까지 증가한 것으로 나타났다 (NAS, 2021). 이것은 시설재배지에서 과다한 비료의 투입으로 (Lee et al., 2020; Cho et al., 2021) 염류가 되어 토양 전기전도도를 증가시키고, 양이온간에 불균형을 심화시키고 있다. 특히 시설수박 재배지에도 농진청에서 추천하는 염류농도 (2 dS m-1)보다 2배 (4.4 dS m-1) 높아 생육피해가 발생하고 있다.
그 동안에 시설재배지의 염류집적 문제를 해결할 수 있는 방안으로, 객토, 담수제염 (Oh et al., 2010), 심토반전 (Jun et al., 2002), 녹비작물 재배 (Yang et al., 2011), 미생물제 투입 (Lee et al., 1996), 바이오차 투입 (Heo et al., 2021; Kim et al., 2022), 윤작 (Kim et al., 2021) 등의 다양한 기술이 개발되었다. 그리고 시설재배지에 작물의 염류장해를 해결하는 방법으로 토양 중 양이온과 킬레이트 결합하여 작물이 잘 흡수할 수 있도록 도와주는 킬레이트제의 활용 기술이 개발되었다 (Kim et al., 2013; Lee et al., 2019). 킬레이트제란 금속 이온과 2자리 이상으로 배위결합을 하여 고리구조의 모양을 만드는 리간드로 (Tuntiwiwut, 1982), 인간이 인위적으로 만든 합성킬레이트제와 자연상태에서 존재하는 천연킬레이트제가 있다 (Brady and Weil, 2008). 합성 킬레이트는 50년 이상 동안 토양과 수경재배에서 미량 영양소를 식물에 공급하는 데 사용되었다 (Neugschandtner et al., 2017). 철에 킬레이트제를 결합한 비료 (예: Na2FeEDTA)는 일반적으로 원예에서 잎 시비에 사용되었다 (Bergmann, 1993).
합성 킬레이트제로 Diethylenetriamine pentaacetic acid (DTPA), Ethylene diamine disuccininc acid (EDDS), N-(2-hydroxyethyl)-ethylene diaminetriacetic acid (HEDTA), Ethylenediaminetriacetic acid (EDTA) 등이 있다. 이 중에서 DTPA는 토양의 미량원소 분석할 때 추출하는 시약으로 사용되고 있다 (Lindsay and Norvell, 1978). Fe-DTPA는 알칼리성 토양에서 작물로의 미량원소 공급을 높이며 (Weinstein et al., 1954; Tuntiwiwut, 1982), pH 높은 양액재배에서 미량영양소의 침전을 예방할 목적으로 활용하였다 (Lee et al., 2011). 농촌진흥청에서는 염류집적지에서 염류저감기술의 하나로 DTPA를 이용한 영농기술을 개발하여 (Kim et al., 2012) 2018년부터 2021년까지 농업기술센터에 기술을 보급하였다. Lee et al. (2019)은 영양염류 중 Ca2+의 비율이 높은 염류 토양에서 DTPA는 Ca2+에 비해 유효도가 낮은 양분들의 식물 이용성을 증가시킴으로써 양분 흡수 불균형을 해소하였고 수박의 생육 및 당도를 증가시켰다고 발표하였다. EDDS는 aminopolycarboxylates의 일종으로, 많은 미생물에 의해 자연적으로 생성하는 물질로 알려져 있다 (Nishikiori et al., 1984; Goodfellow et al., 1997; Meers et al., 2004). Schowanek et al. (1997)에 따르면, EDDS는 토양 배양실험에서 2.5일부터 4.6일 사이에 반감되었고, 토양개량제로써 중금속과 킬레이트 결합하는 능력의 활성 기간이 짧았는데, 이는 미생물에 의해 빨리 생분해되기 때문이라고 하였다. HEDTA는 토양 중의 중금속과 결합하여 식물체로의 중금속 흡수량을 높이는 기능이 있어서 (Meers et al., 2004), 중금속으로 오염된 농경지에서 작물로의 중금속을 흡수시켜 토양으로부터 중금속을 제거 (phytoremediation)하는 연구에 사용되었다 (Chen and Cutright, 2001). 이처럼 국외에서는 DTPA는 미량원소 분석법의 추출시약, 작물에 미량원소 공급원으로 이용하였고, HEDTA, EDDS와 같은 킬레이트제는 중금속 오염된 농경지를 정화하는 데 주로 연구되었다. 국내에서는 염류집적지에 DTPA를 투입하여 염류감소 등의 토양특성 변화와 작물 생육반응을 평가한 연구가 이루어졌으나, HEDTA와 EDDS는 이에 비해 연구가 부족하다.
시설수박 재배지에도 농진청에서 추천하는 염류농도 (2 dSm-1)보다 2배 (4.4 dS m-1) 높아 생육피해가 발생하고 있는 문제를 효과적으로 해결하는 것이 필요하다. 따라서, 본 연구에서는 기존에 개발된 킬레이트제인 DTPA를 포함하여 HEDTA, EDDS를 염류농도가 높은 토양에 처리하여 수박의 생육특성과 토양의 화학성에 미치는 영향을 평가하였다.
Materials and Methods
킬레이트제의 토양양분 가용화 평가 위한 항온실험
작물이 주로 흡수하는 형태인 수용성 양분을 킬레이트제별로 가용화되는 정도를 평가하기 위해 실시하였다. 공시토양은 2021년에 경기도 평택시에 위치한 시설토마토 재배 농가에서 채취하였다. pH는 6.6으로 농촌진흥청에서 추천하는 수박 생육의 적정 기준 (6.0 - 6.5)의 상한치 (NAS, 2019) 부근에 있었고, 전기전도도 (electrical conductivity, EC)는 12.7 dS m-1, 유기물 (organic matter, OM) 함량은 55 g kg-1, 유효인산 (available P2O5, Av. P2O5) 함량은 1,192 mg kg-1, 교환성 칼륨 (exchangeable K, Ex. K) 함량은 4.6 cmolc kg-1, 질산태질소 (NO3-N) 함량은 585 mg kg-1으로, 적정 기준의 상한치보다 1.8 - 6.4배 높은 수치로서, 비료로 투입한 성분이 토양 염류로 많이 축적되어 있었다 (Table 1). 처리구는 공시토양에 증류수만 처리한 대조구, 실험용 bottle 용기 (125 mL)에 토양 50 g을 넣고 킬레이트제를 각각 1 mM씩 섞은 후에 증류수를 넣어 킬레이트제와 토양이 반응하도록 하였고 (DTPA 1 mM, HEDTA 1 mM, EDDS 1 mM), 3반복으로 처리하였다. 이것을 항온기에 넣고 온도를 25°C로 유지하면서 70일 동안 배양한 후 pH, 전기전도도, 수용성 양분 (NO3-N, P, K, Ca, Mg, Fe)을 분석하였다.
Table 1.
Chemical properties of soils used in incubation experiment.
수박재배 포트 실험
킬레이트제 종류별로 수박생육과 토양 유효 양분에 미치는 영향을 평가하기 위해 포트규모의 재배시험을 실시하였다. 항온실험에 사용한 것과 동일한 농가의 토양을 이용하였고, 처리구는 물만 넣은 처리구 (no treat.), 표준시비량을 투입한 처리구 (N-P2O5-K2O = 138-49-87 kg ha-1), 킬레이트제 를 각각 0.5, 1, 5 mM로 처리한 구 (DTPA, HEDTA, EDDS)가 있다. 모두 11개 처리구를 두었고, 3반복으로 실험하였다. 시험구 배치는 완전임의배치법으로, 비가림 하우스에서 1/2000a 포트에 토양 4 kg을 넣고 킬레이트제와 혼합하였다. 1주일 후 (6월 28일)에 수박을 정식하였고, 정식 후 74일째 (8월 23일)에 수확하였으며. 토양은 킬레이트제를 처리하기 전에 토양과 수박을 수확할 시점에 토양을 채취하였다.
토양 및 식물체 분석
토양은 음지에서 자연 건조시킨 후 2 mm 체를 통과시켜 농촌진흥청 토양 및 식물체 분석법 (NIAST, 2000)과 토양화학분석법 (NAAS, 2010)에 따라 분석하였다. pH와 전기전도도는 토양과 증류수의 비율을 1:5로 혼합하여 30분간 진탕한 후에 pH와 전기전도도를 겸용해서 측정하는 기기 (Orion 5 star, ThermoFisher Scientific, USA)로 측정하였고, 전기전도도는 측정수치에 5를 곱하여 사용하였다. 토양유기물은 Tyurin법, 유효인산은 Lancaster법으로 720 nm에서 분광광도계 (U-3000, Hitachi, Japan), 질산태질소는 2 M KCl로 추출한 후 자동이온분석기 (QuAAtro, Bran+Luebbe, Germany)로 측정하였다. 교환성 양이온은 1 M NH4OAc (pH 7.0) 완충용액으로 추출하여 유도결합 플라즈마 발광광도계 (ICP-OES, GBC, Australia)으로 측정하였다. 항온조건에서 실험한 토양의 pH와 EC는 앞에서 제시한 동일한 방법으로 측정하였고, 수용성 성분인 PO43-, K+, Ca2+, Mg2+, Fe3+를 유도결합 플라즈마 발광광도계로 분석하였다. 수박 식물체 분석은 건조 후 분쇄한 시료를 0.5 g 칭량하고 P, K, Ca, Mg, Fe은 conc. H2SO4을 10 mL와 50%의 HClO4 10 mL를 가하여 분해 후 여과하여 P는 vanadate 발색방법으로, K, Ca, Mg, Fe은 유도결합 플라즈마 발광광도계로 측정하였다. T-N은 원소분석기 (Vario MAX CNS, Germany)를 이용하여 표준시료와 함께 900°C에서 측정하여 질소함량을 분석하였다.
통계분석
SAS 프로그램 (ver 9.4, SAS Institute, USA)으로 ANOVA 분석과 Duncan의 다중검정을 킬레이트제 수준별로 수박생육과 토양에 처리한 효과를 비교하였다.
Results and Discussion
항온조건에서 킬레이트제 처리에 따른 토양의 수용성 양분 변화
pH, K+ 및 Fe3+은 대조구보다 모든 킬레이트제 처리구 (DTPA, HEDTA, EDDS를 각각 1 mM로 투입)에서 모두 증가한 반면, 질산태질소, PO43-, Ca2+ 및 Mg2+ 농도는 감소하였다 (Table 2). 킬레이트제를 토양에 투입하면 토양의 수용성 양분 농도가 높아진다고 하였고 (Neugschandtner et al., 2017), Kim et al. (2012)도 유기물 함량 22 - 28 g kg-1인 토양에 DTPA 300 mM을 투입 후 25일간 항온 배양 시, 증류수 처리구 대비 수용성 양이온 (K, Ca, Fe), 음이온 (P)의 함량은 높았다고 하여 본 연구결과와는 달랐다. 또한 미생물제의 분해는 킬레이트제의 농도 (Meers et al., 2005)와 반응시간, 환경조건에 따라 미생물의 분해하는 정도가 다르다 (Means et al., 1980). 본 연구에서 토양의 일부 수용성 양분 농도가 낮은 이유는 투입농도 (1 mM)가 낮고, 토양과의 반응시간 (70일)이 길었기 때문에 미생물이 킬레이트제를 분해하는 비율이 높았으며, 더군다나 토양유기물 함량이 많아 미생물의 번성정도가 커서 (Peacock et al., 2001; Suh et al., 2010), 수용성 양분을 영양원으로 소모하였기 때문이라 추정한다. 수용성 Fe3+의 함량이 다른 이온보다 많이 증가하였는데 (89 - 95%), Fe은 킬레이트제와 안정화상수 (log KFe-DTPA = 29.19)가 다른 원소 (log KCa-DTPA = 10.61)보다 크기 때문이라고 하였다 (Lindsay and Norvell, 1969).
Table 2.
Chemical characteristic of salt-accumulated soil after applying distilled water, DTPA, HEDTA, and EDDS.
포트재배 시 킬레이트제 처리농도별 수박 생육량 및 흡수량 영향
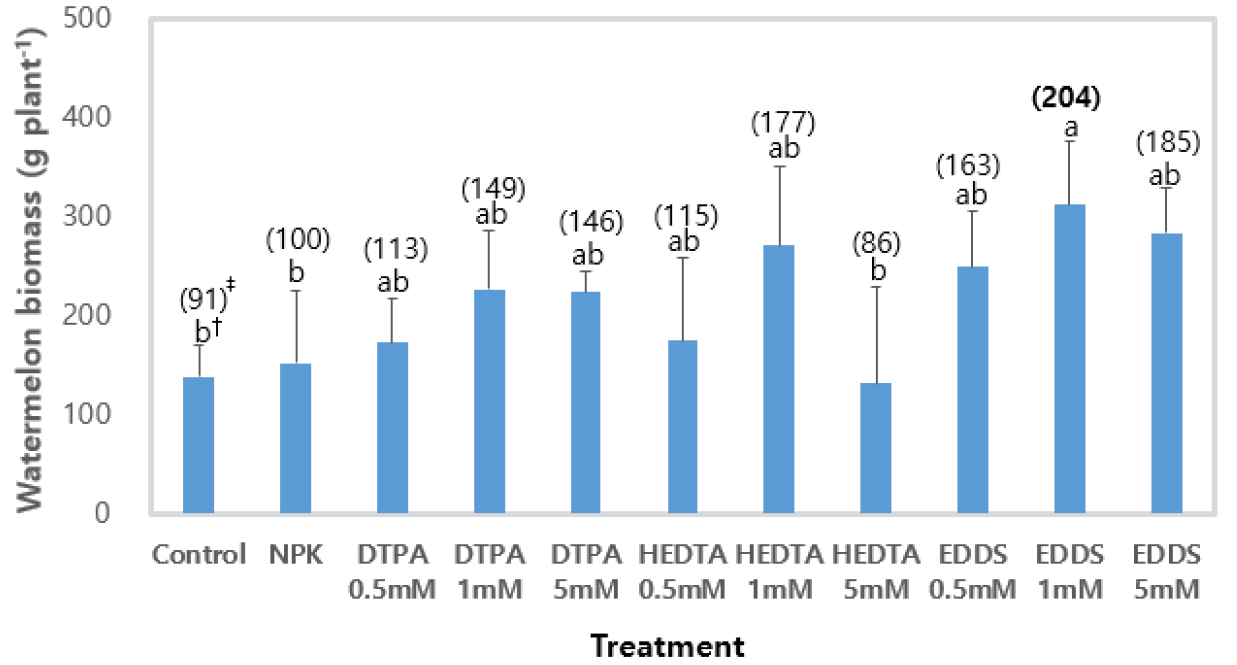
수박 생중량은 NPK 처리구를 기준으로 EDDS 1 mM 처리구는 104%, EDDS 5 mM에서 85%, EDDS 0.5 mM은 63% 증가하였다 (Fig. 1). HEDTA 1 mM 처리에서 77% 증가되었지만, HEDTA 5 mM 처리구에서는 오히려 14% 감소하였고 황화증상이 나타났다. DTPA 1 mM에서 생육량은 49% 증가하였다. DTPA 처리할 경우에 작물의 종류, 시험규모 (포트, 포장실험)에 따라 차이가 있었다. Lee et al. (2019)의 포장시험 결과에 따르면, DTPA 0.6 kg 10a-1로 처리하였을 때 대조구 (무처리구)에 비해 수박의 줄기, 잎, 과실의 생육이 유의적으로 증가하였으며, 특히 과실의 중량이 7.7% 증가하였다. 포트조건에서 배추의 수량이 대조구 (무처리구)와 통계적으로 유의한 차이는 보였다고 하였고 (Kim et al., 2012), 포장 조건에서는 DTPA 0.06 mM 처리시 대조구 (무처리구) 대비 시설오이는 9% (Kim et al., 2013), 시설고추 재배 시 0.06 mM은 무처리 대비 29% 증가하는 경향이었다 (Kim et al., 2015).
작물에 피해가 발생하는 킬레이트제의 임계농도 이상에서는 식물체 잎이 적색으로 변하거나 (Jeffreys and Wallace, 1968), 시들음증 및 식물 괴사를 일으키는 독성이 유발되어 식물 생육이 억제된다 (Jeffreys and Wallace, 1968; Vassil et al., 1998; Lombi et al., 2001; Safari Sinegani and Khalilikhah, 2008). 하지만, 작물과 킬레이트제 종류에 따라 임계농도는 다양하게 나타났다. FeEDDHA 처리 시 보리, 해바라기는 1 mM 이상에서 잎에 적색이 나타났고, 0.8 mM에서 나타나지 않았으며, 담배는 20 mM 이상에서 나타났다. Vassil et al. (1998)은 킬레이트제 (EDTA)를 높은 농도로 처리하면 시들음증과 식물 괴사로 보이는 식물독성을 일이키고, 첨가 후 2년 동안 심어진 옥수수와 보리의 식물 바이오매스 감소를 초래한다고 발표하였다. 국내에서 Kim et al. (2012)은 배추 포트 실험 시 DTPA 1 mM에서 수량이 30%, Kim et al. (2015)은 고추 포장 실험 시 DTPA 0.13 mM에서 7%가 감소하였다. 이처럼 킬레이트제 종류 및 농도에 따라 생육량이 억제되는 정도가 다른 이유는 배위결합하지 않은 free EDTA가 뿌리에 직접적으로 작용하여 영향을 주고 (Vassil et al., 1998), 이로 인해 유발된 세포 교란의 정도에 따른 것으로 사료된다 (Ruley et al., 2006).
킬레이트제 종류에 따른 농도별 수박의 무기성분 흡수량의 관계는 Table 3과 같다. EDDS 1 mM, 5 mM, 0.5 mM과 HEDTA와 DTPA 모두 1 mM 처리구에서 N, P, K, Ca, Mg, Fe의 흡수량은 NPK 처리구와는 통계적 차이가 없었다. 그러나, DTPA와 HEDTA 5 mM 처리구와는 유의적인 차이가 발생하였다.
킬레이트제 및 작물 종류에 따라서 작물이 흡수한 무기성분 흡수량은 그동안의 연구결과에서 다양하게 나타났다. 포장조건에서 DTPA 0.06 mM 처리한 시설오이가 흡수한 무기성분의 함량은 대조구 (무처리구)와 통계적으로 유의한 차이는 나타나지 않았다 (Kim et al., 2013). 그러나 DTPA 0.06 mM 처리한 시설고추의 경우 지상부의 T-N, Ca, Mg, 미량원소 (Fe, Mn, Zn) 흡수량은 대조구 (무처리구)에 비하여 유의성 있게 증가하였고 (Kim et al., 2015), Abdulla and Smith (1963)는 배추에서도 대조구 (무처리구)보다 Ca, Mg, P, Fe, Cu, Zn의 함량이 증가하였다. EDTA 2.5 mmol kg-1 처리한 토양에서 재배한 옥수수 잎과 뿌리에 분포하는 P 농도는 대조구보다 높았으나, K 농도와 미량원소인 Fe, Zn, Cu는 다른 처리구들과 차이가 없었다 (Hovsepyan and Greipsson, 2005). Nowack et al. (2008)은 EDTA가 보리싹에서 Fe 농도를 증가시킬 수 있지만 곡물에서는 증가시킬 수 없다고 발표하였다.
Table 3.
Inorganic element contents of watermelon grown in highly saline soils treated with different chelating agents including DTPA, HEDTA, and EDDS.
수박 포트재배 시 킬레이트제 처리가 토양유효양분에 미치는 영향
DTPA, HEDTA, EDDS를 토양과 혼합하여 수박 포트재배 후 채취한 토양의 화학성을 살펴보았다 (Table 4). 수박 생육량이 가장 높은 EDDS 1 mM 처리구의 전기전도도, 유효인산, 교환성 양이온 및 질산태질소는 무처리구와 통계적인 차이가 없었으나, 수치는 높은 경향이었다. 이것은 무처리구의 토양양분은 수박이 생육함에 대부분 소모되었고, EDDS 1 mM 처리구는 토양에 고정된 양분을 가용화시켰기 때문이라고 생각된다. HEDTA 1 mM 처리구의 (HEDTA 처리구 중에서 수박 생육량이 높음) 유효인산, 교환성 칼륨, 교환성 마그네슘 및 질산태질소도 무처리구와 유의한 차이는 없었으나, 전기전도도와 교환성 칼슘 (exchangeable Ca, Ex. Ca)은 높은 값을 보였다. DTPA 1 mM (DTPA 처리구 중에서 수박 생육량이 높음) 처리구의 교환성 마그네슘 (exchangeable Mg, Ex. Mg)은 무처리구보다 높은 값을 나타냈고, 다른 성분들은 처리간에 통계적인 차이 없었다.
본 연구에서는 미생물의 영향을 분석하지 못하였는데, NAS (2022) 보고서에서 시설멜론 재배 시 DTPA를 처리할 경우 토양미생물활성 (fluorescein diacetate hydrolase)은 증가하는 경향이 있었고, Epeldea et al. (2008)에 따르면 EDDS 0.2 mM을 첨가하면 β-글루코시다아제 값이 상당히 높아진다고 하여, 토양 양분에 영향을 주는 미생물 분석 연구를 진행할 필요가 있다고 사료된다.
Table 4.
Soil chemical properties after harvest of watermelon in soil treated by DTPA, HEDTA, and EDDS.
Conclusions
염류와 유기물 함량이 높은 시설재배지 토양에 DTPA, HEDTA 및 EDDS 킬레이트제를 처리하면 토양에서 K+와 Fe3+의 가용성이 증가했다. 특히 EDDS 1 mM를 처리했을 때 수박의 biomass가 가장 높게 나타났고, 킬레이트제와 결합력이 높은 Fe 성분이 토양으로부터 수박이 흡수한 무기성분 양을 크게 증가시켰다. 이로부터 포트조건에서 전기전도도가 12. 7 dS m-1인 시설토양에 집적된 양분을 킬레이트화하여 작물의 생육량을 증대하고 토양 염류을 감소하는데 효율적인 방법으로 킬레이트제가 활용될 수 있다. 그리고 킬레이트제는 토양의 미생물 활성에도 영향을 주기 때문에 향후 연구에서는 토양의 미생물적인 특성도 고려할 필요가 있겠다.