Introduction
Materials and Methods
시험포장지 설계 및 작물품종 선정
토양 및 식물 채취
토양 화학성 분석
토양 미생물 군집 분석
통계 분석
Results and Discussion
비료 종류 및 경각기간에 따른 토양 화학성 차이
비료 종류 및 경작기간에 따른 토양 미생물 풍부도와 다양성 지수 차이
비료 종류 및 경각기간에 따른 토양 미생물 군집구조 차이
토양 미생물 군집구조와 토양 인자과의 연관관계
Conclusions
Introduction
토양 생태계에서 미생물은 토양 형성, 유기물 무기화, 양분 순환, 작물 생산 등 토양 기능성이 결정됨에 있어서 아주 중요한 역할을 한다 (Yan et al., 2019). 특히, 농경지의 토양 미생물상은 작물 종, 비료 시비, 경운, 관개 등에 따라 풍부함과 다양성이 달라질 수 있으며, 이에 따른 변화가 작물 성장, 비옥도 그리고 토양 생산성에 직 ‧ 간접적으로 영향을 미친다 (Li et al., 2021). 또한 토양 미생물 군집 형성에 있어서 토양 pH와 토성 등의 이화학적 특성 뿐만 아니라 토지용도, 관리방법도 아주 중요한 요인으로 작용한다 (Jangid et al., 2008; Lauber et al., 2008). 그리고 토양환경의 다양한 내 ‧ 외적 요인들로 인한 토양 미생물 군집의 변화는 전반적인 토양의 생태적 기능을 변화시킨다 (Riah-Anglet et al., 2015). 따라서 농업지의 환경적 변화에 의한 토양 미생물 군집의 반응과 그 유동성에 대한 이해도 향상은 토양 비옥도, 작물 생산성 뿐만 아니라 전반적인 농업생태계의 효율적 관리를 위해 필요하다.
일반적으로 토양 미생물 군집의 다양성 및 구조를 평가하기 위해 phospholipid fatty acids (PLFAs), denaturing gradient geletrophoresis (DGGE), temperature gradient gel electrophoresis (TGGE) 등 다양한 분석방법이 활용되어 왔다 (Nkongolo and Narendrula-Kotha, 2020). 하지만 위의 방법들은 낮은 처리량과 경제성, 그리고 현장 모니터링 연구에 대해 제한적이므로, 이러한 단점을 보완하기 위해 최근 차세대 시퀀싱 (next generation sequencing, NGS) 기술이 개발되어 다양한 연구분야에 널리 보급 ‧ 이용되고 있다 (Hou et al., 2018). 특히 국내외 농업토양 분야에서도 NGS 기술을 이용한 미생물 군집 분석을 통해, 토양의 질 및 건강성 연구가 활발히 수행되고 있다 (e.g. Kim et al., 2018a, 2020; Kang et al., 2019; Yan et al., 2019; Zhao et al., 2019; Li et al., 2021; Wang et al., 2021).
지난 수십 년간 우리나라의 음식소비 경향이 변하면서, 쌀 소비량은 감소하는 반면 밭 작물 소비량은 급격히 증가하고 있다. 이러한 음식소비 경향의 변화에 따라, 국내의 수많은 논 농경지 면적이 쌀 공급 과잉 해소와 밭 작물 자급률의 향상을 위해 밭으로 용도 전환되고 있다. 통계청 자료에 따르면 (Statistics Korea, 2017, 2018, 2020), 전국적으로 논밭 전환으로 증가되는 밭 면적은 2016년 22.8천ha, 2017년 33.3천ha, 그리고 2019년 19천ha로 집계되었다. 하지만 논밭 전환 후 초기 밭 작물을 생산하기에 토양 조건이 매우 불량함으로 (Yoon et al., 2009), 농경지의 비옥도와 생산성을 극대화하기 위해 유 ‧ 무기질 비료 시비 등 다양한 토양관리가 요구되고 있다. 논밭 전환에 의한 농경지 용도 변경과 이후 토양관리는 기존의 토양 이화학성 뿐만 아니라 미생물 군집 구조 및 다양성에 직 ‧ 간접적으로 상당히 크게 영향을 미칠 것으로 사료되지만, 아직까지 국내에서는 이와 관련된 연구가 매우 부족하다. 특히, 토양 미생물 다양성과 활성이 농업토양의 질, 건강성 및 작물의 생산성을 결정하는 주요 요인임을 고려해 볼 때, 논밭 전환 농경지에서 형성되는 토양 미생물 군집 구조와 사후 토양관리에 따른 이들의 변화에 대한 연구가 시급히 필요하다고 판단된다.
본 연구는 논밭 전환지와 기존 콩 연작지간 토양 화학성 및 미생물 군집 구조의 특성 차이를 구명하고자 수행하였다. 또한, 비료처리 방법에 따른 논밭 전환지 토양의 화학적 특성 및 미생물 군집 구조 차이를 알아보고, 그 경작기간이 증가함에 따른 차이를 평가하였다.
Materials and Methods
시험포장지 설계 및 작물품종 선정
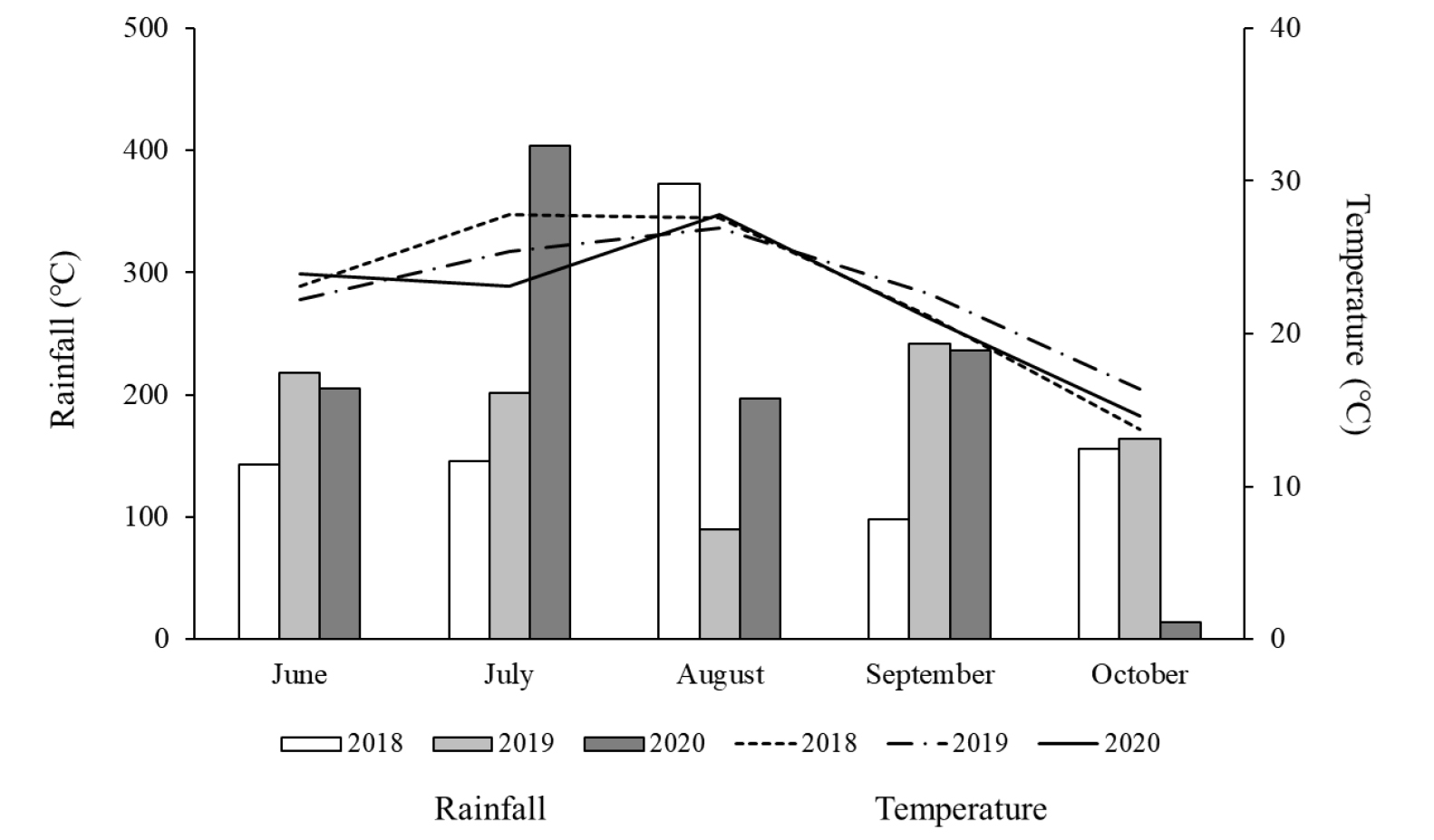
본 연구의 포장시험을 수행하기 위해, 국립식량과학원 남부작물부 (밀양)의 포장시험지 중 논밭 전환지 561 m2를 선정하였다. 논밭 전환되기 이전 논 토양은 장기간 표준 시비량에 따른 무기질 비료 (N-P2O5-K2O = 9-4.5-5.7 kg 10a-1)가 처리되어 왔다. 밭으로 전환 후 비료 무처리구 (NF), 무기질 비료 3요소 처리구 (NPK) 그리고 무기질 비료 및 퇴비 혼합처리구 (NPKC)로 구획을 나누어 3년간 콩 (품종: 대원)을 재배하였다. 각 처리구의 무기질 비료 시비는 콩 표준 시비량에 따라 3-3-3.4 (N-P2O5-K2O) kg 10a-1, 퇴비 시비량은 1,200 kg 10a-1으로 적용하여 처리하였다. 본 연구의 시험구 배치는 분할구배치법으로 각 처리구당 3반복 시료채취를 하였다. 또한, 논밭 전환지와의 토양 특성을 비교분석하기 위해 5년 이상 콩 작황이 수행된 기존의 연작지를 본 연구의 비교대상구 (comparison site, CS)로 추가적으로 선정하였다. 기존의 콩 연작지 밭의 경우, 장기간 표준 시비량에 준하여 무기질 비료시비를 통해 토양관리가 이루어져 왔다. 논밭 전환지 및 기존 연작지 밭 모두 연중 단작으로 콩이 재배되었다. 파종 전 로타리 경운 및 비닐 멀칭을 하였고, 파종은 매년 6월 초 ‧ 중순에 실시하였다. 재식거리는 70 × 20 cm으로 점파 (5 kg 10a-1) 하였다. 콩 수확은 개화 후 50 - 55일차에 수행하였다. 포장시험 기간 중 강수량 및 평균 기온에 대한 기후 데이터는 Fig. 1과 같다.
토양 및 식물 채취
토양시료는 콩 수확기 이후 시험포장지의 표토 (0 - 15 cm)를 채취하였으며, 논밭 전환 후 1년차와 3년차 때 수행되었다. 기존 콩 연작지 CS 토양은 논밭 전환지 토양과 비교하기 위해 전체 시험기간 중 1회 채취하였다. 채취된 토양으로부터 뿌리 등 잔유물을 제거하고 체거름 (<2 mm)한 후 생토 중 일부는 미생물 군집분석을 위해 -80°C 냉동실에 보관하였고, 나머지 토양은 화학성 분석을 위해 풍건한 뒤 플라스틱 용기에 보관하였다. 그리고 콩 수확량 평가는 수확 후 건조 탈곡을 하여 10a당 총 수량 (kg 10a-1)을 산출하여 수행하였다.
토양 화학성 분석
농업과학기술원 토양화학분석법 (NIAST, 2000)에 따라 토양시료의 화학적 특성을 분석하였다. 토양 pH와 전기전도도 (electrical conductivity, EC) 측정을 위해 토양과 증류수를 1:5 비율로 진탕한 후 각각 pH meter (Orion Star 2-Star, Thermo Scientific, USA)와 EC meter (Orion 3-Star, Thermo Scientific, USA)로 측정하였다. 토양 중 유기물 함량은 Tyurin법, 전질소 함량 (T-N)은 Kjeldahl법, 그리고 유효인산 (Av. P2O5)은 Lancaster법으로 정량하였다. 교환성 양이온 (Ex. K, Ca, Mg)은 토양시료를 1N NH4OAc (pH 7.0)으로 추출하여 ICP-OES (OPTIMA 5300DV, PerkinElmer, USA)으로 분석하였다.
토양 미생물 군집 분석
토양시료의 Genomic DNA는 FastDNA SPIN kit (MP Biomedicals, South Korea)를 이용하여 추출하였다. 추출된 DNA는 Nanodrop ND-1000 분광광도계 (Therom Scientific, USA)를 이용하여 정량하였다. Bacterial 16S rRNA genes은 V1-9F (5’-X-AC-GAGTTTGATCMTGGCTCAG-3’)과 V3-541R (5’-X-AC-WTTACCGCGGCTGCTT-3’) primers를 이용하여 증폭하였으며, 여기서 X는 7 - 11개의 nucleotide를 나타낸다 (Chun et al., 2010). PCR mixture (50 µL)는 1x PCR buffer, 0.2 mM dNTPs, 400 µM primer, 1 mg mL-1 bovine serum albumin (Sigma-Aldrich, USA), 1.25U taq polymerase (Roche, Germany) 그리고 10배 희석된 DNA template 1 µL를 혼합하여 제조하였다. PCR 반응은 다음과 같은 조건하에서 진행되었다: 초기변성 (initial denaturation) 94°C 5분; 94°C 30초, 60°C 45초, 72°C 90초 10 cycles (annealing 온도는 cycle당 0.5°C씩 감소); 94°C 30초, 55°C 45초, 72°C 90초 20 cycles. PCR products는 QIAquick Gel Extraction kit (QIAGEN, Germany)로 정제하였다.
Pyrosequencing은 (주)천랩 (Seoul, South Korea)에서 454 GS FLX Titanium 시퀀싱 시스템 (Roche, Branford, USA)을 이용하여 수행하였다. 계통분류 및 통계분석을 위해, 먼저 전체 Pyrosequencing read sequence 중 낮은 quality를 가지는 서열들을 제거하였다. 이후 Hidden Markov Model (HMMER 3.0 platform)을 이용하여 non-targeting 16S rRNA sequence와 chimeric sequence를 분석하여 제거한 후 taxonomic assignment를 수행하였다. 토양 미생물 (세균) 군집 분석은 CLcommunity (Chunlab, Inc., South Korea) 프로그램을 이용하여 수행하였다. Operational taxonomic units (OUTs)는 97% 서열 유사성을 기준으로 하여 CD-HIT 프로그램을 활용하여 분석하였다. 미생물 종 풍부도 및 종 다양성 분석을 위해 MOTHUR platform을 이용하였다.
통계 분석
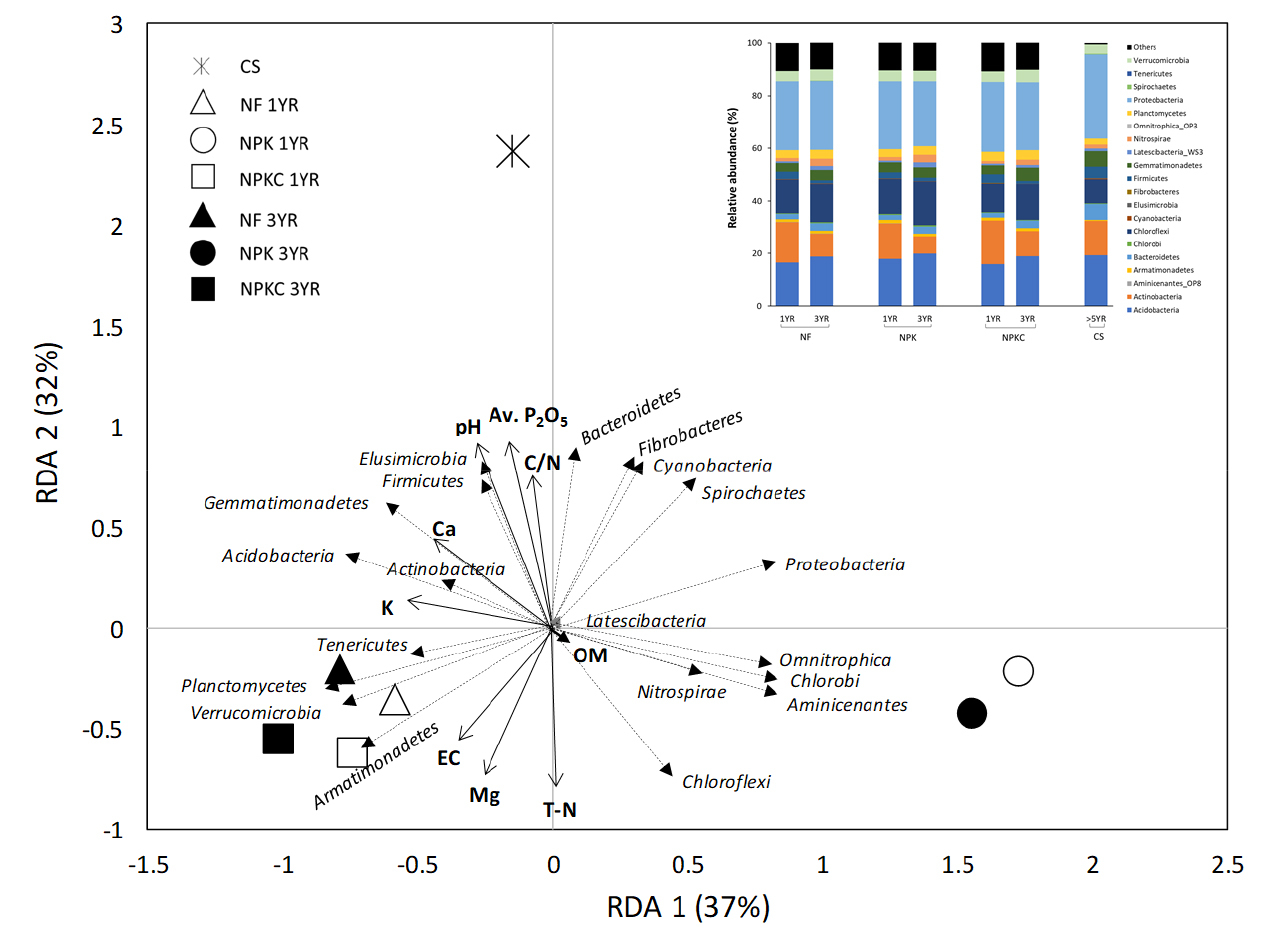
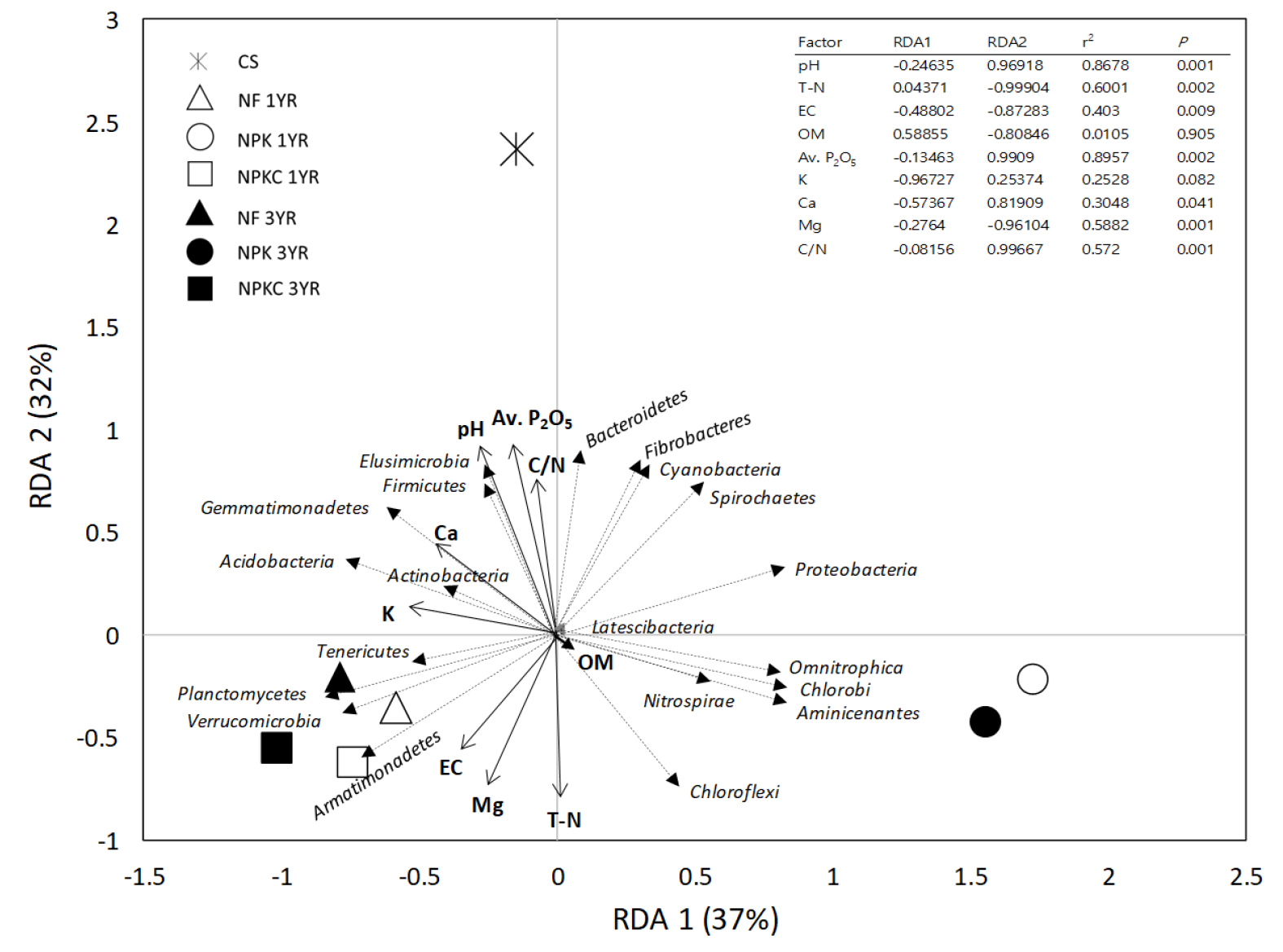
본 연구의 분석자료는 R 프로그램 (version 3.3.3)을 이용하여 통계 분석하였다. 비료처리구 및 경작기간 사이 토양 화학성, 미생물 종 풍부도 및 다양성 그리고 콩 수확량의 통계적 차이 유의성을 평가하기 위해 일원분산분석 (One-way ANOVA) 및 사후분석 (Fisher’s LSD)을 실시하였다. 또한, 비료처리구, 경작기간 및 이들의 상호작용 효과에 따른 토양인자 변화의 차이를 알아보기 위해 이원분산분석 (Two-way ANOVA)를 실시하였다. 토양 화학성 인자와 콩 수확량간 상관관계를 평가하기 위해 Pearson correlation test를 수행하였다. 미생물 종 풍부도 (species richness/abundance)는 abundance-based coverage estimator (ACE)와 Chao, 미생물 종 다양성 (alpha diversity)은 Shannon과 non-parametric Shannon (Np-Shannon) 지표를 이용하여 평가하였다. 토양 미생물 군집 구조와 토양 화학성 인자간 연관성을 평가하기 위해 다변수 통계방법인 Redundancy analysis (RDA)를 이용하였다. 도표에서 비료 처리구는 점 (point)으로, 토양 미생물 문 (phylum)과 토양 환경인자는 각각 점선과 실선 화살표로 표시되며, 각 미생물 문의 증감과 환경변수간 선형적 비례정도를 나타낸다. RDA 분석은 R 프로그램의 Vegan 패키지를 이용하였다.
Results and Discussion
비료 종류 및 경각기간에 따른 토양 화학성 차이
논밭 전환 후 1년차 경작토양의 화학성은 비료 처리구에 따라 차이를 보였다 (Table 1). 토양 pH는 NPK보다 NF와 NPKC 처리구에서 상대적으로 높았지만, 모든 처리구의 pH 값 (6.08 - 6.45)은 콩 작황지 CS 처리구 (pH 7.11)보다 상당히 낮았다 (p < 0.05). 토양 전기전도도의 경우, 비료 처리구간 차이는 없었지만 CS 토양의 EC 값보다 모든 논밭 전환지에서 더 높았다. 특히, NPKC 처리구에서 가장 높은 EC 값이 측정되었으며, 이는 시비된 무기질 비료영향 뿐만 아니라 퇴비의 무기화 과정에서 나온 염이온에 의한 것으로 사료된다 (Kim et al., 2018b).
논밭 전환지 토양 중 유기물 함량은 NPKC (24.7 g kg-1) > NPK (23.9 g kg-1) > NF (22.0 g kg-1) 처리구 순으로 많았으며, 모든 처리구의 값은 CS 토양 (20.3 g kg-1)보다는 상당히 많았다 (p < 0.05). 전질소 함량 또한 비료 처리구간 차이가 OM과 유사한 경향을 보였다. 유효인산의 경우, CS 토양 (256 mg kg-1)에 비해 모든 비료처리구 토양에서 Av. P2O5 값이 0.23 - 0.33배 더 낮았으며, 그 중 NPKC 처리구 (84 mg kg-1)가 가장 높은 값이 나타났다. 교환성 칼륨농도는 NF와 NPK 토양보다 NPKC에서 두 배 이상 높았으며, 이는 본 연구결과 중에 퇴비시비에 의한 가장 뚜렷한 변화로 보였다. 이와 유사한 결과가 교환성 칼슘과 마그네슘 농도에서도 확인되었으며, 이 모든 교환성 양이온 농도 값은 NPKC 처리구에서만 콩 재배 적정수준 범위 내 또는 가장 근접함을 보였다. C/N의 경우, CS (14.5) > NF (11.7) > NPK (8.5) > NPKC (8.3) 순으로 나타났다.
그리고 논밭 전환 후 콩 경작기간 증가에 따른 토양 화학성 변화가 관찰되었다 (Table 1). 모든 처리구의 토양 pH는 밭 전환 1년차보다 3년차에서 더 낮았으며, 그 감소폭은 통계적으로 유의하였다 (p < 0.05). 토양 유기물함량 또한 밭 전환 후 경작연수가 증가할수록 감소하는 경향을 보였고, 감소한 유기물 함량의 범위는 5.0 - 6.4 g kg-1로 모든 처리구에서 유사하게 나타났다. 전질소의 경우, NPK 및 NPKC 처리구가 질소질 비료가 첨가되지 않은 NF 처리구보다 상당히 더 높은 T-N 값을 보였다 (p < 0.05). 그리고 NF 처리구에서 밭 경작기간 증가에 따른 T-N 값의 유의한 증가 (0.14 → 0.18%)를 확인할 수 있었다. 이는 장기간 콩 경작에 의한 콩 뿌리-뿌리혹 박테리아의 질소고정 효과 (Rodríguez-Navarro et al., 2011)의 증가 영향으로 사료된다. 반면, NPK 및 NPKC 처리구의 경우, 요소와 퇴비 투입으로 인한 인위적인 질소 공급이 뿌리혹 박테리아와의 공생 질소고정 효과를 감소시키는 것으로 사료되며 (Dogra and Dudeja, 1993; Reinprecht et al., 2020), 이로 인해 NF 처리구와는 달리 경작기간의 증가에 따라 T-N값이 감소 또는 그 수준을 유지한 것으로 보인다. 또한 밭 전환 후 경작기간 증가에 따른 유기물 및 전질소 함량의 이러한 변화는 모든 처리구의 C/N 감소에 영향을 미친 것으로 보인다.
Table 1.
Chemical properties of soils converted from paddies to soybean-growing uplands with different fertilizer treatments such as non-fertilizer (NF), inorganic fertilizer (NPK), and NPK + compost (NPKC). Each treatments had different periods of farming practice since land use conversion (1 and 3 years) and comparing site (CS) with history of land use as a soybean-growing upland for more than 5 years included. Data indicate mean of each treatment (n = 3) and same letters in each column represent no significant difference among the treatments (LSD, p < 0.05).
전반적으로 유효인산은 밭 전환 3년차 토양에서 더 낮은 값이 관찰되었고, 그 감소폭은 NF > NPK > NPKC 순으로 나타났다. NPKC 처리구에서의 연차별 토양 유효인산 농도 차이에는 통계적으로 유의성이 없었으며 (p > 0.05), 이는 시비된 퇴비에 포함된 인의 공급에 의한 영향으로 사료된다. 반면 NPK 처리구의 경우, 무기질 인산비료가 지속적으로 처리되었음에도 불구하고 토양 중 Av. P2O5 값에서 통계적으로 유의한 감소가 관찰되었는데, 이는 표준 시비량보다는 시비처방에 따른 인산비료 공급이 필요한 것을 보여준다. 또한 유효인산 감소의 또 다른 이유로는 밭 전환 이전의 기존 논토양에 함유되어 있던 유효태 인의 공급원이 논밭 전환 후 호기조건 상태에 지속적으로 노출되면서 그 유효도가 점차 감소되어 비롯된 것으로 보인다 (Zhou et al., 2014). 이와 같이 포장시험 기간 동안 논밭 전환지 토양의 낮은 유효인산 농도는 콩 수확량에도 영향을 미친 것으로 사료되며, 실제로 모든 처리구 (NF, NPK, NPKC)의 3년차 토양 중 유효인산 농도가 1년차에 비해 각각 18, 37, 19%로 감소하였다 (Fig. 2). 하지만 재배시험 3년간 지속적으로 비료가 시비되었음을 감안할 때, 유효인산의 부족 뿐만 아니라 다른 환경요인에 영향을 받은 것으로 보였다. 이에 기상자료를 살펴본 결과, 포장시험 3년차 기간 중 7월의 강수량이 다른 년도에 비해 2배 이상 많은 것으로 나타났으며, 평균기온 또한 2 - 4°C 정도 낮았다 (Fig. 1). 따라서 이러한 기상요인의 악조건이 3년차의 모든 처리구 콩 생산량에 악영향을 미친 것으로 판단된다. 전반적으로 콩 수확량은 토양 pH (r = 0.77, p < 0.001), 유기물 (r = 0.61, p < 0.01) 그리고 유효인산 (r = 0.70, p < 0.01)과 양의 상관관계를 보였다 (Table 2).
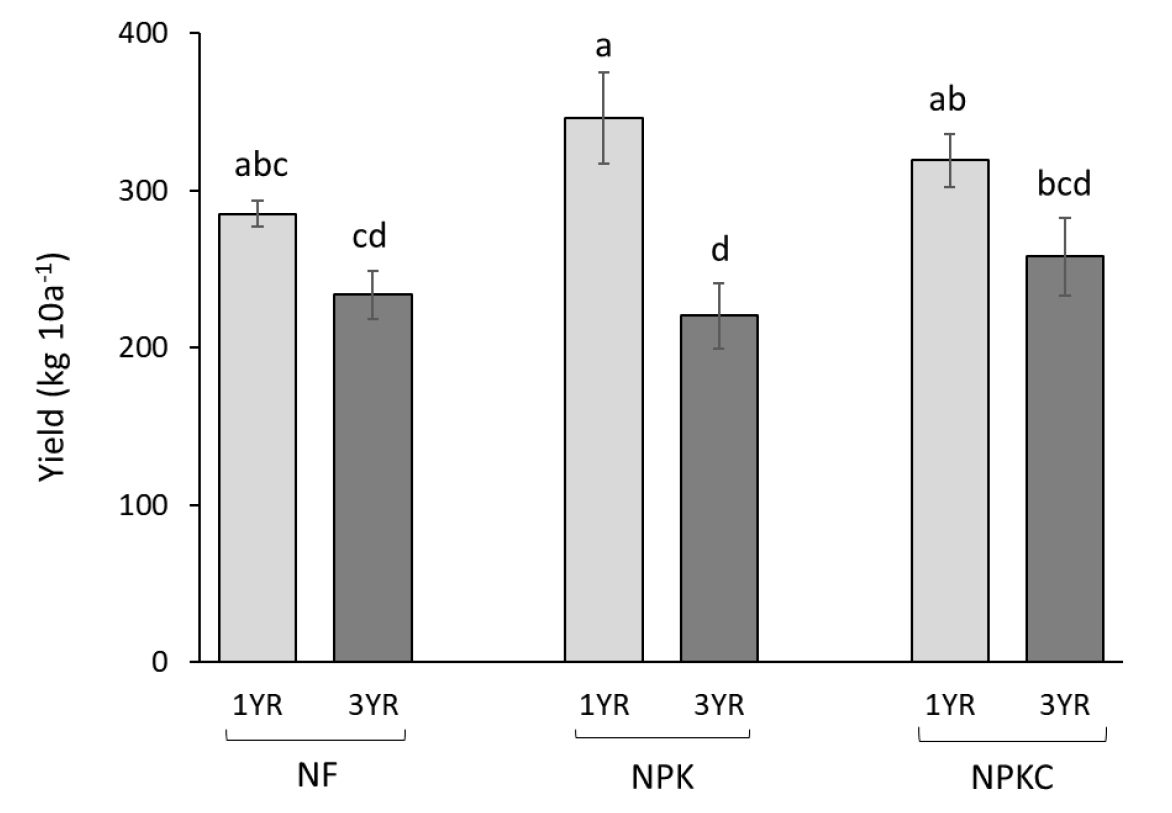
Fig. 2.
Yield of soybean in soils with different fertilizer treatments including non-fertilization (NF), inorganic fertilization (NPK), and inorganic and organic fertilization (NPKC) during three years. Comparing sites (CS) with history of land use as a soybean-growing upland for more than 5 years included. Data indicate mean of each treatment and standard deviation (n = 3). Same letters represent no significant difference among the treatments (LSD, p < 0.05).
Table 2.
Correlation coefficient (r) of soybean yield and soil properties.
| Parameter | r | P value |
| pH | 0.770 | <0.001 |
| T-N | -0.393 | 0.078 |
| EC | -0.324 | 0.152 |
| OM | 0.609 | 0.003 |
| Av. P2O5 | 0.698 | <0.001 |
| Ex. K | 0.226 | 0.325 |
| Ex. Ca | -0.078 | 0.738 |
| Ex. Mg | -0.813 | <0.001 |
비료 종류 및 경작기간에 따른 토양 미생물 풍부도와 다양성 지수 차이
논밭 전환 1년차 모든 처리구의 밭 토양에서 관찰된 총 유효 sequences 수는 81,660, 조작분류단위인 OTUs (operational taxonomic units) 수는 9,375이였다. 또한 공통적으로 두 수치는 NPKC > NPK > NF 처리구 순으로 높았다 (Table 3). 종 풍부도 (diversity richness)를 나타내는 지수인 ACE와 Chao는 NPKC > NPK > NF 순으로, 알파 다양성 (alpha diversity) 지수인 Shannon과 Np-Shanon 값은 NPKC = NPK > NF 순으로 높았다. Phylogenic diversity는 NPKC > NPK > NF 순으로 높았다. 위 결과를 종합해보면, 토양 중 미생물 종 풍부도와 다양성은 무기질 비료 (NPK)와 퇴비 (compost) 시비에 의해 확연히 영향을 받는 것으로 사료되며, 이와 유사한 연구결과가 Hartmann et al. (2015)과 Li et al. (2021)에 의해 보고된 바 있다.
토양 화학성과 같이, 논밭 전환 후 콩 경작기간에 따른 토양 미생물의 풍부도와 다양성 변화가 확인되었다 (Table 3). 논밭 전환 후 1, 3년차 토양의 모든 미생물 군집 관련 지수 (OTUs, ACE, Chao, Shannon, Np-Shannon, phylogenetic diversity)를 비교해 본 결과, 모든 지수가 공통적으로 1년차에서보다 3년차 토양에서 통계적으로 유의하게 높았다 (p < 0.05). 이는 장기간 양분 및 유기물의 투입으로 인한 영향 뿐만 아니라 논밭 전환지 토양 중 호기성 미생물인 Acidobacteria, Bacteroidetes, Proteobacteria 등의 밀도 (population) 및 활성 증가에 따른 변화가 그 원인으로 보인다 (Yan et al., 2019).
Table 3.
Abundance and diversity of bacteria in soils converted from paddies to soybean-growing uplands with different fertilization treatments such as non-fertilizer (NF), inorganic fertilizer (NPK), and NPK + compost (NPKC). Each treatments had different periods of farming practice since land use conversion (1 and 3 years) and comparing site (CS) with history of land use as a soybean-growing upland for more than 5 years included. Data indicate mean of each treatment (n = 3), and same letters in each column represent no significant difference among the treatments (LSD, p < 0.05).
비료 종류 및 경각기간에 따른 토양 미생물 군집구조 차이
Fig. 3은 문 (phylum) 수준에서 다른 비료 처리 및 경작기간에 따른 미생물 군집 구조의 상대적 풍부도 차이를 보여준다. 본 연구 시험포장지 토양에서는 전반적으로 Proteobacteria > Acidobacteria > Actinobacteria > Chloroflexi > Verrucomicrobia > Planctomycetes > Firmicutes 등의 순으로 미생물 군집 구조가 관찰되었다 (Table 4). Proteobacteria는 Gram-negative 세균으로 농업 토양생태계에서 가장 우점적 미생물 그룹으로 알려져 있으며, 탄소, 질소, 황 순환과 같은 토양 기능에 기여도가 높다 (Mhete et al., 2020). 또한 Actinobacteria 문도 대부분 Gram-negative 세균으로 구성되어 있으며, cellulose, chitin 및 humus 등 다양한 형태의 토양 유기물 분해와 탄소 순환에 중요한 역할을 한다 (Shivlata and Satyanarayana, 2015; Anandan et al., 2016). 반면 Firmicutes 문은 대부분 인간의 병원균과 관련이 높은 미생물이 포함되는 것으로 알려져 있다 (Mhete et al., 2020).
농경지 토양에서의 무기질 비료 및 유기물 시용은 토양 미생물 군집의 풍부도와 다양성에 직접적으로 영향을 미칠 뿐만 아니라 이러한 토양 관리의 기간이 길어질수록 토양 미생물, 특히 세균 군집 구조 변화를 더 큰 영향을 준다 (Hartmann et al., 2015). 본 연구에서는 논밭 전환 1년차때, 비료 처리구간 토양 미생물 군집 풍부도의 상대적 차이가 없었지만, 콩 작황지인 CS와는 확연한 차이를 보였다 (Fig. 3). 특히, 논밭 전환지의 모든 처리구 토양에서 호기성 미생물인 Acidobacteria, Bacteroidetes 및 Proteobacteria 문의 풍부도가 CS 처리구보다 상대적으로 더 낮았는데, 이는 논밭 전환지와 기존 콩 작황지 토양간 산화/환원 조건 차이에서 기인된 것으로 사료된다.
토양 물리성, 양분 순환 등 토양 이화학적 특성은 토양 중 수분함량에 따른 산화/환원 조건에 따라 달라지며, 이에 의한 토양 기능의 변화가 토양 미생물 군집 구조 형성 및 활성에 영향을 미친다 (Hou et al., 2018). 본 연구에서는 논밭 전환에 따라 농경지 토양이 혐기성에서 호기성으로 변화되었으며, 밭 경작기간이 증가하면서 토양 산소포화도가 더 향상되어, 이로 인해 호기성 미생물인 Acidobacteria, Bacteroidetes 및 Proteobacteria 등의 밀도가 증가한 것으로 사료된다. 이 세균들은 토양 탄소 무기화 및 순환에 중요한 역할을 하는 것으로 잘 알려져 있다 (Kalam et al., 2020; Wang et al., 2021). Keiluweit et al. (2017)의 보고에 따르면, 혐기에서 호기로 토양 조건이 변화되면 토양 중 탄소 무기화율은 10배 증가된다. 따라서 이러한 점을 고려해 볼 때, 본 연구에서 논밭 전환 후 장기간의 밭 경작활동이 토양의 산소포화도를 향상시키고, 이로 인해 증가된 유익한 토양 호기성 미생물군이 토양 중 유기물 무기화를 촉진 그리고 양분 유효도를 증가시키는 것으로 판단된다. 이를 뒷받침하는 결과로 본 연구에서는 모든 처리구에서 경작기간 증가에 따라 유기물 함량은 감소한 반면 양분 유효도는 증가되었다 (Table 1).
반면 본 연구에서는 증가된 토양 호기성에 따른 감소된 미생물군이 관찰되었다. 세균 문 중 혐기성 미생물인 Firmicutes (Malele et al., 2018)은 모든 처리구에서 논밭 전환 후 경작기간이 증가함에 따라 확연히 감소하였다 (Table 3). 특히, Firmicutes 문 중 Clostridium 속의 미생물 종은 인간과 동물의 몇 가지 심각한 질병을 일으키는 병원균 (e.g. 보툴리누스 중독, 파사풍, 흑색병, 식중독)으로 알려져 있으며 (Gibbs, 2009), 본 연구에서는 논밭 전환 및 장기간 밭 경작수행에 의해 Clostridium 속 분포가 감소하는 것을 확인할 수 있었다. 또한 대부분 호기성 미생물로 알려진 Actinobacteria (Anandan et al., 2016)은 Firmicutes와 같이 밭 경작기간에 따라 감소하였는데, 이 세균 문의 Actinomyces와 같은 일부 혐기성 미생물 속 (genus)의 감소로 인한 영향인 것으로 사료된다 (Bowden, 1996).
Chloroflexi와 Planctomycetes 문의 세균은 논밭 전환 후 경작기간이 증가함에 따라 NPK, NPKC보다 NF 처리구 토양에서 이들의 증가율이 훨씬 높은 것으로 관찰되었다 (Table 4): NF (2.5배), NPK (<1.9배), NPKC (<1.9배). 그 원인으로 Chloroflexi와 Planctomycetes는 빈영양미생물 (oligotropic microorganism)로 저농도 영양조건에서 증식이 활발해지는 특성을 지니고 있기 때문에 (Zhao et al., 2019), 무기질 비료와 퇴비가 처리된 토양 (NPK, NPKC)에 비해 무처리구 토양 (NF)에서 상대적으로 더 많은 population이 형성된 것으로 사료되며, 심지어 이들 세균의 모든 population은 콩 작황지 토양 (CS)보다 더 높았다.
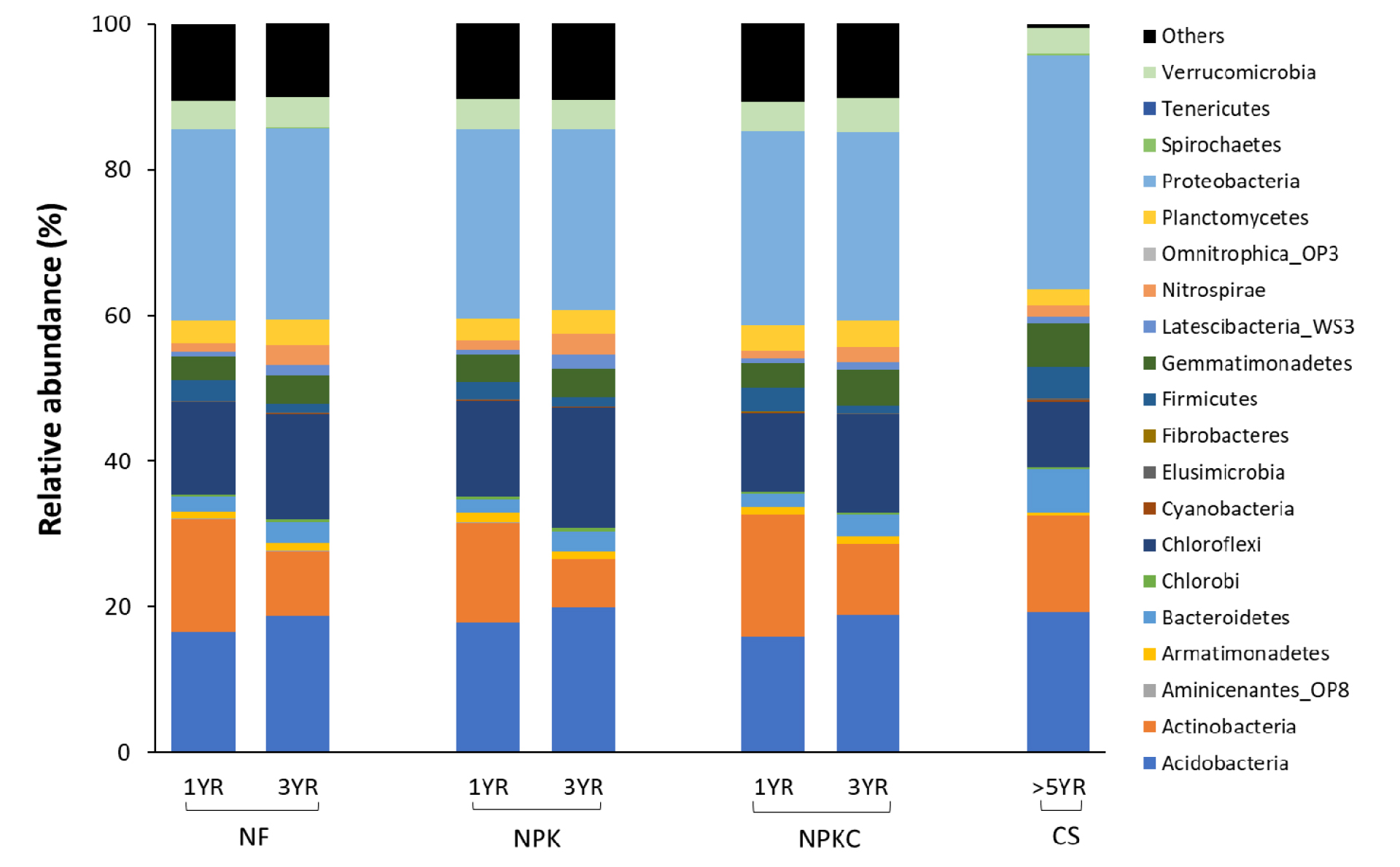
Fig. 3.
Relative read abundance of different microbial community structure at the phylum level in soils with different fertilizer treatments including non-fertilization (NF), inorganic fertilization (NPK), and inorganic and organic fertilization (NPKC) during three years. Comparing sites (CS) with history of land use as a soybean-growing upland for more than 5 years included.
Table 4.
Total sequence number of bacteria at the phylum level in soils with different fertilizer treatments including non-fertilization (NF), inorganic fertilization (NPK), and inorganic and organic fertilization (NPKC) during three years. Comparing sites (CS) with history of land use as a soybean-growing upland for more than 5 years included.
토양 미생물 군집구조와 토양 인자과의 연관관계
Fig. 4는 미생물 (세균) 군집 구조와 토양 화학성 인자간 연관성을 다변수 통계분석법인 RDA로 분석한 결과를 보여준다. 비료 처리구 3가지 (토양채취 시점 2가지 및 반복수 3개) 및 CS 토양 3개를 포함하여 총 21개의 토양시료를 대상으로 Actinobacteria을 포함한 20개 그룹으로 나누어 통계분석을 실시하였다. 토양 미생물 군집구조에 영향을 주는 매개변수로는 pH, T-N, EC, OM, Av. P2O5, Ex. Ca, Ex. Mg 및 C/N으로 총 8개 변수가 이용되었다. 이 중 통계적으로 유의한 변수 (p < 0.05)는 OM과 Ex. K을 제외한 6개의 토양 변수가 미생물 군집구조에 영향을 미치는 것으로 나타났다. 특히, RDA1 축 (37% variance)을 따라 비료 처리방법에 따른 차이로 그룹이 형성이 되었고, RDA2 축 (32% variance)을 따라서는 CS와 논밭 전환지간 특성 차이를 나타났다. Table 4의 결과를 토대로 보았을 때, CS 토양특성은 Bacteroidetes, Elusimicrobia, Firmicutes, Gemmatimonadetes, Fibrobacteres, Cyanobacteria 등 분포와 연관성이 높은 것을 알 수 있었다. 논밭 전환지의 경우, NF와 NPKC 토양특성은 Planctomycetes와 Armatimonadetes, NPK 토양특성은 Chlorobi의 분포와 관련이 있는 것을 확인할 수 있었으며, 이러한 경향은 3년차 토양시료에서 나타났다. 또한 이와 같은 각 처리구의 미생물 군집 구조 분포는 토양의 화학성 인자와 높은 연관성이 있음을 확인할 수 있었다 (Fig. 4). CS 토양의 경우, pH, 유효인산 및 C/N율이 미생물 군집 구조 형성에 주요 요인으로 나타났으며, 비료 처리구간 (NF, NPKC vs NPK) 토양 미생물 군집 구조 차이는 Mg, EC, Ca 및 K의 토양인자와의 상관관계 경향에 따라 구분되는 것으로 나타났다. 또한, 논밭 전환 후 경작기간 증가에 따른 미생물 군집 구조 변화는 RDA1 축에 따라 나타났는데, 이는 장기간 밭 경작수행에 따른 교환성 양이온 (Mg, Ca 및 K)의 변화가 미생물 군집 구조 형성에 밀접한 영향을 미친 것으로 판단된다.
Conclusions
본 연구에서는 논밭 전환 후 다양한 비료처리를 통한 토양관리와 그 경작기간에 따라 토양 화학성 및 미생물 군집 구조 형성이 확연히 달라지는 것을 확인할 수 있었다. 다양한 비료 처리에 의한 처리구간 토양 pH, 유기물, 유효인산, 교환성 칼슘과 마그네슘 및 C/N율의 상당한 차이가 있었고, 이 중 pH, 유기물, 유효인산, 교환성 마그네슘은 경작기간에 따라 큰 변화를 보였다. 이러한 토양 화학성의 차이와 시간적 변화는 논밭 전환 후 토양 산화환원 조건 변화와 밀접한 연관이 있는 것으로 보이며, 이로 인해 토양 미생물 군집 구조 형성에도 직 ‧ 간접적으로 영향을 미친 것으로 사료된다. 종 풍부도 및 다양성은 NPKC > NPK > NF 순이였고, 우점 세균 문은 Proteobacteria, Acidobacteria, Actinobacteria, Chloroflexi이였다. 특히 논밭 전환 후 밭 경작기간의 증가에 따른 호기성 세균 Acidobacteria 및 Bacteroidetes의 분포도 증가는 토양 유기물 분해 촉진과 양분 유효도 증가에 영향을 준 것으로 판단된다. 하지만 본 연구에서는 3년 동안의 꾸준한 비료 시용에도 불구하고, NPK 및 NPKC 토양의 낮은 유효 인산 함량이 콩 수확량에 악영향을 미친 것으로 사료된다. 따라서, 논밭 전환 후 토양 비옥도 및 생산성을 극대화하기 위해서는 시비처방에 따른 적절한 비료시비를 통해 토양관리 방법이 적용될 필요가 있으며, 토양 질과 건강성 향상과 관련된 환경적 요인과 미생물 군집 구조를 밝혀내어 경작지 토양을 지속적으로 관리하는 것이 필요하다.