Introduction
Materials and Methods
시험재료 및 GH1-13균주 접종
시험구 배치 및 파종
클로렐라의 감자 식물체에 살포
감자 초장, 병해발생 및 수량 조사
토양중 양분 분석방법
통계분석
Results and Discussion
시험 전 ‧ 후 토양의 화학성 변화
GH1-13 처리와 감자의 초장 변화
균주처리와 씨감자 더뎅이병 발생
균주처리와 씨감자 무름병 발생
균주처리와 씨감자 수확 개체수
균주처리와 씨감자 수량
Conclusions
Introduction
감자의 영양체인 덩이줄기는 각종 병원균이나 토양해충 등에 의해 피해를 받기 쉽다. 그래서 생산물을 씨감자로 사용하면 수량과 품질이 크게 나빠질 수 있다. 즉, 씨감자는 재배과정에서 바이러스병, 세균병, 곰팡이병 등에 의한 병리적 퇴화가 발생되기 쉬우므로 관리가 요구된다. 특히, 바이러스는 진딧물과 같은 매개충에 의한 접촉 및 즙액에 의한 전염 등 전염경로가 다양하고 전염속도가 빨라서 씨감자를 급속히 퇴화시킨다. 따라서 씨감자의 병리적 퇴화방지에 각별한 노력이 필요하다.
우리나라는 1970년에 이르러 기본종 → 기본식물 → 원원종 → 원종 → 보급종이라는 씨감자 공급체계를 갖추었다. 일반 씨감자는 주로 국가기관에서 생산보급하고 있으며, 일부 가공용 등은 민간 기업에서 생산, 보급되었으나 정부의 종자산업 활성화 정책에 따라 2012년부터는 지방자치단체와 민간업체에서 보증된 씨감자를 공급하고 있다.
건전한 씨감자를 생산하기 위해 감자 싹에서 생장점을 0.1 - 0.3 mm 크기로 잘라 시험관내에서 배양하고 바이러스병을 검정하여 건전한 개체만을 증식하여 기내소괴경을 생산하거나 온실 내에서 수경재배 또는 경삽 재배하여 소괴경을 생산한다. 수경재배 씨감자와 경삽소괴경은 조직 배양한 어린 줄기를 수경재배하거나 토양이나 영양배지에 삽목 생산하며 기내소괴경보다 크기가 커서 (5 - 30 g) 토양에서 증식 횟수를 줄일 수 있다.
시 ‧ 군 농업기술센터는 영양번식작물에 대하여 농촌진흥청 소속 연구기관으로부터 기본종을 분양받아 조직배양 → 양액재배 → 토양재배를 통해 씨감자를 생산하여 농가에 보급하고 있다.
농업미생물은 작물에 대한 생육촉진, 유도저항성, 면역활성, 병해충 피해 예방과 토양개량 등 화학비료와 합성농약의 대체재로 수요가 증가되고 있다 (Avis et al., 2008; Santoyo et al., 2012). 최근 농촌진흥청 국립농업과학원에서는 작물의 생육촉진, 염 내성 및 작물의 주요 병원균에 대한 길항 활성을 갖는 신규 바실러스 균주인 Bacillus velezensis GH1-13 (이하 GH1-13로 표기)의 생산기술을 산업체에 이전하였다 (Kim et al., 2016b). GH1-13 균주는 식물생장촉진 물질인 인돌아세트산 (indole-3-acetic acid, IAA)을 생산하는 한편, 식물병원성 곰팡이에 대해 강한 길항작용을 갖는 bacillomycin, bacilysin, fengycin, iturin, surfactin 등의 물질을 생합성하는 유전자를 가지고 있다고 한다 (Kim et al., 2017).
클로렐라는 광합성을 하는 녹조류의 일종으로 단백질, 엽록소, 비타민, 미네랄, 핵산 및 불포화지방산 등 (Cha et al., 2008)을 세포내에 함유하고 있어어서 면역기능 향상 (Guzman et al., 2003), 항산화 작용 (Guzman et al., 2001; Shibata et al., 2003), 간 기능개선 등의 효과가 있다고 알려져 있다 (Kang et al., 2004). 클로렐라를 실내에서 빛과 암 상태를 14:10 h (Light:Dark)로 조절하거나 암 상태에서 glucose (5 g L-1)를 첨가하여 배양할 경우 식물생장조절제 (plant growth regulators)인 내생옥신 (auxin)과 사이토키닌 (cytokinin)이 증가하는 것으로 보고되었다 (Stirk et al., 2014).
국내에서 GH1-13균주와 클로렐라 균주는 개별적으로 작물에 처리한 효과는 보고되었으나, 이 두 균주를 복합적으로 처리된 효과는 보고되지 않았다. 또한 씨감자 생산 사업에서 농업 미생물의 활용에 대한 연구 결과도 볼 수 없었다. 이에 본 연구는 농가보급용 씨감자 생산에서 GH1-13의 침지처리와 클로렐라의 엽면살표 처리에 따른 효과를 규명하고자 수행되었다.
Materials and Methods
시험재료 및 GH1-13균주 접종
농촌진흥청 국립식량과학원 고령지농업연구소에서 무병묘 (품종명: 추백)를 2019년 2월 분양받아 조직배양한 다음 이를 양액재배를 통해 생산한 것을 ‘수경 씨감자’로 구분하였다. 이 수경 씨감자를 2020년 가을 완주군 농업기술센터에서 밭 재배를 통해 증식한 것은 ‘토경 씨감자’로 시험에 사용하였다. 수경 씨감자는 조각내지 않은 상태로, 토경 씨감자는 2 - 4등분한 상태에서 파종하고 있다. 따라서 본 실험에서는 기본종인 수경씨감자와 토경씨감자를 이용하여 농가보급용 원종 생산성에 미치는 영향을 규명하고자 각각의 씨감자를 GH1-13 균주 100배액에 1시간 침지하고 실내에서 음건한 다음 파종하였다.
상업적으로 판매되는 GH1-13균주의 밀도는 1.0 × 109 cfu mL-1이었으며, 이를 100배로 희석하여 접종용 균주액으로 사용하였다.
시험구 배치 및 파종
완주군 고산면 소재 완주군농업기술센터의 밭에 ha당 질소 100 kg을 요소로, 인산 88 kg을 용성인비로, 칼리 130 kg을 염화가리로 환산하여 전량 밑거름으로 시용하였다. 포장은 경운 로터리 작업 이후 이랑을 만들고 배색필름으로 피복하였다. 시험포장의 한쪽에는 토경 씨감자를 GH1-13에 침지 후 파종구와 무침지 파종구로 구분하였다. 다른 한쪽은 수경 씨감자는 모두 GH1-13에 침지한 다음 실내에서 건조시켰다. 이렇게 준비한 다음 토경 씨감자에서는 GH1-13 무침지 + 클로렐라 살포, GH1-13 침지 + 클로렐라 무살포, GH1-13 무침지 + 클로렐라 무살포, 수경 씨감자에서는 GH1-13 침지 + 클로렐라 무살포, GH1-13 침지 + 클로렐라 살포와 같은 5처리하였다. 포장시험에서 각 처리는 완전임의배치법 3반복으로 배치하고, 감자를 80 × 25 cm 간격으로 2021년 3월 18일에 심었다.
클로렐라의 감자 식물체에 살포
본 실험에 사용된 클로렐라 균주 (Chorella vulgaris, CHK0008)는 농촌진흥청 유기농업과에서 개발하여 산업체에 기술이전된 제품이었다. 본 실험에 사용된 클로렐라는 이 산업체로부터 공급받은 균주를 완주군농업기술센터 미생물배양센터에서 증식한 것이었다.
씨감자의 초장은 파종 7주 후인 4월 27일 48 cm 이상이 되었으며, 이때 클로렐라 균주 250배 희석액을 ha당 417 L 해당량으로 감자의 지상부인 잎과 줄기에 1차 살포하고, 2021년 5월 4일에 2차 분무 살포하였다.
감자 초장, 병해발생 및 수량 조사
감자의 초장과 괴경의 병해발생과 수량은 농촌진흥청의 농업과학기술 연구조사 분석 기준 (Jung et al., 2012)에 따라 조사하였다. 감자의 초장은 클로렐라 1차 살포이후 2주 후인 5월 13일 조사하였고, 감자는 처리 별로 6월 14일 수확한 다음 괴경 별로 더뎅이병과 무름병 여부를 조사하였고, (발병 괴경수/조사 괴경수) × 100으로 발병 괴경률을 산정하였고, 이병된 감자를 제외한 건전한 씨감자의 생산량도 조사하였다.
토양중 양분 분석방법
토양시료는 감자 정식 전과 수확이후 0 - 20 cm 깊이로 채취하여 음지에서 자연 건조시킨 후 2 mm 체를 통과시켜 농촌진흥청 토양 및 식물체 분석법 (NIAST, 2000)과 토양화학분석법 (NAAS, 2010)에 따라 분석을 실시하였다. 토양 pH는 토양과 증류수를 1:5 (w/v)로 혼합하여 30분간 진탕한 후 pH meter (Mettler Toledo, Switzerland)로 측정하였고, EC는 conductivity meter (Mettler Toledo, Switzerland)로 측정하고 환산하였으며, 유기물은 Walkley-Black법, 유효인산은 Lancaster법으로 측정하였고, 교환성 K, Ca, Mg은 1 N ammonium acetate로 침출한 후 AAS (atomic absorption spectrophotometer, SpectrAA 55B, Varian, USA)로 분석하였다.
통계분석
감자의 수량에 대한 통계 분석은 SPSS (SPSS version 19.0, IBM, USA)를 사용하여 5% 수준에서 Duncan’s multiple range test를 실시하였다.
Results and Discussion
시험 전 ‧ 후 토양의 화학성 변화
시험토양은 고천통의 사양토 (모래 13.4%, 미사 62.8%, 점토 23.8%)이며, 화학적 특성은 Table 1과 같다. 고천통은 최근의 하성충적물로부터 기인하며 주요 강을 따라서 내륙하성평탄지에 위치한다. 경사도는 0 - 2%이며, 배수는 약간 양호하여, 벼는 물론 밭작물 재배에도 적합한 토양이다. 시험 전 토양 중 pH, 칼슘, 마그네슘 함량은 적정 기준 보다 높았지만, 유기물, 칼리, EC는 기준치에 적합하였다. 또한 감자 재배시험 후 토양 중 양분함량은 시험 전 토양과 비교하여 별 차이가 없었다.
Table 1.
Chemical properties of the experimental field before and after planting.
GH1-13 처리와 감자의 초장 변화
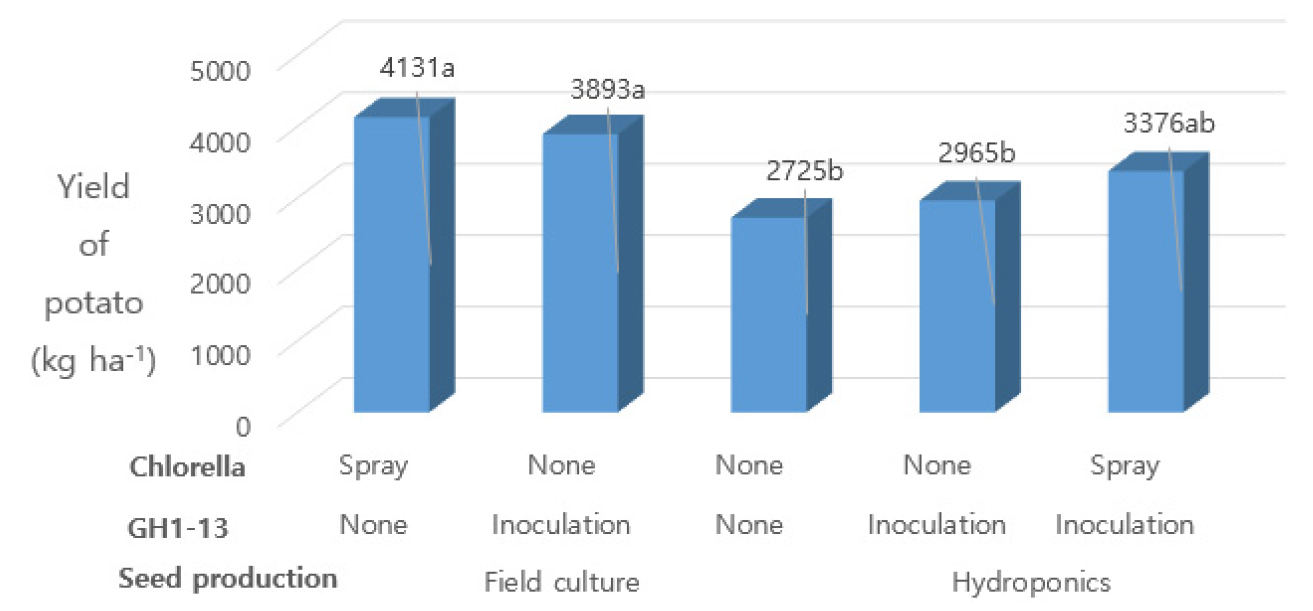
Fig. 1은 추백 감자 파종 57일 후의 초장을 처리별로 나타낸 것이다. 씨감자 종류별로 비교해 보면, 토경 씨감자 파종이 수경 씨감자 파종 보다 초장이 약 10 cm 이상 길었다. 토경 씨감자에서는 GH1-13 균주 침지는 59.1 - 60.7 cm로서 무처리의 57.0 cm보다 길었고, 클로렐라 경엽살포의 초장은 59.1 cm로서 무처리 보다 2.0 cm가 길었다. 수경 씨감자에서도 클로렐라 경엽살포 처리에서 초장은 49.7 cm로서 무처리 보다 1.5 cm가 길었다.
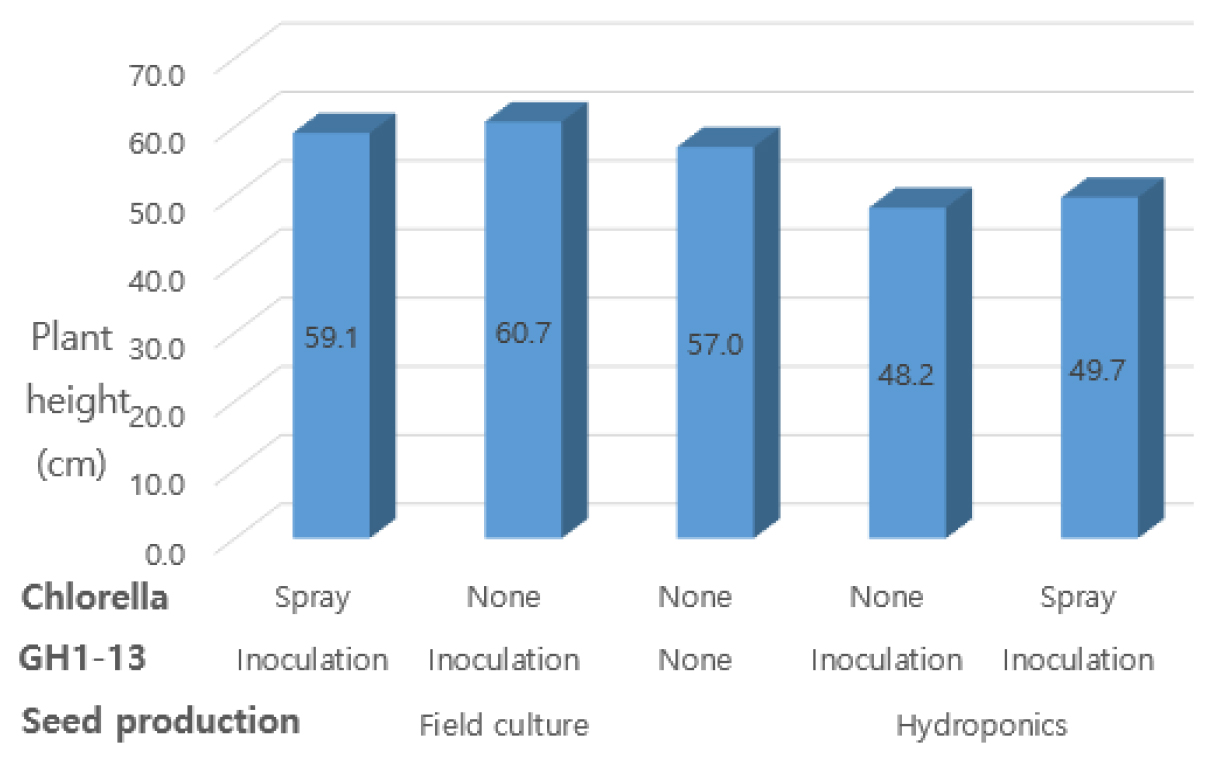
Fig. 1.
Effect of inoculation of Bacillus velezensis GH1-13 and spraying Chlorella vulgaris on the plant height at 57 days after planting. GH1-13 inoculation: seed soaked for 1 hours in the culture solution and dried in the dark room; Chlorella spray: Chlorella sp. solution was sprayed on the leaf and stem of potato plants.
한편 토경 씨감자에서는 GH1-13균주와 클로렐라 복합처리가 GH1-13 균주 단독 보다 초장이 짧았으나, 수경 씨감자에서는 반대의 결과가 관찰되었다.
Idris et al. (2007)은 GH1-13균주가 tryptophan을 전구체로 사용하여 IAA를 만드는 tryptophan 의존형 경로를 가진 세균이라고 하였다. Kim et al. (2016b)은 GH1-13 균주로 종자에 침지 처리한 결과, 토마토와 오이에 대한 생육촉진효과와 벼의 근장에 대한 생육촉진 효과는 통계적 차이가 없었으나 뿌리털의 개수에는 통계적인 유의성을 보였다고 하였다. 이러한 결과를 볼 때, GH1-13 균주와 클로렐라 균주의 처리시기, 처리농도, 복합처리 효과 등에 대한 체계적인 연구가 필요하다고 본다.
균주처리와 씨감자 더뎅이병 발생
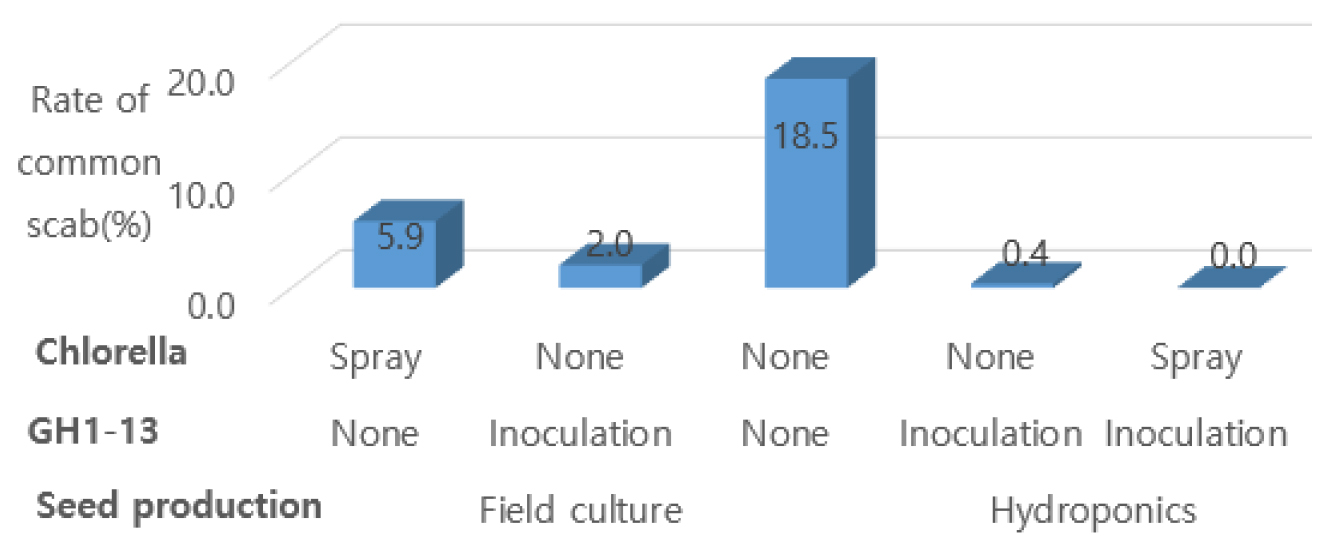
Fig. 2는 GH1-13 균주와 클로렐라 처리에 따른 수확기 괴경의 더뎅이병 이병율을 나타낸 것이다. 토경 씨감자에 GH1-13을 침지처리하면 무접종 보다 더뎅이병 이병율은 16.5%가 낮았고, 클로렐라를 엽면 살포하면 무살포 대비 더뎅이병 이병율은 12.6%가 낮았다. 수경 씨감자에 GH1-13을 침지하여 파종한 다음 경엽에 클로렐라를 엽면 살포하면 더뎅이병에 이병된 씨감자는 발견되지 않았다.
바실러스는 non-ribosomal peptide synthetase (NRPS)와 polyketide synthase (PKS)를 이용하여 관련된 여러 항생제뿐만 아니라 다양한 휘발성 물질 등을 생산하여 식물의 생장을 촉진하고 병 저항성을 강화시켜 병 방제에도 효과가 있는 것으로 알려져 있다 (Ongena and Jacques, 2008; Insam and Seewald, 2010; Raaijmakers et al., 2010; Chowdhury et al., 2015). 일반적으로 오이 (Cucumis sativus) 균핵병을 방제하는 Bacillus sp. M27 균주와 벼 (Oryza sativa)의 생육촉진과 발병을 억제시키는 Bacillus vallismortis EXTN-1 등이 알려져 있다 (Park et al., 2006; Lee et al., 2013).
본 실험에 사용된 GH1-13 균주는 다양한 작물에 병을 일으키는 것으로 알려진 Cercospora capsici (갈색무늬병균), Phytophthora capsici (역병균), Sclerotinia sclerotiorum (균핵병균), Colletotrichum acutatum (탄저병균), Alternaria alternata (검은곰팡이병균), Botrytis cinerea (잿빛곰팡이병균), Fusarium oxysporum (뿌리썩음병균), Streptomyces scabiei (더뎅이병균), Clavibacter michiganensis (궤양병균), Pectobacterium carotovorum (무름병균)에 대한 생육 억제 활성을 보였다고 하였다 (Kim et al., 2016b). 향후 씨감자 생산외에도 씨생강, 씨고구마, 딸기묘 생산에서 GH1-13의 활용을 기대할 수 있겠다.
균주처리와 씨감자 무름병 발생
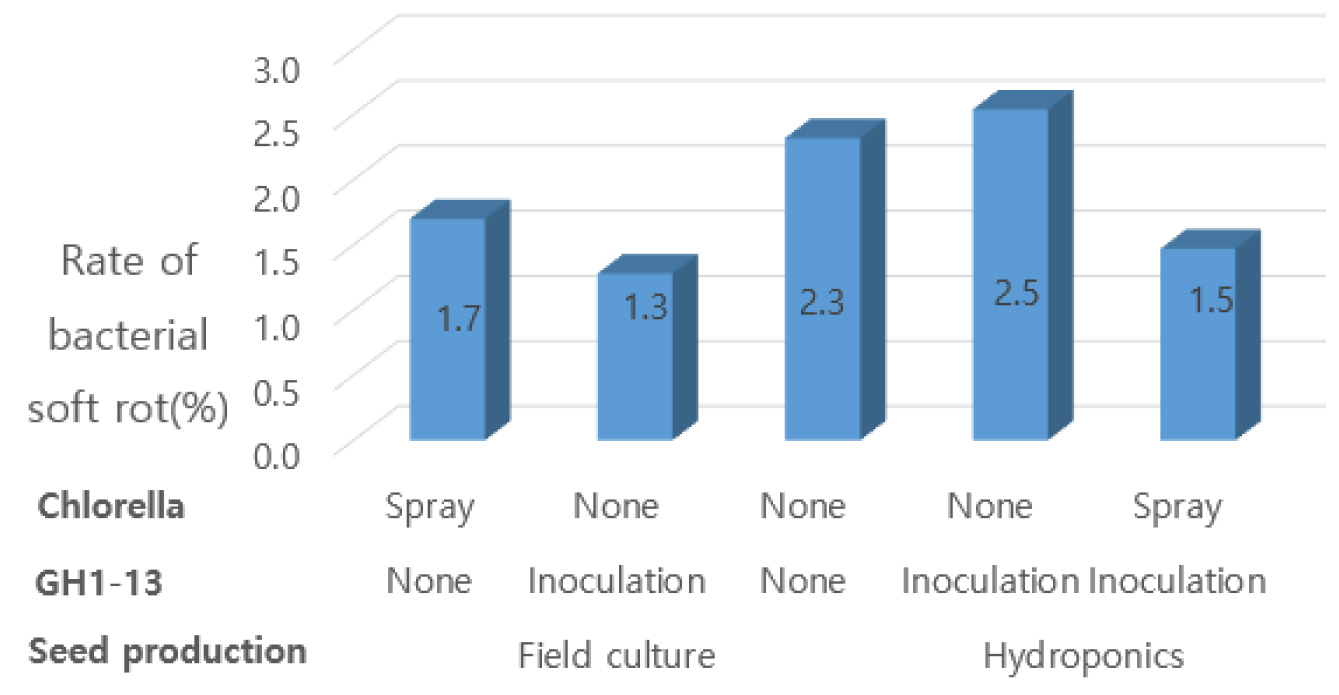
Fig. 3은 GH1-13과 클로렐라 처리에 따른 씨감자의 무름병 이병율을 나타낸 것이다. 토경 씨감자에 GH1-13을 침지처리하면 괴경의 무름병 이병율은 1.28%로서 무처리 보다 1.04%가 낮았으며, 클로렐라 경엽 살포의 무름병 이병율은 1.7%로서 무처리 보다 0.62%가 낮았다.
Kim et al. (2016a)은 병원균 접종 12시간 후 클로렐라 배양액 처리에 의해서 자스몬산, 에틸렌, 앱시스산 등의 식물 호르몬 기작과 식물 면역반응에 관련된 PDF1.2, FMO1, LUBP1 등의 유전자의 발현이 증가하였고, CRK 6, 7, 23 등의 CRK gene과 RLP20 등의 수용체 키나아제 관련 유전자가 많이 발현하였다고 하였다. 또한 클로렐라 병 저항성 유도 물질은 클로렐라 세포가 아닌 상등액 내에 존재하며, 직접적으로 DC3000을 죽이지 않고 식물의 면역을 유도한다고 하였다.
Fig. 3에서 수경 씨감자를 GH1-13 침지 + 클로렐라 경엽 살포는 GH1-13 침지 + 클로렐라 무살포 보다 무름병 이병율은 1.07%가 낮아서, GH1-13 균주와 클로렐라의 복합처리 효과가 인정되었다.
균주처리와 씨감자 수확 개체수
토양에서 생산된 감자를 종서로 사용할 때는 조각을 내되, 개별 씨감자의 무게는 30 - 40 g 정도가 적당하다고 한다. Yoo et al. (2014)은 30 - 330 g의 감자를 규격품으로 선별하여 4 - 5°C의 저장고에 저장하여 씨감자용 기본식물로 이용했다고 한다. 이를 기준으로 씨감자의 생산 개체수를 평가한 결과는 Table 2와 같다.
생산가치가 없는 30 g 미만의 감자생산 개체수를 비교해 보면, 토경 씨감자 재배에서는 GH1-13 침지처리가 ha당 4,111개로써 무처리 보다 2,333개가 많았으며, 반대로 클로렐라의 경엽 살포는 무처리 보다 556개가 적었다. 수경 씨감자에 GH1-13 침지처리 + 클로렐라 엽면살포는 GH1-13침지 + 클로렐라 무살포 보다 30 g 미만 씨감자 수가 778개가 적었다.
씨감자의 규격품인 30 - 330 g의 생산개체수를 비교해 보면, 토경 씨감자 재배에서는 GH1-13 침지처리는 무처리 대비 5,000개가 많았으며, 클로렐라 경엽처리는 무처리 보다 2,667개가 많았다. 수경 씨감자에서 GH1-13침지 + 클로렐라 경엽살포에서 30 - 330 g의 감자생산 개체수는 25,889개로써 GH1-13 침지 + 클로렐라 무살포 보다 556개가 많았다.
330 g 이상 감자의 생산 개체수를 비교해보면, 토경 씨감자에 GH1-13 침지처리는 무처리와 차이가 없었으며, 클로렐라 엽면살포는 1,222개로써 무살포 보다 556개가 많았다. 수경 씨감자 재배에서 클로렐라 경엽살포에 따른 괴경 생산 개체수는 무살포와 차이가 없었다.
감자의 총 괴경수를 비교해보면, 토경 씨감자 재배에서 GH1-13침지 처리는 29,778개로써 무침지 처리보다 7,333개가 많았고, 클로렐라 엽면살포는 2,667개가 많았다. 수경 씨감자 재배에서 GH1-13침지 + 클로렐라 엽면살포는 GH1-13침지 + 클로렐라 무살포 보다 222개가 적었다.
이상의 결과를 요약하면 규격품인 30 - 330 g의 씨감자 생산에서 GH1-13는 물론 클로렐라의 단독처리효과가 인정되었으며, 두 미생물제의 복합처리 효과도 인정된 것으로 나타났다. 향후 유용 미생물을 활용한 씨감자 생산기술의 체계화를 위해서는 활용가치가 없는 30 g 미만의 감자 개체수는 줄이고 30 - 330 g의 규격 씨감자의 생산개체수를 늘리는 기술개발과 기작 구명에 대한 연구가 더 필요하다고 본다.
Table 2.
Effect of inoculation of Bacillus velezensis GH1-13 and spraying Chlorella vulgaris on distribution of potato fresh weight.
균주처리와 씨감자 수량
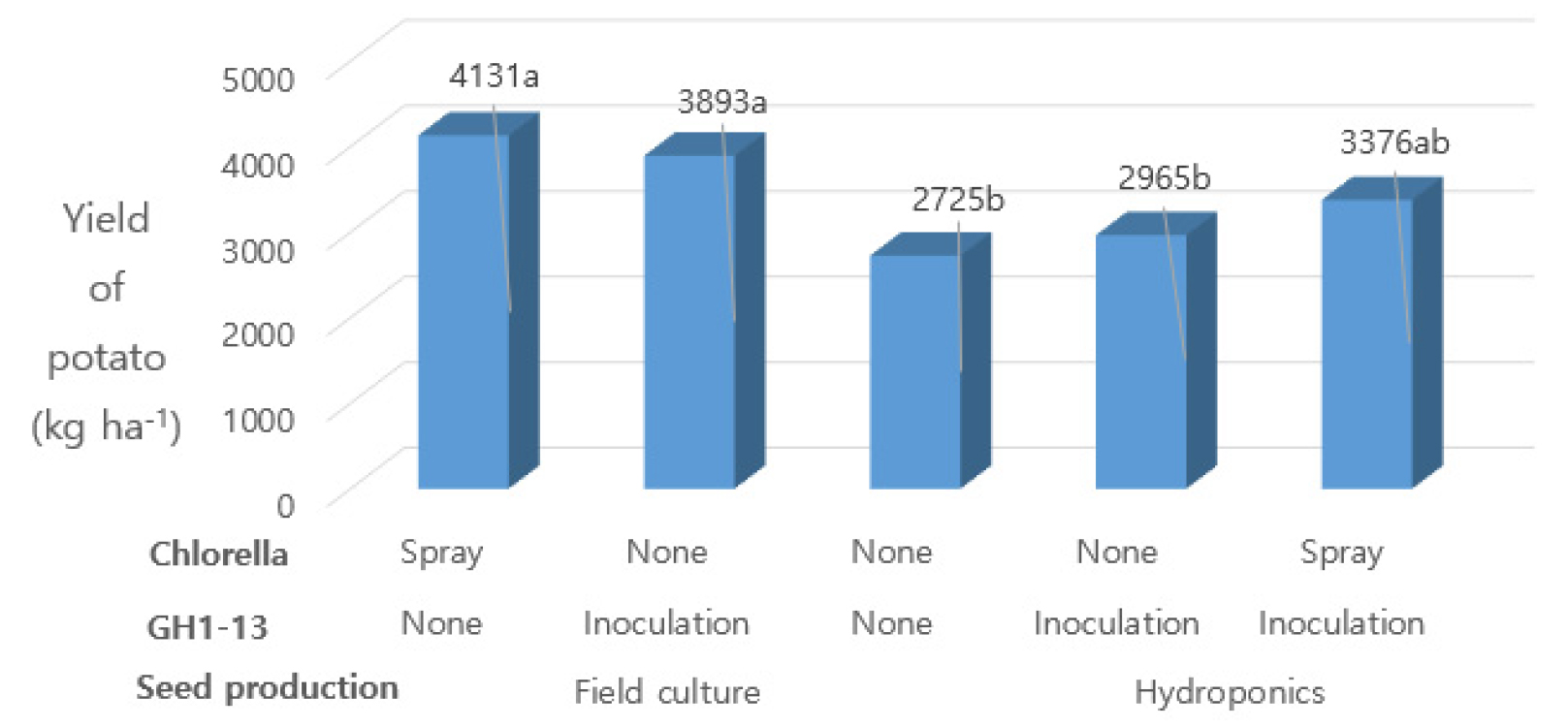
Fig. 4는 더뎅이병과 무름병에 이병 개체를 제외한 외관상 건전한 씨감자의 수량을 나타낸 것이다. 토경 씨감자 재배에서 GH1-13 침지 + 클로렐라 무살포 처리의 씨감자 수량은 ha당 3,892.9 kg으로서 GH1-13 무침지 대비 1,167 kg이 많았고 통계적 유의차이도 인정되었다. 또한 클로렐라 경엽살포도 무처리 대비 ha당 1,405.6 kg이 증수되었으며 통계적 유의차도 인정되었다.
GH1-13 균주를 침지한 수경 씨감자 재배에서 클로렐라 경엽 살포는 무살포 대비 씨감자 생산량은 ha당 412 kg이 늘었으나, 통계적 유의차는 없었다.
우리나라의 씨감자는 기후특성상 노지상태에서 여름재배가 가능한 고랭지에서 기본식물-원원종-원종-보급종의 4단계 생산체계로 씨감자를 생산하고 있다. 강원도 대관령 소재의 농촌진흥청 국립식량과학원 고령지농업연구소는 무병묘를 조직배양하여, 이를 분양받은 시 ‧ 군 농업기술센터는 조직배양과 수경재배를 통해 기본종 (基本種)을 생산하고 이를 토양에서 증식하여 기본식물 (基本植物)을 생산하여 농가에 씨감자를 공급하고 있다.
한편, 농촌진흥청이 개발한 유용 미생물 균주도 시 ‧ 군 농업기술센터에서 배양되어 농가에 유 ‧ 무상으로 공급되고 있다. 농업기술센터에서는 씨감자 외에도 씨고구마, 씨생강, 씨마늘 등 영양번식작물의 종묘를 증식하여 농가에 공급하고 있다. 우량종묘의 생산사업의 효율성 향상은 국가적 과제인 식량안보 확보나 지역적 과제인 농업생산성 향상에 매우 중요한 과제이다. 유용미생물을 활용한 영양번식 작물의 종묘생산에 대한 체계적인 기술과 정책 사업의 개발이 필요하다고 본다.
Conclusions
본 연구는 씨감자 생산성을 향상시키고자 Bacillus velezensis GH1-13 균주와 클로렐라 균주 (Chorella vulgaris, CHK0008)의 처리효과를 규명하고자 수행되었다. 토경 씨감자와 수경 씨감자를 Bacillus velezensis GH1-13 균주에 침지 처리하여 감자를 파종 5주후 Chlorella sp.를 경엽에 살포한 다음 씨감자의 더뎅이병과 무름병 이병율, 괴경수, 감자 수량을 조사한 결과는 다음과 같다.
토경 씨감자 재배에서 GH1-13 균주의 침지처리는 무처리 대비 괴경의 더뎅이병 발생율은 16.5% 낮추었고, 무름병 발생율도 1.0% 낮추었다. GH1-13을 침지한 수경 씨감자 재배에서 클로렐라의 경엽살포는 더뎅이병 이병율을 12.6% 낮추었고, 무름병 이병율도 1.1%를 낮추었다.
씨감자 규격품인 30 - 330 g의 생산 개체수를 비교해보면, 무처리 대비 토경 씨감자에 GH1-13 침지처리는 ha당 5,000개가 많았고, 클로렐라 경엽살포는 2,666개가 많았다. 또한 수경 씨감자에서도 클로렐라 경엽 살포로 씨감자 생산 개체수는 ha당 555개가 많았다.
토경 씨감자를 GH1-13에 침지하면 무접종 대비 수량은 ha당 1,167 kg이 많았고, 클로렐라 경엽 살포는 무살포 대비 씨감자 수량을 ha당 1,405 kg을 늘렸다. 수경 씨감자에 GH1-13 침지 처리한 다음 경엽에 클로렐라를 살포하면 무살포 대비 씨감자 생산량은 ha당 412 kg가 늘었다.
이상의 결과와 같이 GH1-13과 클로렐라 처리는 씨감자 생산에서 더뎅이병과 무름병 방지효과와 수량증대 효과를 얻을 수 있었으며, 향후 동 미생물의 처리시기와 처리농도 등에 대한 체계적이고 실용적인 연구강화가 필요한 것으로 나타났다.