Introduction
Materials and Methods
시료 채취
토양 정화 실험
토양 화학성 분석
토양 호흡 및 효소 활성 분석
통계 분석
Results and Discussion
토양 화학성 분석 결과
토양 호흡 분석 결과
토양 효소 활성 분석 결과
Conclusions
Introduction
유류 유출로 인한 토양 오염은 전 세계적으로 토양을 오염시키는 주요 오염원으로 알려져 있다 (Nadim et al., 2000). 유류의 대부분은 물에 잘 용해되지 않는 소수성 물질로 토양에 유출되면 강한 흡착 및 공극 내에 남아 오랜 기간 잔류하면서 주변 환경을 오염시킨다 (Pankow and Cherry, 1996). 유류 중 토양으로 유입된 석유계총탄화수소 (total petroleum hydrocarbons, TPH)는 토양 내 오랜 기간 잔류하는 오염물질로 작물의 생육을 저해하고 인체의 영향을 미치는 물질로 총 탄소수가 8 - 20에 해당되는 화학물질이며, 현재 우리나라의 경우 토양환경보전법에 의해 TPH는 토양오염우려기준 2,000 mg kg-1, 토양오염대책기준 5,000 mg kg-1로 규정하여 관리되고 있다 (Jung, 2003; Nwankwegu and Onwosi, 2017). 우리나라의 경우 유류 소비가 꾸준히 증가하고 있으며, 주유소와 유류 및 화학물질을 저장하고 있는 지하저장탱크에서 오염물질 유출로 인한 여러 지역의 토양 및 지하수 오염이 발견되면서 유류 오염에 대한 문제가 발생되고 있다. 특히, 토양환경보전법 제정 이전부터 운영되던 철도 차량 기지들은 부지 내 대부분의 지역이 대단위 매립장, 철도 정비 장소 등으로 이용되어 왔으며, 이로 인한 국내 철도 차량기지 및 철도시설 부지의 토양오염실태조사에 따르면 토양오염이 발견되고 있다 (MOE, 2013). TPH로 오염된 토양의 정화 방법으로는 물리적 (굴착, 복토, 고형화, 분쇄, 열분해 등), 화학적 (산화, 중화, 이온 교환, 계면활성제 등) 생물학적 (토양 경작, 식물 정화, Biopiles 등)으로 나눌 수 있으며, 처리하는 장소에 따라서는 현장에서 이루어지는 원위치 (in-situ), 현장에서 떨어져서 진행되는 비원위치 (ex-situ)로 나뉜다 (Mann, 1999; Khan et al., 2004; Besalatpour et al., 2011; O’Brien et al., 2017). 비원위치 (ex-situ) 정화 공법의 경우 오염된 지반을 굴착하여 정화하므로 관리가 용이하고 처리효과를 직접 확인할 수 있어 처리 효율성은 높으나, 경제적 비용이 과다하게 발생하거나 도심지역 및 주변 환경에 의한 장소 제한 및 굴착으로 인한 주변에 영향을 미칠 수 있다는 단점을 지니고 있다. 반면, 원위치 (in-situ) 정화 방법은 비원위치 (ex-situ)에 비해 경제적으로 효율적이며, 친환경적이다 (Wilson and Brown, 1989). 주로 현장에 적용하기 위해 과황산 (persulfate, H2SO4), 과산화수소 (hydrogen peroxide, H2O2), 오존 (ozone, O3) 등의 산화제를 활용하는 화학적 산화처리 방법에 대한 연구가 많이 진행되고 있다 (Ji et al., 2001; Brown et al., 2003; Huang et al., 2005; Sirguey et al., 2008). 토양 정화에 대한 선행 연구들은 오염 물질 제거 효율 및 정화 이후 토양의 이화학적 특성 변화 등에 대한 연구가 주로 이루어지고 있으며, 정화 이후 토양 호흡 및 토양 효소 활성과 같은 생물학적 변화 특성에 대한 연구는 부족한 실정이다. 토양의 생물학적 특성인 토양 호흡 및 효소 활성은 토양 내 생화학적 반응을 촉진시켜 토양 내 영양분의 순환에 관여하며 이를 통해 비옥도를 증진시키는 중요한 역할을 한다 (Bandick and Dick, 1999; Gil-Sotres et al., 2005). 또한, 토양질의 생물학적 및 생화학적 지표로써 활용되고 있어 이를 통해 선행 연구에서는 토지이용에 따른 생물학적 특성, 논토양의 토양질을 평가하였다 (Dick, 1994; Alkorta et al., 2003; Hong et al., 2021, 2022). 본 연구의 목적은 TPH로 오염된 토양의 산화 방법을 활용하여 정화한 후 토양의 화학적 특성뿐만 아니라 토양 생물학적 특성 분석을 통해 TPH로 오염된 토양 및 정화 토양에서 종합적인 토양 특성의 변화를 파악하는 데 있다.
Materials and Methods
시료 채취
시험을 위한 시료 채취는 유류 오염 정화 사업이 진행되고 있는 경기도 의왕시 소재의 철도차량기지에서 실시하였으며 부지 내 TPH 오염 원인으로는 급유 및 저장시설에서의 유출로 인해 발생하였다 (Oa and Lee, 2009). 토양 시료 채취는 토양오염공정시험기준 (ES 07130. B)과 농촌진흥청 토양화학분석법 (NAAS, 2010)을 참고하였으며, 시료의 균질성을 위해 채취 지점을 오염원 면적 내 10곳을 선정하여 채취하였다. 시료 채취 방법은 Geoprobe 장비를 이용하여 채취하였으며, 토양 깊이는 표층에서 0 - 1.0 m의 깊이에서 채취하였다. 채취한 토양은 폴리에틸렌 지퍼백에 담아 Ice box에 보관 후 연구실까지 이동하였으며, 냉장 보관 (4°C 이하) 후 실험에 사용하였다.
토양 정화 실험
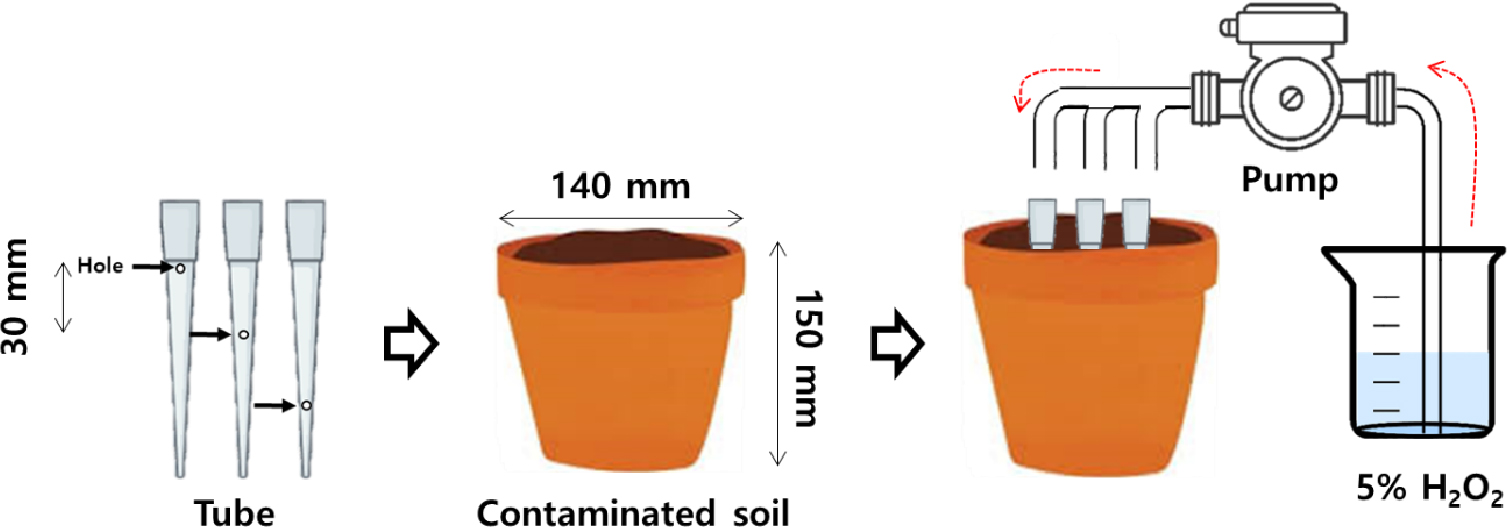
균일한 토양을 활용하기 위해 채취한 토양을 5 mm 체로 체거름 하여 사용하였으며, 정화 실험에 대한 모식도는 Fig. 1에 나타냈다. 오염 토양 2.0 kg을 용기 (h 150 mm, Ø 140 mm)에 채운 후, 구멍이 뚫린 튜브 (h 120 mm, hole 간격 30 mm, hole size Ø 2 mm)를 토양이 담긴 용기 내 삽입하였다. 본 연구에 사용된 산화제는 Bajagain et al. (2018)의 연구 결과에 따르면 3, 5, 10%의 과산화수소 중 5% 과산화수소의 저감율이 가장 효율적인 것으로 보고 된 바 있어 5% 과산화수소 (H2O2, 30%, SAMCHUN)로 선정하였으며, 정량펌프 (Masterflex L/S cartridge pump 7519-06, Vernon Hills, IL, USA)를 활용하여 0.6 mL min-1의 속도로 주입하였다. 투입된 토양에 대해 용적밀도 (1.55 g cm-3)와 공극률 (41.5%)로 1 pore volume을 산출하여 24시간 기준으로 주입속도를 산출하였다. 본 연구에서는 정화과정에 따른 특성 변화를 비교하기 위해 0, 3, 7, 11일 간격으로 반응시킨 후 시료를 채취하여 분석을 진행하였다.
토양 화학성 분석
토양 pH와 전기전도도 (electrical conductivity, EC)는 토양과 증류수의 비를 1:5 (w/v)로 하여 진탕기 (JSOS-500, JSR, Tokyo, Japan)를 이용하여 30분간 진탕한 후 각각 pH meter (Orion Star™ A111, Thermo Fisher Scientific, Waltham, MA, USA)와 EC meter (SevenCompact™ Conductivity Meter S230, Mettler Toledo, Columbus, OH, USA)를 활용하여 측정하였다. EC의 결과값은 희석배수 (×5)를 고려하여 결과 값을 나타냈다. 토양유기물함량 (soil organic matter, SOM)은 Walkley & Black법으로 하였고, 유효 인산 (available P2O5, Av. P2O5)은 Bray No. 1 방법으로 추출하여 몰리브덴 청법으로 정량 하였으며, UV/Vis Spectrophotometer (UV-1800, SHIMADZU, Tokyo, Japan)로 측정하였다. TPH는 토양오염 공정시험기준 (KSTM ES. 07552)에 따라 초음파 추출기를 활용하여 methylene chloride 용매로 추출한 뒤 농축 후, GC-FID (gas chromatograph-flame ionization detector, 7890A, Agilent, Santa Clara, CA, USA)를 이용하였다. Column은 Agilent의 DB-5 HT (30.0 m × 0.32 mm × 0.1 µm)를 사용하였으며, 오븐 설정은 초기 온도 40°C에서 1분에 8°C씩 290°C까지 승온시켰다. 주입구와 검출부 온도는 각각 300°C, 315°C로 설정하였으며, N2 gas flow rate는 30 mL min-1으로 split ratio는 15:1로 설정하여 TPH 함량을 분석하였다.
토양 호흡 및 효소 활성 분석
토양의 생물학적 특성 분석은 습토를 활용하기 위해 시료 채취 후 4°C에서 냉장 보관하였으며, 토양미생물실험법 (Yang and Kim, 2002)과 Methods of soil analysis, Part 2: Microbiological and biochemical properties (Weaver et al., 1994)를 참고하여 수행하였다. 토양 호흡 분석은 300 mL의 bottle에 습토 100 g을 취한 후, 0.5 M NaOH를 Vial에 넣어 bottle 안에 넣어준 후 밀봉하여 25°C에서 72시간 배양하였다. 배양 후 0.5 M NaOH을 비커에 옮긴 후 phenolphthalein을 지시약으로 1.0 M HCl을 활용하여 보라색에서 무색으로 변할 때까지 적정 하였고, Bromocresol green을 지시약으로 0.2 M HCl로 푸른색에서 노란색으로 변할 때까지 적정한 후 이 때, 소모된 양을 CO2 발생량으로 환산하여 산출하였다. β-glucosidase (Glu)의 활성도를 측정하기 위하여 Eivazi and Tabatabai (1988)의 분석법을 참고하였다. 토양시료를 centrifuge tube에 담은 뒤, toluene, citric phosphate buffer (pH 4.9), 증류수 및 50 mM ρ-nitrophenyl-D-glucopyranoside (PNG)를 첨가하였다. 이후 배양기를 이용하여 30°C에서 1시간 배양하였으며, 배양이 완료된 뒤 이후 UV/Vis Spectrophotometer를 이용하여 400 nm 파장에서 비색 정량 하였다. Phosphatase (PHA)의 활성도는 토양 시료에 toluene, 0.5 M Tris (tris (hydroxymethly) aminomethane), 증류수와 50 mM ρ-nitrophenyl-phosphate (pNPP)를 넣고 30°C에서 1시간 배양한 뒤, ethanol을 넣고 여과하였다. 여과액에 2 M tris를 넣고 UV/Vis Spectrophotometer를 이용하여 400 nm 파장에서 비색 정량 하였다. Dehydrogenase (DHA)의 경우 토양시료와 CaCO3를 1:10 (w/w) 비율로 혼합 후, 2,3,5-triphenyltetrazolium chloride (TTC)와 증류수를 넣어 밀봉하여 37°C에서 24시간 배양하였다. 배양 후 Methanol을 넣은 후, 탈지면으로 막은 Funnel에 혼합물을 탈지면의 붉은색이 없어질 때까지 지속적으로 Methanol을 넣어 여과하였다. 100 mL volumetric flask의 표선까지 methanol을 채운 후 UV/Vis Spectrophotometer으로 파장 485 nm에서 측정하였다. Urease (URE)의 활성도는 Kandeler and Gerber (1988)의 분석법을 참고하였다. 먼저 100 mL 삼각 플라스크에 토양시료를 넣은 뒤 79.9 mM Urea를 가하여 37°C에서 2시간 동안 배양하였다. 배양 후 증류수, 2.0 M KCl를 첨가한 뒤 30분간 교반 후 여과하였으며, 여과액을 취하여 0.3 M NaOH, sodium salicylate solution 및 증류수를 혼합하여 조제한 시약을 넣은 후 30분 동안 교반 후 690 nm 파장에서 측정하였다.
통계 분석
모든 분석 실험은 3회 반복 수행하여 평균과 표준편차 값으로 표시하였으며, 분석 결과를 비교하기 위해 Statistical package for social science (SPSS) version 26.0 (SPSS Inc., Chicago, IL, USA)을 활용하여 일원분산분석 (one-way ANOVA)을 신뢰성 95% 수준으로 검증하였다.
Results and Discussion
토양 화학성 분석 결과
본 연구에서 활용한 TPH 오염토양에 대한 화학적 특성 분석 결과는 Table 1에 정리하였으며, TPH로 오염된 토양에서 5% 과산화수소 (H2O2)를 이용한 정화 효율 및 토양 화학성 분석 결과를 Fig. 1과 Fig. 2에 나타냈다. 초기 오염 토양의 TPH 농도 분석 결과 5,617 mg kg-1로 3지역 토양오염 우려 기준인 2,000 mg kg-1을 상회하는 것으로 나타났다. 이후 정화 과정 중 TPH 농도는 3일과 7일, 11일차 각각 3,307 mg kg-1-1, 3,826 mg kg-1, 1,977 mg kg-1로 변화하였다 (p < 0.05). TPH 농도는 7일차에 증가하였으나 최종 수행 기간 동안 점차 감소하는 경향을 나타냈으며, 최종 11일차에는 3지역 기준치인 2,000 mg kg-1이하 까지의 저감을 보였으며, TPH 제거 효율은 64.8%이었다. 과산화수소 (H2O2)를 이용한 TPH 오염 토양의 정화 방법은 과산화수소 (H2O2)의 산화에 의해 유기화합물과 강력하게 반응하여 Eq. 1과 같은 과정을 통해 토양으로부터 유기오염물질이 제거된다 (Kong et al., 1998). 또한, 토양 내에는 일반적으로 0.5 - 5 wt% 철 (Fe)이 존재하는데 과산화수소 (H2O2)는 2가 철 (Fe2+)을 촉매로 Fenton reaction을 일으켜 그 과정에서 발생되는 hydroxyl radical (OH∙)의 강한 산화력으로 인해 TPH가 저감될 수 있다 (Kong et al., 1998). 정화기간에 따른 토양 일반분석 결과는 Fig. 3에 나타냈다. 토양 pH 분석 결과 초기 오염 토양의 pH는 8.47이었다. 정화 과정동안 토양의 pH는 3일차에 8.29로 감소하였으나, 다시 7일차에 8.46으로 증가하였으며, 최종 정화토양에서는 8.21로 전체적으로 반응기간에 따라 감소하는 경향을 나타냈다 (p < 0.05). 이는 Fenton 반응에 의해 오염물질이 중간 산화 생성물로 전환되면서 토양 내 pH가 낮아진 것으로 선행 연구와 비슷한 경향을 보였다 (Huling and Pivetz, 2006; Arroyo et al., 2021). 정화 처리 전 오염 토양의 EC는 0.44 dS m-1이었으며, 정화 과정 중에서는 각각 0.30 dS m-1 (3일), 0.31 dS m-1 (7일), 0.31 dS m-1 (11일)로 통계적으로 유의한 차이를 보이지 않았다 (p > 0.05). 토양 유기물 함량 (SOM)은 초기 함량인 2.14%에서 과산화수소와의 반응 기간이 늘어날수록 증가하였으며 (p < 0.05), 11일에 토양 유기물 함량이 3.46%로 초기 함량에 비해 38.1% 증가율을 보였다. 이는 다른 정화 방법인 토양경작 방법 활용한 연구에서 초기 10일 이내에 오염물질이 분해되면서 유기물 함량이 증가한 것으로 보고된 바 있다 (Park et al., 2022).
Table 1.
TPH concentration and physiochemical properties of the experiment soil.
토양 호흡 분석 결과
TPH의 정화 과정 중에서의 토양 호흡량 분석 결과를 Fig. 4에 나타냈다. 토양 호흡량은 0일차에서 63.8 CO2 mg kg-1 day-1로 나타났으며, 3일차에 98.5 CO2 mg kg-1 day-1로, 7일차에는 114.7 CO2 mg kg-1 day-1로, 11일차에는 153.5 CO2 mg kg-1 day-1로 통계적으로 유의하게 증가하였다 (p < 0.05). 토양 호흡량은 토양 내 미생물 활동에 대한 지표로 널리 사용되어 왔으며 (Alef and Nannipieri, 1995), 화학적 산화 공정인 H2O2를 이용한 정화과정 중 유기오염물질 (TPH)이 산화반응에 의해 분해되면서 토양 유기물 함량이 증가하고 이로 인해 토양 미생물 활동이 높아져 토양 호흡량이 증가한 것으로 보인다 (Balogh et al., 2011; Park et al., 2022).
토양 효소 활성 분석 결과
본 연구에서는 토양 내 β-glucosidase (Glu), dehydrogenase (DHA), phosphatase (PHA), urease (URE)의 활성을 분석하였으며 그 결과는 Fig. 5에 정리하였다. β-glucosidase는 토양 내 cellulose의 분해에 관여하는 효소 중 하나이며, 토양 내 유기물을 분해함으로써 양분 순환에 큰 역할을 한다 (Turner et al., 2002). 본 연구 결과에서 오염 토양의 Glu활성은 0.43 µmol PNP g-1이었으며, 정화 3일차에는 0.74 µmol PNP g-1로 증가하였다. 이후 7일차 및 11일차에는 다시 감소하여 각각 0.50 µmol PNP g-1, 0.52 µmol PNP g-1로 나타났으나, 11일 동안의 Glu활성은 통계적으로는 유의미한 차이를 보이지 않았다 (p > 0.05). 이는 다양한 정화 방법을 통해 TPH 농도는 저감되었으나 Glu 활성에 영향을 미치지 않는다고 보고된 바 있다 (Yi et al., 2013; Dindar et al., 2015; Kim et al., 2022). 토양 내 PHA의 활성은 초기 오염 토양에서 1.70 µmol PNP g-1이었으며, 정화 3일, 7일차에는 각각 1.88 µmol PNP g-1 및 1.86 µmol PNP g-1로 증가하였다가 11일차에는 다시 1.62 µmol PNP g-1로 감소하는 결과를 보였지만, 통계적으로 유의한 차이를 보이지 않았다 (p > 0.05). 이는 토양 내 유효인산 함량이 정화 기간에 따라 3.76 - 5.78 mg kg-1로 변화가 없었으며, 이로 인해 PHA 활성도 차이가 없는 것으로 보인다. 또한, Glu 활성과 같이 유류오염물질 농도가 PHA 활성에 영향이 미치지 않는다고 보고 된 바 있기에 TPH 농도 감소에 따른 PHA 활성 차이가 없는 것으로 판단된다 (Turgay et al., 2010). Dehydrogenase 활성은 0일차에 5.65 TPF µg-1로 가장 높았으나, 그 이후로는 감소하여 3일, 7일, 11일 각각 3.33 TPF µg-1, 3.78 TPF µg-1, 2.31 TPF µg-1으로 나타났다 (p < 0.05). Alrumman et al. (2015) 연구에 따르면 정화기간에 따라 TPH에 의한 독성 감소로 인해 DHA 활성이 증가하였다. 본 연구 결과인 DHA활성 감소에 대한 원인은 명확하지 않지만, 정화과정 중 토양 pH가 감소하여 DHA 활성이 감소한 것으로 판단된다 (Cooper and Warman, 1997). 마지막으로 토양 urease 활성은 오염 토양에서 125.7 µg NH4-N g-1 2 h-1로 가장 활성이 높았으며, 3일차 74.5 µg NH4-N g-1 2 h-1, 7일차 35.8 µg NH4-N g-1 2 h-1, 11일차 55.0 µg NH4-N g-1 2 h-1으로 통계적으로 유의미한 감소를 보였다 (p < 0.05). 정화 방법 중 토양경작을 적용한 연구 결과에 따르면 URE는 요소를 탄소와 암모니아로 가수분해하는데 관련된 효소로 정화과정이 진행되면서 토양 내 존재하는 요소 (N)의 부족 현상으로 인해 URE 활성이 감소되는 것으로 보고된 바 있다 (Besalatpour et al., 2011; Bae et al., 2021).
Conclusions
본 연구에서는 산화제 (H2O2)를 이용한 TPH 오염 토양의 정화 과정 중 토양의 화학적 및 생물학적 특성을 평가하고자 하였다. 총 연구 기간인 11일 동안 토양 내 TPH는 64.8%의 저감율을 보였으며, 3지역 기준치인 2,000 mg kg-1이하 까지의 저감을 보였다. 토양 내 pH는 반응 기간이 길어질수록 감소하는 경향을 보였으며, 반면, 토양 미생물 활성에 따른 토양 호흡량의 지속적인 증가를 보여 오염토양 기준 58.4% 증가율을 보였다. 4가지의 토양 효소 분석 결과 11일 동안 β-glucosidase 및 phosphatase 활성은 큰 차이를 보이지 않았으며, dehydrogenase 및 urease의 활성은 정화 과정이 진행됨에 따라 오염토양 기준 각각 59.0, 56.3%정도 감소하는 경향을 보였다. 이는 정화 과정 중 토양 내 pH 감소와 요소 (N)의 부족으로 인한 것으로 보인다. 본 연구는 H2O2를 이용한 TPH의 산화적 정화 과정을 소규모로 구현한 결과이며, 정화 과정 이후 토양 내 화학적 및 생물학적 특성의 변화를 자세하게 파악하기 위해서는 다양한 조건의 연구가 필요할 것으로 판단된다.