Introduction
Materials and Methods
액비 제조 재료 및 미생물 배양
A. thiooxidans, 바이오 황 현탁액 및 골분의 혼합 비율
Results and Discussion
골분액비 현탁액의 pH 변화
골분액비 현탁액의 가용화된 인산 함량
Conclusions
Introduction
유기농업에서 양분 관리는 주로 퇴비, 녹비 및 유기질 비료 등을 통해 이루어지고 있다. 그러나 유기 재배 농가에서는 작물의 부족한 양분을 보충하기 위해 다양한 유기질 자재로 액비를 제조하여 관주 및 엽면시비용으로 사용하고 있다 (An et al., 2011). 많은 연구자들에 의해 유기농업에서 수확량을 증가시키고 작물에 필요한 양분을 균형있게 공급하기 위해 액비의 제조방법, 화학적 및 미생물학적 특성, 시용 효과 등에 대한 연구가 이루어졌다 (Joo et al., 2001; Lee et al., 2004; Choi et al., 2008; An et al., 2014). 액비 중에서도 인산을 작물에 공급하기 위해 골분액비를 제조하여 사용하고 있으나 골분액비의 인산 전함량은 0.4% 이하 (An et al., 2014)로 골분 (P2O5 22.6%)의 인산 전 함량의 약 0.02%가 용해되었다. 이 또한 식물이 직접 흡수할 수 있는 수용성 형태가 아니므로 수용성 인산 함량은 더 낮을 것으로 예상된다. 따라서 골분을 액비로 제조하기 위해서는 무기화 과정을 촉진할 수 있는 미생물 선발이 필요하다.
A. thiooxidans는 호기성 환경에서 성장하는 독립영양균으로 순수 황 및 환원된 황을 산화시켜 성장에 필요한 에너지를 얻고, 생물학적으로 황산을 생성하여 배양액의 pH를 1.5 - 2.5까지 낮춘다 (Lee et al., 2006; Han et al., 2009; Ullah et al., 2013; Saeid et al., 2014). 생물학적으로 황산을 생성할 수 있는 황산화균 (Acidithiobacillus thiooxidans)은 액비 발효과정 중에 생성되는 유기산보다 골분액비의 무기화를 촉진시킬 수 있을 것으로 기대된다. 인광석에 황산을 반응시켜 인산 비료를 화학적으로 제조하는 방법과 유사하게, Rajan (1983)과 Chi et al. (2006)은 황의 박테리아 (Acidithiobacillus sp.) 산화 과정에서 생성된 황산으로 인해 인광석에서 가용성 인산이 증가했다고 보고하였고, Bhatti and Yawar (2010)은 A. thiooxidans과 A. ferrooxidans을 황이 70% 함유된 진흙 (sulfur-mud)에 접종하여 인광석을 용해시켰을 때, 인광석의 최대 인산 가용화율은 565 mg P2O5 L-1 d-1이라고 보고하였다.
미생물학적 용출법에서는 Acidithiobacillus sp.의 에너지원으로 대부분 순수 황이 이용되었으나 (Han et al., 2009; Xiao et al., 2011; Priha et al., 2014), 황철석 (Chi et al., 2006)과 sulfur-mud (Bhatti and Yawar, 2010)도 이용되기도 하였다. 에너지원인 황 이외에도 A. thiooxidans 용출 효율은 원소의 종류, 미생물 접종량 등과 같은 요인이 중요한 영향을 미친다 (Gomez and Bosecker, 1999; Lee et al., 2006; Han et al., 2009). 그러나 유기농업에서는 화학물질의 첨가나 화학적 제조공정을 거치지 않은 자재를 사용해야 되므로 미생물학적 용출법을 이용하여 골분액비를 제조하기 위해서는 유기농업에 적합한 황이 필요하다.
바이오 황은 수도권 매립지에서 발생하는 황화수소를 미생물 공법으로 황을 분리하여 현탁액 상태로 생산되며, 곤충에 무해하고 곰팡이병 방제에 효과가 있다고 보고되고 있다 (Ko et al., 2019; Shin et al., 2019; Oh et al., 2020). 그러나 유기농자재인 바이오 황이 유기액비제조에 이용된 연구는 없었다.
본 연구에서는 생물학적 용출법에 의한 바이오 황의 농도, A. thiooxidans 접종량, 골분 첨가량에 따른 인산의 용해도에 미치는 영향을 조사하였다. 이를 통해 관행 액비의 낮은 인산 용해도를 개선하고, 골분액비의 품질을 향상시킬 수 있는 기초 자료를 제공하고자 수행하였다.
Materials and Methods
액비 제조 재료 및 미생물 배양
액비 제조에 사용된 재료는 골분 (제주비료 (주)), 바이오 황 현탁액 (바이오 황, 토탈아그로(주)) 및 황산화균 (A. thiooxidans)을 사용하였다. 골분의 인산 함량은 20.3%이며, 바이오 황 현탁액은 황 50%을 포함하여 약간의 무기 양분이 포함되어 있다 (Table 1). 액비제조 방법이 농업현장에서 쉽게 이용될 수 있도록 제조과정을 단순화하기 위해 골분과 바이오 황 현탁액은 멸균하지 않고 사용하였다.
A. thiooxidans (KCTC 4515)는 한국생명공학연구원 생물자원센터 (KCTC)에서 분양 받았으며, 100 mL 삼각플라스크에 50 mL의 medium 1053 (KCTC Media No. 1053)과 1% 황 (S0)을 넣고 A. thiooxidans를 접종하여 사전 배양하였다. 배양액의 조성은 (NH4)2SO4 0.2 g, MgSO4・7H2O 0.5 g, K2HPO4 3.0 g, FeSO4・7H2O 10.0 mg, CaCl2・2H2O 250.0 mg, 증류수 1,000 mL이며, 배양액 pH는 0.5 M 황산을 이용하여 pH 3.0으로 조절하였다.
미생물 배양은 500 mL 삼각플라스크에 순수 황 10 g L-1를 첨가하여 121°C에서 약 15분간 3회 고압 멸균 후, 멸균한 medium 1053 배양액 200 mL를 clean bench에서 주입하고 사전 배양된 A. thiooxidans 10 mL를 접종하였다. 배양 조건은 25°C의 교반배양기에서 100 rpm으로 20일 동안 호기성 환경에서 배양하였다. 배양된 A. thiooxidans는 미라클로스 (Miracloth, Calbiochem corporation, USA)로 여과하였고, 미생물의 농도는 분광광도계 (Optizen POP, Mecasys, Korea)로 600 nm 파장에서 흡광도를 측정하였다. 본 실험에 접종된 A. thiooxidans의 농도는 6.0 ×108 cells mL-1이었다.
Table 1.
Chemical properties of bone meal and bio-Sulfur suspension used for shake-flask leaching experiments.
| Material | pH |
O.M. (%) |
T-N (%) |
P2O5 (%) |
K2O (%) |
CaO (%) |
MgO (%) |
Na (%) |
T-S (%) |
NO3-N (mg kg-1) |
| Bone meal† | - | 50.4 | 3.13 | 20.3 | 0.32 | 24.2 | 0.94 | - | - | - |
| Bio-S‡ | 8.05 | - | - | 0.00 | 1.11 | 1.62 | 1.26 | 6.55 | 50 | 300 |
A. thiooxidans, 바이오 황 현탁액 및 골분의 혼합 비율
골분에 함유된 인산의 용해도를 높일 수 있는 최적 조건을 결정하기 위해 A. thiooxidans의 접종량, 바이오 황의 농도 및 골분 첨가량에 대해 shake-flask 용출 실험을 통해 수행하였다 (Table 2).
미생물 접종량은 멸균된 250 mL 삼각플라스크에 바이오 황 2%를 넣고 A. thiooxidans를 각각 0%, 5%, 10%, 20% 접종하였다. 미생물의 에너지원으로 사용되는 바이오 황 첨가 효과는 0%, 0.5%, 1%, 2%, 5%를 각각 넣고 A. thiooxidans 10%를 접종하였다. 그리고 멸균수로 최종 부피가 100 mL이 되도록 한 후 25°C 교반배양기에서 120 rpm으로 5일간 배양하여 박테리아로부터 충분한 양의 황산이 생성될 수 있도록 하였다. 5일간 배양 후에 삼각플라스크에 골분 10%을 첨가하여 다시 45일간 배양하였다.
미생물 접종량과 바이오 황 첨가량에 따른 인산의 가용화 효율을 조사한 후에, 골분의 첨가 비율은 A. thiooxidans (5%)와 바이오 황 (5%)를 250 mL 삼각 플라스크에 넣고 5일간 배양한 후 골분 첨가량을 2%, 4%, 10%로 조절하여 위와 동일한 조건에서 배양하였다. 또한 친환경농가에서 주로 사용하는 관행 골분액비를 제조하여 (골분 2 kg, 당밀 300 mL, 건조효모 150 g, 물 10 L) 150일간 배양 후에 본 연구의 골분액비와 수용성 인산 함량을 비교하였다 (An et al., 2014).
골분액비 현탁액의 pH와 수용성 인산의 농도는 배양 1, 5, 6, 10, 20, 30, 40, 50일에 무균 상태에서 pH meter (Orion Star A211, Thermo, USA)로 pH를 측정한 후에 현탁액 3 mL를 채취하여 0.45 µm syringe로 여과한 후 희석하여 인산을 분석하였다. A. thiooxidans의 활성도는 현탁액의 pH를 측정하여 판단하였다 (Han et al., 2009; Bhatti and Yawar, 2010). 인산의 농도는 이온크로마토그래프 (Metrohm 940 professional IC Vario, Switzerland)로 PO4를 측정하여 P2O5로 환산하였다. 또한 골분액비 현탁액의 무기원소 농도를 측정하기 위해 양이온 (K, Ca, Mg, Na, K, Fe, Mn, Cu, Zn)은 유도결합플라즈마발광광도계 (ICP-OES, Optima, 7300DV, PerkinElmer, USA)로 측정하였고, NH4+-N은 MgO로 알카리화여 Kjeldahl법으로 정량하였다. 음이온 (Cl, NO3, PO4, SO4)은 이온크로마토그래프 (Metrohm 940 professional IC Vario)로 측정하였다.
Results and Discussion
골분액비 현탁액의 pH 변화
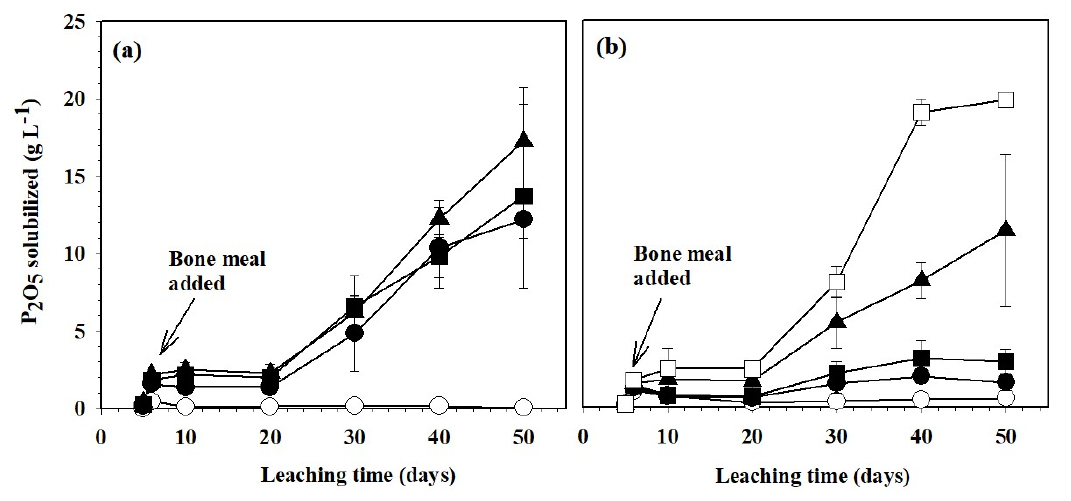
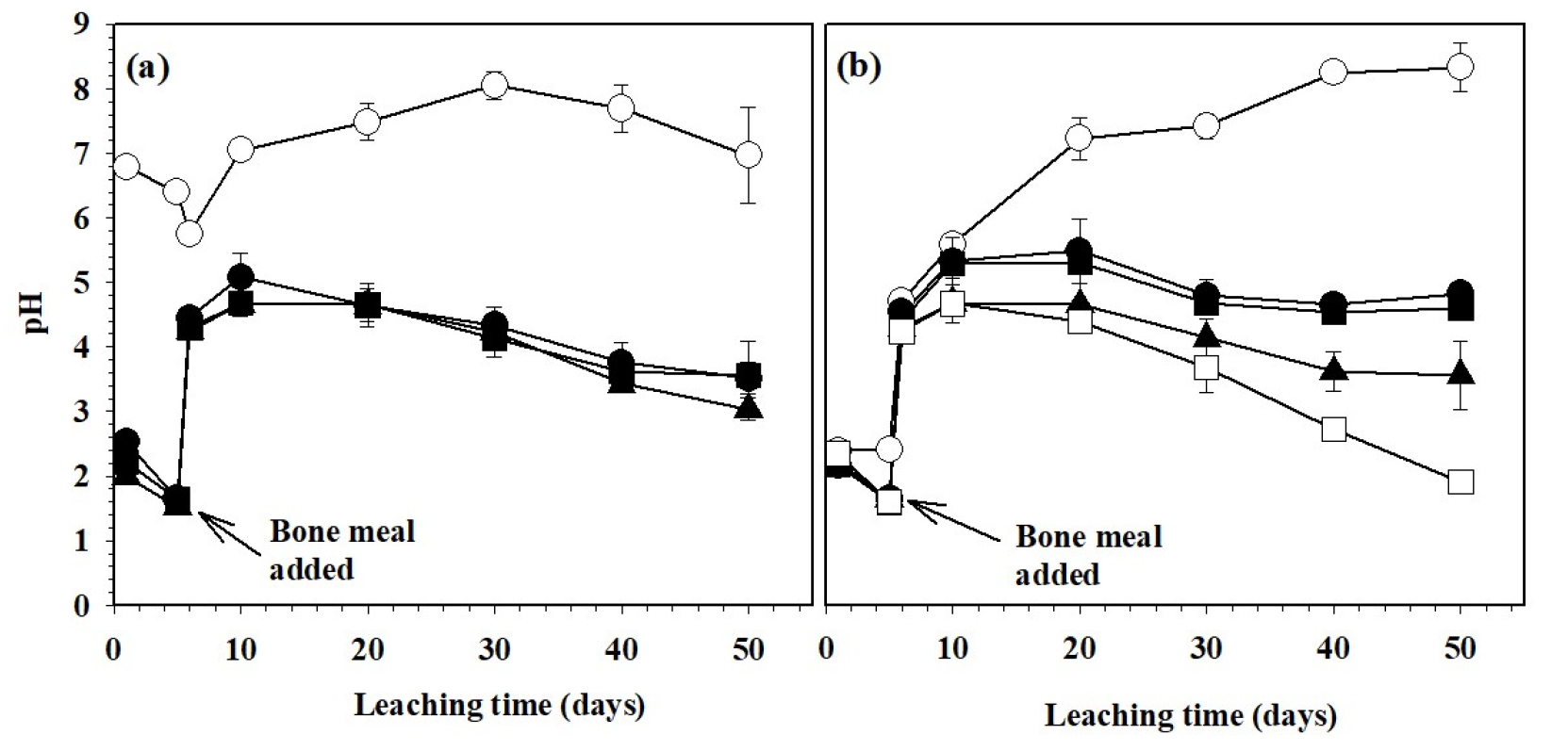
A. thiooxidans는 호기성 환경에서 성장하는 독립영양균으로써 순수 황과 환원된 황화합물을 산화시켜 성장에 필요한 에너지를 얻고 생물학적으로 황산을 생성하여 현탁액의 pH를 낮춘다 (Rajan, 1983; Chi et al., 2006). 미생물 접종량과 바이오 황 첨가량에 따른 골분액비 현탁액의 pH 변화를 Fig. 1에 나타내었다. 바이오 황 2%에 A. thiooxidans의 접종량을 각각 0%, 5%, 10%, 20%로 조절한 조건에서는 A. thiooxidans 현탁액의 pH (pH 1.14) 영향으로 A. thiooxidans을 접종하지 않은 무처리를 제외하고 초기 pH가 2.52에서 1.99로 미생물 접종량이 많을수록 낮았다. A. thiooxidans를 접종한 처리구는 박테리아의 대사 활동에 의해 배양 5일 후 pH가 2.3에서 1.5로 낮아졌다. 골분 (10%)을 첨가한 후부터 pH가 4.5까지 증가하였으나 50일이 경과했을 때에는 3.51에서 3.04범위로 미생물 접종량에 의한 pH차이는 없었다. 그러나 A. thiooxidans을 접종하지 않은 무처리는 실험 기간 동안 pH가 6.79에서 7.0 범위로 낮아지지 않았다 (Fig. 1a).
바이오 황을 각각 0%, 0.5%, 1%, 2%, 5% 넣고 A. thiooxidans를 10% 접종한 조건에서는 바이오 황 무처리구에서 pH가 지속적으로 증가하여 50일째는 pH 8.32까지 높아졌다 (Fig. 1b). 반면에 바이오 황 처리구에서는 첨가량이 증가할수록 pH가 지속적으로 감소하였으며, 특히 바이오 황 5%를 첨가했을 때는 50일 후에 pH가 1.92로 가장 낮았다. 이는 접종된 A. thiooxidans의 활발한 대사작용에 의해 황산이 생성된 결과로 판단되며, Han et al. (2009)과 Bhatti and Yawar (2010)의 결과와 유사한 경향을 보였다. Bhatti and Yawar (2010)은 인광석을 미생물학적 용출법으로 용해시키기 위한 연구에서 sulfur-mud에 A. thiooxidans와 A. ferrooxidans 접종 직후 pH 2.5에서 A. ferrooxidans는 1.54, A. thiooxidans는 pH 1.40으로 낮아졌다고 보고한 바 있다. 그러나 황산화균을 이용한 미생물학적 용출실험은 화학적 화합물들로 배지를 조성하여 용출 실험을 수행한다. 하지만 본 연구에서 사용된 바이오 황은 황 (50%)과 무기양분이 함유되어 있기 때문에 (Table 1) 화학적 배지를 사용하지 않고도 황산화균의 생장과 황산화 활성에는 문제가 없는 것으로 판단된다.
골분액비 현탁액의 가용화된 인산 함량
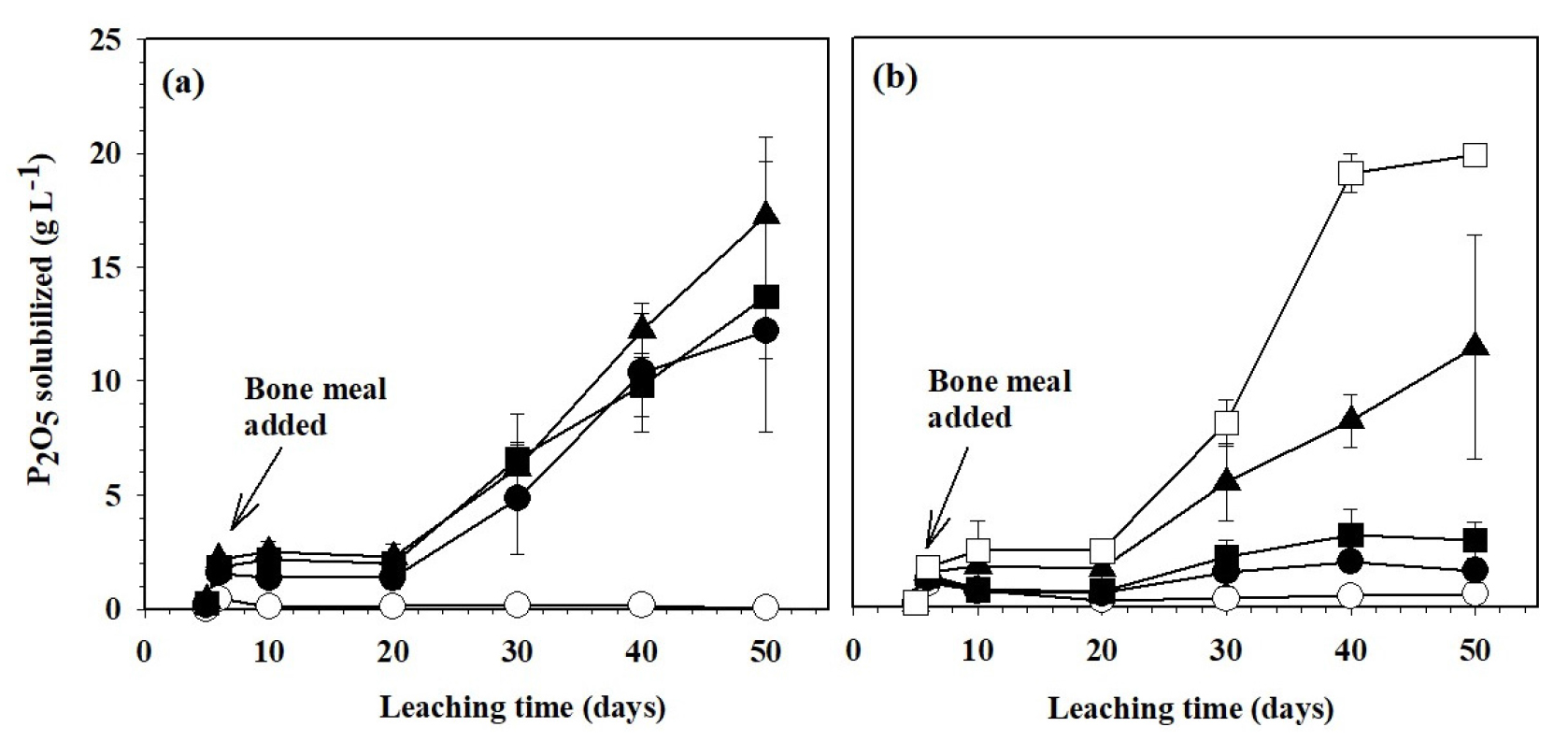
A. thiooxidans의 접종량과 바이오 황 첨가량에 따른 가용화된 인산의 농도 변화를 Fig. 2에 나타내었다. A. thiooxidans을 접종하지 않은 무처리에서는 50일 배양 기간 동안 인산 농도가 0.05 g P2O5 L-1로 큰 변화가 없었다. 반면에 A. thiooxidans을 접종한 처리구는 20일 이후부터 인산 함량이 급속히 증가하였다. 배양 20일부터 A. thiooxidans 접종량이 많을수록 인산 함량이 약 1.5배 높았으나 30일 이후부터는 미생물이 충분이 성장함에 따라 A. thiooxidans의 접종량에 의한 인산 농도의 차이는 없었다 (Fig. 2a).
바이오 황 첨가량을 조절한 조건에서는 바이오 황 무처리구가 바이오 황을 첨가한 조건에 비하여 매우 낮은 인산이 용해되었고, 가용화된 인산 함량은 첨가한 바이오 황의 농도가 높아질수록 증가하였다 (Fig. 2b). 이는 pH변화 (Fig. 1b)와도 일치하는 결과이다. 특히 바이오 황 5%를 첨가한 조건에서 배양 기간이 30일에서 50일로 길어짐에 따라 골분액비 현탁액의 pH가 3.67에서 1.92로 낮아졌으며 (Fig. 1b), 인산 함량은 9.69 g P2O5 L-1에서 23.8 g P2O5 L-1로 증가하였다. Han et al. (2009)은 배양액중에 황 성분이 많으면 황산화균의 생장이 활발하다고 보고한 바 있어 황산화균과 배양액속의 황산이온에 의한 결과로 판단된다. 생물학적 용출과정에서는 골분에 함유된 알칼리 광물이 용해되어 생물학적으로 생성된 황산을 중화시킨다 (Bhatti and Yawar, 2010). 따라서 골분에서 인산의 가용화 효율을 높이기 위해서는 황 첨가량을 증가시킬 필요가 있을 것으로 생각된다.
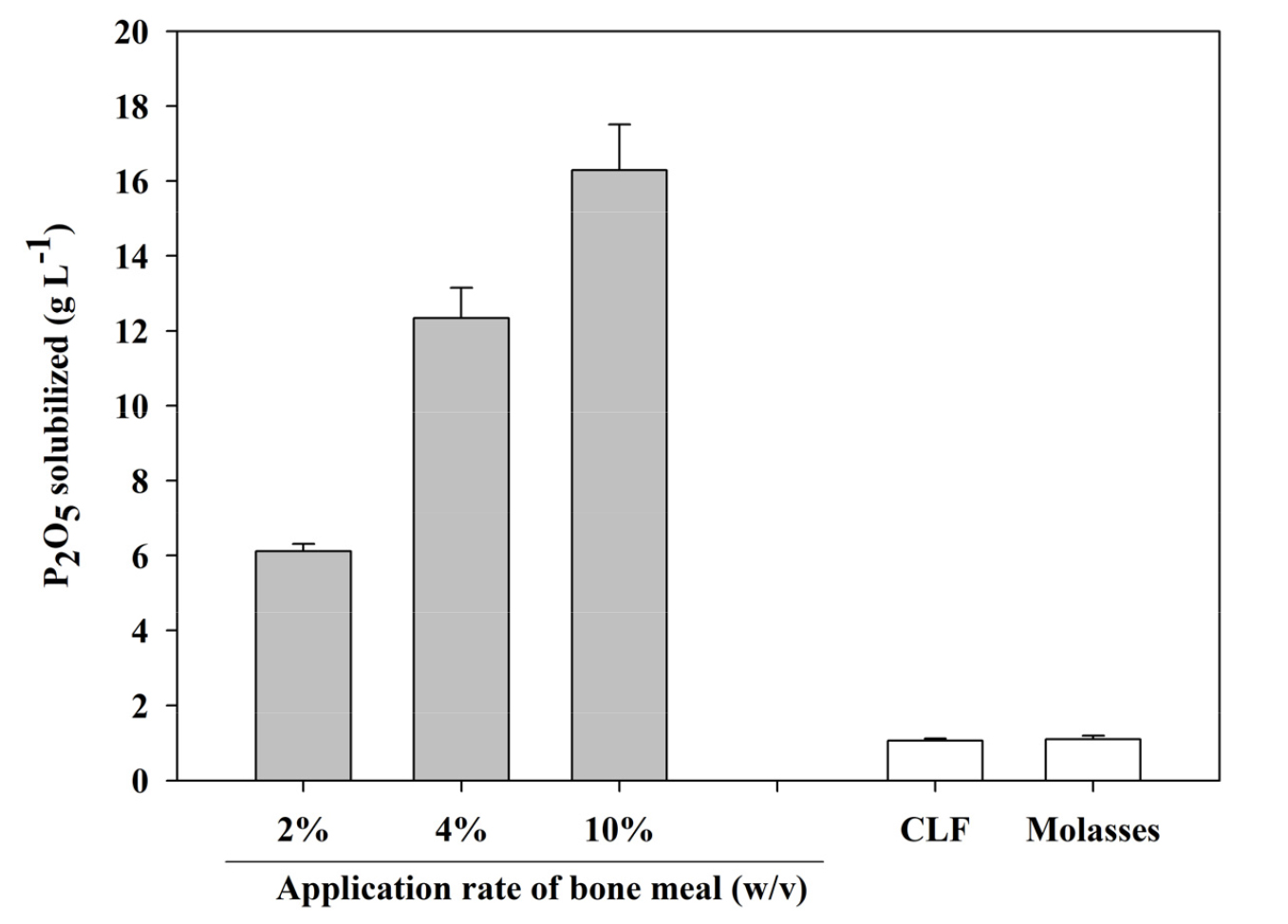
골분첨가 비율에 따른 가용화된 인산 함량을 Fig. 3에 나타내었다. 골분을 2%, 4%, 10%비율을 첨가한 조건에서 인산 함량은 각각 6.11, 12.3 및 16.4 g P2O5 L-1으로 점차 높아졌다. 그러나 관행 골분액비의 수용성 인산 농도는 1.04 g P2O5 L-1로 매우 낮았는데, 이는 당밀에 포함된 인산 함량에 기인하는 것으로 보인다 (Fig. 3). 이러한 결과로 보아 관행 골분액비 제조 기간 동안 인산이 매우 느리게 침출되어 인산이 가용화되기 위해서는 인위적으로 인산 가용화 미생물이나 유기산 성분이 첨가가 필요할 것으로 생각된다.
골분 (10%), 바이오 황 (5%) 및 A. thiooxidans (5%)을 이용하여 배양된 골분액비 현탁액에는 Table 3과 같이 인산 (16.4 g P2O5 L-1)뿐만 아니라 암모늄태 질소와 질산태 질소 (각각 0.5 g L-1) 및 칼슘 (3.5 g L-1) 등도 가용화되어 있었다. 이는 관행액비 제조보다 무기화 과정을 촉진시켜 배양 기간을 단축시키고, 엽면시비 할 경우 작물에 빠르게 흡수될 수 있을 것으로 기대된다. 그러나 본 연구의 골분액비 현탁액은 pH 2.49로 매우 낮고 SO4-S (1.34 g L-1)도 함유되어 있어 작물 재배를 통한 생육 및 토양 환경에 미치는 영향을 추가적으로 연구할 필요가 있다.
Table 3.
pH and water-soluble inorganic nutrient in leach solutions obtained during bioleaching of bone meal†.
Conclusions
본 연구는 바이오 황을 A. thiooxidans의 에너지원으로 이용하여 생물학적 용출법에 의한 골분에 함유된 인산의 가용화 정도를 50일 동안 진탕 배양하면서 조사하였다. A. thiooxidans 접종량이 많을수록 반응 20일 까지는 가용화된 인산 함량이 증가하는 경향을 보였으나 20일에서 50일까지는 미생물 접종량에 따른 차이는 없었다. 바이오 황 함량이 5%인 경우가 인산함량이 23.8 g P2O5 L-1로 가용화 효율이 가장 높았다. 본 연구의 골분액비 현탁액은 관행 골분액비보다 수용성 인산 농도가 20배 이상 높았으며, 질소 및 칼슘 등의 무기양분이 가용화 되어 유기농업에서 작물의 양분 관리에 도움을 줄 것으로 기대된다.