Introduction
산림 토양은 육상 생태계의 탄소의 약 45% 이상을 저장하는 가장 큰 탄소저장고이지만 (Bonan, 2008), 온난화를 동반한 기후변화 조건에서 토양의 탄소 저장 기능에 대한 우려가 있다 (Kirschbaum, 2000; Davidson and Janssens, 2006; Reddy et al., 2010). 산림에서 낙엽은 유기물과 양분의 주요 공급원이며, 낙엽 분해를 통해 탄소가 방출됨은 물론 질소와 인과 같은 양분이 재순환한다 (Berg and McClaugherty, 2008). 따라서, 기후변화 조건에서 낙엽 분해 양상의 변화는 산림 토양의 탄소 저장량 뿐만 아니라, 양분 공급에 따른 산림의 생산성에도 영향을 미쳐 궁극적으로 지구 탄소 순환 과정에 변화를 초래할 수 있다 (Berg and McClaugherty, 2008; Prescott, 2010).
미생물에 의한 낙엽의 분해는 리그닌 (lignin) 함량, 질소 (N) 함량, 탄질비 (C/N), 리그닌과 질소의 비 (lignin/N) 등과 같은 낙엽의 화학성과 토양 특성 (양분 및 수분 함량), 기후 요소 (온도 및 강우) 등 다양한 요인에 의해 영향을 받는 것으로 알려져 있다 (Aerts, 1997; Zhang et al., 2008). 하지만, 동일한 기후 및 지역 조건에서는 낙엽 화학성이 낙엽 분해 속도에 영향을 미치는 주요 인자로 알려져 있다 (Aerts, 1997; Zhang et al., 2008; Prescott, 2010). 기존의 선행 연구들을 살펴보면, 다양한 낙엽의 화학성 중 난분해성인 리그닌 함량과 미생물의 필수 양분인 질소 함량에 따른 낙엽 분해 변화가 상대적으로 널리 수행되었다 (Melillo et al., 1982; Fog, 1988; Taylor et al., 1989; Zhang et al., 2008). 리그닌과 질소 함량은 특히 침엽수와 활엽수 낙엽의 분해 차이를 설명하는데 널리 이용되고 있는데, 일반적으로 리그닌 함량이 낮고 질소 함량이 높은 활엽수가 침엽수 낙엽보다 분해 속도가 빠른 것으로 알려져 있다 (Berg and McClagherty, 2008). 하지만, 리그닌과 질소 함량에 따른 낙엽의 분해는 분해 초기와 후기에 양상이 달라지는데, 낙엽의 분해 초기 단계에서는 리그닌과 같은 난분해성 화합물보다는 이분해성 화합물 (예를 들면, 셀룰로오스, 녹말 등) 함량이 높을수록 낙엽의 분해속도가 빠르며 미생물 증식에 필요한 질소 함량이 높을수록 분해 속도가 더욱 증가한다 (Manzoni et al., 2010; Cotrufo et al., 2013). 이와 달리 이분해성 화합물이 고갈되어 주로 리그닌이 분해되는 시기인 낙엽의 분해 후기 단계에서는 질소 함량이 높을수록 리그닌 분해 효소 (lignase)의 활성이 억제되어 리그닌 분해 속도가 감소하는 것으로 알려져 있다 (Frey et al., 2004; Knorr et al., 2005; Hobbie et al., 2012).
하지만, 일부 연구 결과에 의하면 리그닌이 기존에 알려진 바와 달리 분해 저항성이 크지 않으며 (Rasse et al., 2005; Heim and Schmidt, 2006; Prescott, 2010), 낙엽의 분해 초기 단계에 녹말과 같은 이분해성 탄소화합물과 함께 리그닌의 분해도 시작된다 (Bahri et al., 2008; Klotzbücher et al., 2011). Aponte et al. (2012)는 미생물에 의한 낙엽 분해는 리그닌 함량뿐만 아니라 칼슘 및 망간 함량에 의해서도 달라진다고 보고한 바 있다. 선행 연구에 의하면 낙엽 분해 초기 단계에서 질소보다 칼슘이 낙엽의 분해 속도에 영향을 미치는 더 중요한 요소일 수 있으며, 분해 말기 단계에서는 낙엽의 분해도는 칼슘 함량과 부의 관계를 나타낸다 (Chadwick et al., 1998; Aponte et al., 2012). 망간 또한 리그닌 분해 효소의 활성과 관련하여 낙엽의 분해에 중요한 역할을 하며 (Berg and McClaugherty, 2008; Aponte et al., 2012; Hobbie et al., 2012), 굴참나무 낙엽의 경우 분해 초기단계에서 망간의 영향으로 인해 빠른 속도로 분해된다고 보고된 바 있다 (Davey et al., 2007). 이와 같은 연구 결과는 리그닌과 질소 함량뿐만 아니라, 낙엽의 다양한 화학성이 낙엽 분해에 관여함을 제시한다. 하지만, 기존의 연구는 낙엽의 다양한 화학성을 종합적으로 고려하기 보다는 리그닌, 질소, 칼슘, 망간, 인 등 특정 화학성을 중심으로 진행되어 낙엽 화학성에 따른 분해 특성 차이에 대한 종합적인 이해가 제한적이다 (Melillo et al., 1982; Qualls and Richardson, 2000; Hobbie et al., 2006; Aponte et al., 2012; Zheng et al., 2017). 따라서, 본 연구는 기존의 리그닌과 질소 함량은 물론 칼슘, 망간, 인 함량 등의 다양한 화학성을 종합적으로 고려하여 낙엽의 화학성에 따른 낙엽의 분해 속도 변화를 구명하기 위해 수행되었다.
Materials and Methods
낙엽 시료 채취 및 화학성 분석
다양한 화학성을 갖는 낙엽을 확보하기 위해 CO2와 온도 조건이 상이한 조건에서 생장한 소나무 (Pinus densiflora)와 굴참나무 (Quercus variabilis)의 낙엽을 채취하였다. 예를 들면, 상승 CO2 조건에서는 활발한 광합성 작용으로 탄소 (및 리그닌)이 축적됨에 따라 발생하는 질소 희석 효과로 인해 낙엽의 lignin/N이 증가한다 (Norby et al., 2001). 또한, 상승 온도 조건에서는 토양의 온도 또한 상승하여 토양 내 질소 무기화가 활발해지기 때문에 식물의 질소 흡수량이 증가하여 낙엽의 lignin/N이 감소하는 것으로 알려져 있다 (Emmer and Tietema, 1990; MacDonald et al., 1995; Rustad et al., 2001). 이와 같이 화학성이 상이한 낙엽 확보를 위해 전남대학교 부속농장 (동경 126°53'56", 북위 35°10'26")에 위치한 온도경사형 CO2 훈증 온실 (Temperature-Gradient Field Chamber with CO2 fumigation, TGFC)에서 2012년부터 2013년까지 소나무와 굴참나무 2년생 유묘 생장 실험을 수행하였다. 상세한 실험 방법은 Park (2016)에 설명되어 있으며, 연구 결과의 일부는 Park et al. (2018)에 의해 보고된 바 있다. 정상 CO2 조건의 수목 생장 기간 동안 평균 CO2 농도는 2012년과 2013년에 각각 331.3±1.3 ppmv와 320.1±1.3 ppmv였고, 상승 CO2 조건에서는 각각 647.7±4.8 ppmv와 604.1±3.3 ppmv였다. 온도의 경우 정상 온도 조건의 평균 온도는 2012년과 2013년 각각 24.6±0.3 °C와 25.2±0.3 °C였고, 상승 온도 조건은 각각 26.6±0.3 °C와 27.6±0.3°C였다.
수목 생장이 멈춘 2013년 10월에 낙엽을 채취하고 증류수로 세척하여 토양 입자 및 먼지를 제거한 후 가열건조기 (60°C)에서 5일 동안 건조하였다. 낙엽의 분해 특성은 화학성뿐만 아니라 엽 면적 (Cortez et al., 2007), 엽의 두께 (Pérez-Harguindeguy et al., 2000) 등 물리적 특성에 의해서도 영향을 받으므로, 이러한 영향을 상쇄하기 위하여 건조 시료를 분쇄기 (MM-200, Retsch GmbH 88 & Co., KG, Haan, Germany)를 이용하여 고운 분말 (<0.42 mm)로 만든 후 화학성 분석과 항온배양 실험에 사용하였다.
낙엽 화학성 항목 중 총탄소, 총질소, 리그닌 함량, 무기물 함량을 분석하였다 (Table 1). 총탄소와 총질소는 원소분석기 (FLASHEA-1112, Thermo, USA)를 이용하여 연소법으로 분석하였다 (Nelson and Sommers, 1996). 리그닌 함량은 시료 (0.5 g)에 알코올-벤젠 혼합액 (1:2 V/V)을 가하여 탈지한 후 황산을 가하여 가수분해하였으며, 분해가 완료된 시료는 여과하여 중량법으로 정량하였다 (King and Heath, 1967). 비록 본 방법을 통해 정량한 리그닌 함량이 정확하게 리그닌만을 정량했다라고 보기 어려울 수 있지만, 리그닌 외에 함께 정량된 물질들의 구조성이 리그닌과 매우 유사하다고 보고되었기 때문에 본 연구에서는 리그닌이라고 정의하였다 (Osono and Takeda, 2004). 인, 칼슘, 망간, 알루미늄과 같은 무기물 함량은 시료 (0.5 g)에 HNO3-HClO4-H2SO4 혼합액 (1:8:1)을 가하여 가열 분해한 후 분해액을 유도결합 플라즈마 (IRIS-AP, Thermo Jarrell Ash Corp., Fanklin, MA, USA)로 분석하였다 (Kwak et al., 2009).
Table 1. Selected chemical properties of litters used for the incubation experiment.
†Values are the means with standard errors in parentheses (n=3), and those followed by a different letter are significantly different at α=0.05 between treatments.
토양 시료 채취 및 화학성 분석
수목생장 실험 종료 후 무작위로 선정된 10개의 포트에서 토양을 채취하여 균일하게 혼합하여 실험에 사용하였다. 혼합한 토양은 풍건한 후 2 mm 체를 통과시켜 화학성을 분석하고, 실내항온배양실험에 이용하였다.
토양의 pH, 총탄소, 총질소, 무기태질소 (NH4+와 NO3-), 유효인산을 분석하였다 (Table 2). pH는 토양을 증류수와 1:5 (W/V)로 혼합한 후 30분간 교반하여 pH meter (EcoMet P25, Istek, Inc., Korea)를 이용하여 측정하였다. 탄소와 질소 함량은 원소분석기를 이용하여 분석하였으며, 무기태 질소는 토양을 2 M KCl 용액과 1:5 (W/V)로 혼합하고 1시간 동안 교반한 후 #42 여과지로 여과한 액을 NH4+와 NO3-에 대해 각각 Indophenol법과 VCl3/Griess법에 의해 분석하였다 (Mulvaney, 1996; Doane and Horwáth, 2003). 유효인산은 무기태질소 분석시 침출한 토양 용액을 Bray #1법으로 분석하였다 (Kuo, 1996).
Table 2. Selected chemical properties of soils used for the incubation experiment†.
| Variable | Values† |
| pH (1:5) | 5.93 (0.04) |
| Total C (g C kg-1) | 3.4 (0.8) |
| Total N (g N kg-1) | 0.5 (0.1) |
| C/N | 6.8 (1.0) |
| NH4+ (mg N kg-1) | 14.1 (1.2) |
| NO3- (mg N kg-1) | 1.1 (0.2) |
| Available P (mg P2O5 kg-1) | 7.4 (0.8) |
†Data are also provided in Park et al. (2018) as the same soil was used.
‡Values are means with the standard error of triplicate in parentheses.
실내 항온배양실험 및 CO2 방출 분석
무처리구 (Control)와 소나무 낙엽 처리구 (Pine), 굴참나무 낙엽 처리구 (Oak)를 두었으며, 소나무 낙엽 처리구와 굴참나무 낙엽 처리구에 대해 lignin/N이 낮은 수준 (1)과 높은 수준 (2)으로 처리하여 3반복 실험하였다. 구체적으로 100 mL 비커에 토양 30 g을 충진하고 수분함량을 포장용수량의 60%로 조절한 후 25°C에서 5일간 사전 배양하여 미생물 활성을 회복시켰다. 토양이 충진된 비커에 낙엽 1 g을 균일하게 혼합한 후 0.5 N NaOH 용액 15 mL가 담긴 20 mL 유리병 (CO2 포집액)과 함께 1 L Mason jar에 담아 25°C에서 45일간 항온배양실험을 수행하였다.
CO2 방출량을 조사하기 위하여 항온 배양 1, 2, 3, 5, 7, 10, 15, 20, 25, 30, 35, 40, 45일 째에 CO2 포집액을 수거하였으며, 45일 째를 제외하고 수거한 CO2 포집액 대신 새로운 NaOH 용액이 담긴 CO2 포집액을 넣었다. CO2 포집액 수거시, 공기압축기 (air compressor)를 이용하여 jar 내에 충분한 산소를 공급하였다. 선행 연구에 따르면, 통기 과정 동안의 CO2 손실량은 총 CO2 방출량의 0.7% 이하로 매우 낮아 무시 가능한 정도라고 보고된 바 있다 (Lee et al., 2011; Lim et al., 2012). 또한, 토양 비커를 칭량하여 초기 중량과의 감소분만큼 증류수를 공급하여 수분 함량을 유지하였다. 45일 째에 CO2 방출이 안정화됨을 확인한 후 실험을 종료하였다.
수집한 NaOH 용액에 1 N BaCl2 용액 2 mL를 가하여 탄산 이온을 BaCO3로 침전시킨 후 0.5 N HCl 용액으로 적정하여 CO2 방출량을 조사하였다 (Choi and Chang, 2005). CO2 방출 속도는 mg CO2-C g-1 litter-C day-1로 계산하였으며, 항온 배양 45일까지의 CO2 방출량을 이용하여 누적 CO2-C 방출량을 계산하였다. 낙엽 분해에 의해 방출된 CO2는 낙엽을 혼합한 토양으로부터 방출된 CO2량에서 낙엽을 혼합하지 않은 토양에서 방출된 CO2량을 감하여 계산하였고, 이 때 외부 유기물 투입에 의한 토양 유기 탄소 무기화 변화 (Priming effect)는 크지 않다고 가정하였다 (Kuzyakov et al., 2000).
1차 속도 반응식 적용 및 통계분석
낙엽의 화학성 분석결과와 CO2 방출량은 Shapiro-Wilkt 검정과 Levene's 검정으로 정규성 및 등분산성을 검정하였다. 모든 분석 값이 정규성을 보이며 이질성이 나타나지 않아 데이터 변환은 하지 않았다. SigmaPlot 10.0 (Systat Software Inc., IL) 프로그램으로 시간 (t)에 따른 CO2 누적 방출량 (%Ccum)을 1차 속도 반응식에 적용하여 낙엽의 무기화 가능 탄소 함량 (Cmin, %)과 낙엽의 분해 속도 상수 (k, day-1)를 다음의 식으로 계산하였다 (Lim et al., 2012).
%Ccum=Cmin[1-exp(1-kt)]
여기에서, %Ccum과 Cmin은 투입한 낙엽의 C 함량에 대한 상대적 양으로 표시하였다. 1차 속도반응식의 유의성은 F-test로 검증하였다.
낙엽의 수종에 따른 화학성의 차이와 수종과 낙엽의 화학성에 따른 CO2 방출량 및 분해율 차이는 SPSS 21.0 (SPSS Inc., Chicago)의 일반선형모형을 이용하여 ANOVA로 평가하였으며, 처리 효과가 인정될 경우 Duncan의 다중 비교를 통해 처리 간 차이를 비교하였다. 모든 통계 분석은 95% 수준에서 유의성을 검토하였다.
Results and Discussion
낙엽 투입에 따른 CO2 방출 경향
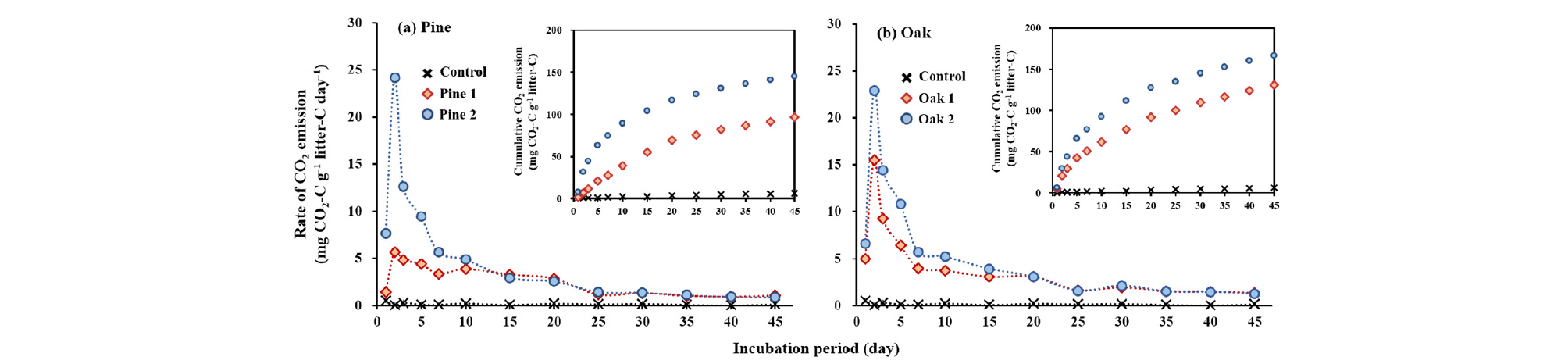
항온배양 실험기간 동안의 낙엽 처리구의 CO2 방출 속도는 수종에 관계없이 2일째 가장 빨랐으며, 25일째까지 점차 감소하다가 이후 안정화 되었다 (Fig. 1). 항온배양 실험기간 동안 낙엽 처리구의 누적 CO2 방출량은 96.5-166.3 mg CO2-C g-1 litter-C 범위로 낙엽 무처리구 (6.1 mg CO2-C g-1 litter-C)보다 약 16배 이상 높게 나타났으며 (Fig. 2), 이는 선행연구와 유사한 결과이다. Bertrand et al. (2007)은 유기물 투입으로 인해 발생하는 토양으로부터의 CO2 방출이 유기물을 투입하지 않은 토양으로부터 발생하는 CO2량보다 10배 이상 높게 나타났다고 보고한 바 있다. 투입한 낙엽의 탄소 함량에 대한 상대적인 분해량을 계산한 결과, 모든 낙엽 처리구에서 45일의 항온배양 실험기간 동안 약 19-32% 가량 분해된 것으로 나타났다 (Table 3). 낙엽의 분해는 낙엽의 화학성뿐만 아니라 토양의 특성 (양분 및 수분 함량, 미생물 생체량 등)과 기후 조건 등에 의해 양상이 달라질 수 있으며 (Berg, 1986; Berg and McClauherty, 2008), 실험 방법 (litter bag 실험, 실내 항온배양실험 등)에 따라 달라질 수 있다. Osono et al. (2014)은 litter bag 실험을 통해 3년간 소나무와 물참나무 (Quercus mongolica) 낙엽의 분해 변화를 조사한 결과, 실험을 시작한지 6개월 후 소나무 낙엽은 약 12%, 물참나무 낙엽은 약 18% 분해되었다고 보고하였다. 반면, Gahrooee (1998)는 실내항온배양실험을 통해 활엽수 낙엽이 항온배양기간 4개월 동안 약 26-42% 분해되었다고 보고한 바 있다. 하지만 이러한 연구 결과는 투입한 낙엽의 탄소 함량이 아닌 낙엽의 전체 질량에 대한 상대적인 양을 의미하고 있어 낙엽 분해에 따른 토양의 탄소 동역학 변화를 구명하기에는 제한적이다. 누적 CO2 방출량 데이터를 1차 속도 반응식에 적용한 결과 낙엽의 총탄소 함량 중 무기화 가능 탄소의 비율은 Oak 2가 15.9%로 가장 높았으나 Pine 1, Pine 2, Oak 1은 서로 간의 통계적 차이가 나타나지 않았다 (Table 3).
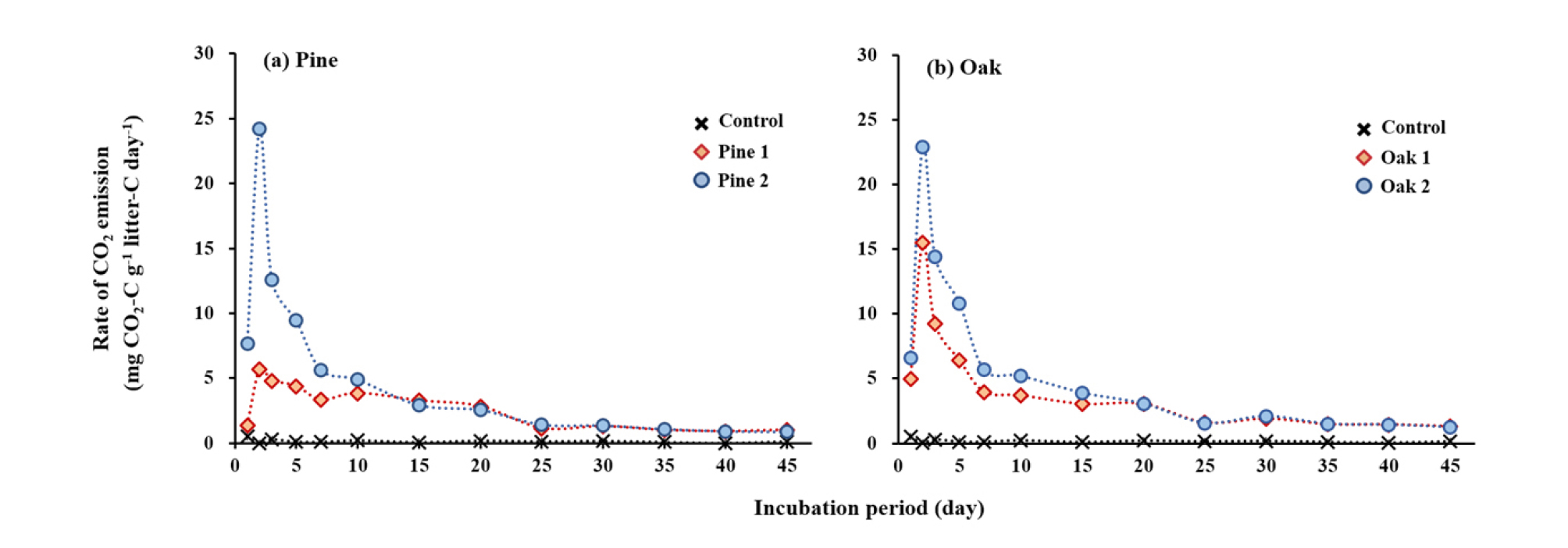
Fig. 1.
Daily CO2 emission rate from soils amended with litters of (a) pine and (b) oak with different litter chemistry during the 45-days incubation. Values are the means of triplicate. Detailed litter chemistry is provided in Table 1, and ANOVA is provided in Table 3. Data for control without litters addition are depicted in all the figure for better comparison.
Fig. 2.
Cumulative CO2 emission from soils amended with litters of (a) pine and (b) oak with different litter chemistry during the 45-days incubation. Values are the means of triplicate. Detailed litter chemistry is provided in Table 1, and ANOVA is provided in Table 3. Data for control without litters addition are depicted in all the figure for better comparison.
Table 3. The cumulative CO2 emission (Ccum), decomposability, and kinetic parameters of the single exponential first-order kinetics model fitted to the CO2 emission for the soils amended with litters of pine and oak with different litter chemistry.
†Values are the means with standard errors in parentheses (n=3), and those followed by a different letter are significantly different at α=0.05 between treatments.
‡Decomposability is the ratio of litter-C decomposed calculated as % of Ccum to total litter C added to the soils. expressed as %.
§Cmin is the size of mineralizable litter-C pool as a percentage of total litter-C and k is litter decomposition rate constant.
¶***, P<0.001.
∮The bold indicates that the effects are significant at α=0.05.
낙엽의 Lignin/N에 따른 분해 특성
전체 기간 중 각 처리별 평균 누적 CO2 방출량 (mg CO2-C g-1 litter-C)은 Oak 2 (166.3) > Pine 2 (145.2) > Oak 1 (130.5) > Pine 1 (96.5)의 순서 (P=0.014)로 나타났는데, 이는 lignin/N 분포 경향 (Pine 2 > Oak 2 > Pine 1 > Oak 1)과 일치하지 않는다 (Table 3). 이와 같은 결과는 기존에 알려진 lignin/N이 낮을수록 낙엽 분해가 빠르다는 사실에 반대되는 결과이다 (Manzoni et al., 2010; Cotrufo et al., 2013). 리그닌은 미생물의 기질 이용 효율 (SUE, substrate use efficiency)이 낮아서 리그닌에서 무기화된 탄소 중 미생물에 동화되어 생체 증식에 사용되는 비율이 낮다 (Bahri et al., 2008). 즉, 미생물에 의해 분해된 리그닌의 탄소는 미생물의 생체량을 증가시키기보다는 무기화되거나 호흡을 통해 손실되기 쉽기 때문에 방출되는 CO2량이 많을 수 있다 (Cotrufo et al., 2013). 유기물의 SUE는 유기물의 종류에 따라 상이한데, 리그닌과 같은 난분해성 물질은 SUE가 낮은 데에 비해 (약 31% 이하, Bahri et al., 2008) 글루코스와 같은 이분해성 물질은 SUE가 높은 것으로 알려져 있다 (약 73%, Dijkstra et al., 2012). 따라서, SUE가 낮은 리그닌이 낙엽 분해 초기 단계에 이분해성 물질과 함께 분해되면서 미생물에 동화되지 않은 CO2가 토양으로부터 방출된 것으로 판단된다. 따라서, 본 연구 결과는 낙엽의 분해에 따른 CO2 방출량은 단순히 낙엽의 lignin/N 비율로만 설명할 수 없음을 보여준다.
낙엽의 무기물 함량에 따른 분해 특성
소나무 낙엽의 경우, 높은 칼슘과 망간에 의해 Pine 1보다 Pine 2가 약 1.5배 분해도가 높은 것으로 나타났다 (Table 3) . 칼슘은 미생물에게 양분이 되는 필수 원소일 뿐만 아니라, 리그닌의 분해와도 밀접한 관련이 있다 (Chadwick et al., 1998; Hobbie et al., 2006; Aponte et al., 2012). 칼슘은 리그닌 분해 효소의 필수 조효소이기 때문에 낙엽의 칼슘 함량이 높을 경우 낙엽의 초기 분해 과정에서 백색부후균종 (White rot fungal species)의 생체량이 증가하여 낙엽의 분해가 빨라진다 (Eriksson et al., 1990). 반면, Aponte et al. (2012)은 리그닌의 비율이 높은 낙엽 분해 말기 단계에서는 칼슘 함량과 낙엽의 분해도는 부의 관계를 나타낸다고 보고하였다. 본 연구는 낙엽의 화학성 중에서도 lignin/N의 낙엽 분해도에 대한 영향을 살펴보기 위하여 수행되었기 때문에 인위적으로 리그닌 함량이 높은 소나무 낙엽 시료 (Pine 1의 경우, Lignin/C=0.91; Pine 2의 경우, Lingin/C=0.78)를 선택하여 실험에 사용하였다. 따라서 항온배양 기간 동안의 전체 분해 과정에서 이분해성 탄소화합물보다는 리그닌의 분해가 소나무 낙엽의 분해에 큰 영향을 미쳤을 것으로 판단된다. 칼슘과 함께 리그닌 분해 효소의 필수 조효소로 작용하는 망간은 곰팡이가 분비하는 리그닌 분해 효소인 망간 과산화효소 (Mn peroxidase)의 생성을 증가시켜 리그닌의 분해 활동을 증가시킨다 (Berg, 2014). 뿐만 아니라, 라카아제 (laccase) (Archibald and Roy, 1992), 리그닌 과산화효소(lignin peroxidase) (Perez and Jeffries, 1992)와 같은 리그닌 분해 효소 또한 망간 함량이 높은 조건에서 분비량이 증가하는 것으로 알려져 있다. 본 연구에서 Pine 2가 Pine 1보다 칼슘과 망간 함량이 약 1.2배 (칼슘 함량의 경우, Pine 1=2.08 g kg-1, Pine 2=2.55 g kg-1; 망간 함량의 경우, Pine 1=0.80 g kg-1, Pine 2=0.97 g kg-1) 높은 것으로 나타났으며, 이에 따라 CO2 방출량 또한 Pine 1을 혼합한 토양 (96.5 g CO2-C g-1 litter-C)보다 Pine 2를 혼합한 토양 (145.2 g CO2-C g-1 litter-C)에서 더 많았다 (Table 3).
한편, 굴참나무 낙엽의 경우, Oak 2보다 Oak 1의 칼슘 (1.7배)과 망간 (1.2배) 함량이 높음에도 불구하고 (Table 1) 토양 내 낙엽의 분해율은 Oak 1 (26.1 %)보다 Oak 2 (32.4 %)가 더 높았다 (Table 3). 이는 Oak 1과 Oak 2의 인 함량 차이에서 비롯된 것으로 판단된다. Oak 2의 인 함량은 0.89 g kg-1으로 Oak 1 (0.26 g kg-1)보다 약 3배 가량 높게 나타났다. 인은 질소와 함께 미생물의 필수 양분이기 때문에 낙엽의 높은 인 함량은 미생물의 생체량을 증가시키고 분해 활동을 촉진하는 등 낙엽의 분해에 상당한 영향을 미치는 것으로 알려져 있다 (Melillo et al., 1982; Berg, 1986; Aber et al., 1990; Aponte et al., 2010; Cheever et al., 2013; Zheng et al., 2017).
따라서, 본 연구 결과에 의하면 낙엽의 분해에 따른 CO2 방출량이 lignin/N 뿐만 아니라 칼슘, 망간, 인 등의 다양한 무기물 함량에 의해서도 영향을 받을 수 있는 것으로 나타났다. 또한, 비록 본 연구에서는 미생물 생체량과 낙엽 분해 효소 활동을 측정하지 않았지만, 소나무 낙엽은 리그닌 분해 효소 활동에 영향을 주는 망간 함량과 낙엽 분해도가 관련이 있었으며 굴참나무의 경우 미생물 활성과 관련된 인 함량이 낙엽 분해에 중요한 역할을 하는 것으로 판단되었다.
Conclusion
본 연구는 소나무와 굴참나무 낙엽을 토양과 혼합하여 발생한 CO2량을 조사하여 낙엽의 화학성에 따른 낙엽의 분해 경향을 비교 검토하였다. 낙엽의 분해에 대한 lignin/N의 영향을 조사한 기존의 선행연구 결과들과 달리, 본 연구에서는 lignin/N이 낮은 낙엽을 투입한 토양보다 lignin/N이 높은 낙엽을 투입한 토양에서 더 많은 양의 CO2가 방출되었다. 이와 같은 결과는 lignin/N뿐만 아니라 인, 칼슘, 망간 등 다양한 낙엽의 화학성이 낙엽의 분해에 영향을 미친 결과이다. 본 연구에서는 소나무 낙엽의 경우에는 칼슘과 망간이 낙엽의 분해도를 결정하는 것으로 나타난 반면, 굴참나무 낙엽의 경우에는 인이 낙엽의 분해에 중요한 역할을 하는 것으로 나타났다. 일반적으로 낙엽의 분해도는 초기 단계에서는 질소, 인, 칼슘과 같은 다량 원소 함량의 영향이 크며, 후기 단계는 리그닌의 분해가 주요 과정이기 때문에 망간의 역할이 큰 것으로 알려져 있다. 본 연구에 사용된 낙엽은 리그닌 함량이 탄소 함량의 약 63% 이상으로 상대적으로 높았기 때문에 본 연구의 결과로 낙엽 분해의 전 과정을 설명하기에는 한계가 있다. 하지만, 칼슘, 인, 망간과 같은 무기물이 리그닌 분해균 및 분해 효소와 관련하여 리그닌 분해에 중요한 역할을 한다는 연구 결과가 지속되게 보고되고 있으며, 본 연구 결과도 이와 상응하다. 따라서, 낙엽의 분해에 대한 낙엽 화학성의 영향을 살펴볼 때 리그닌과 질소뿐만 아니라 칼슘, 망간, 인 등 다양한 화학성을 종합적으로 고려하는 것이 중요하다. 이와 같은 종합적인 연구는 미래 기후변화 조건에서 낙엽의 화학성 변화에 따른 산림 토양의 탄소 동역학 연구에 도움이 될 것이다.