Introduction
수소이온 (proton, H+)과 전자 (electron, e-)는 호흡과 광합성 등 생체내 반응뿐만 아니라 외부 환경의 변화에도 큰 영향을 미치고, 특히 토양에서는 식물생육에 필요한 대부분 원소의 반쪽화학반응에 참여하기 때문에 그 양을 표시하는 pH와 산화환원전위 (Eh;mV, Eh=59.2pe)로 토양환경을 파악 할 수 있다 (Bohrerova et al., 2004; Husson et al., 2016). 또한 pH+pe 값도 중요하게 여겨지는데 이는 반쪽반응식 [산화종 (oxidized species) + e- + H+ ↔ 환원종 (reduced species)]의 평형상수를 이용해 상수로 나타낼 수 있으며 그 자체로 토양의 모든 산화환원반응의 평형상수 합을 의미하기 때문이다 (Sparks, 1999). 대부분 토양의 pH는 3.5-9 범위이고, Eh는 -360~+900 mV (pe -6~+15)이며 담수시 +250~+350 mV 이하의 값을 가지며 pH+pe값은 2에서 18사이에 있다고 알려져 있다 (Lindsay, 1979; Hudsson, 2013).
유기물은 토양의 pH와 Eh에 영향을 미치는 주요한 요인 중 하나이다. 미숙 퇴비나 생유기물을 투입하면 토양미생물은 이를 분해하기 위해 많은 양의 산소를 소모하기 때문에 빠르게 환원조건을 형성하며 Eh를 낮춘다. 그 예로 퇴비화 과정 초기의 Eh는 0 mV까지 떨어진다고 보고되었다 (Hudsson, 2013). 또한 용해된 glucose (C6H12O60)는 6분자의 물과 반응하여 이산화탄소 6분자와 함께 24분자의 전자와 수소이온을 생성하기 때문에 토양 Eh뿐만 아니라 pH도 함께 떨어뜨린다 (Lindsay, 1979; Sa et al., 2008; Gardiner and James, 2012). Kim (2012)의 발표에 의하면, pH 7에서 Eh 600 mV이상일 때 무기태질소는 대부분 NO3- 의 형태로 존재하며 pH+pe 값이 14.32 (pH 7일 때 Eh +480 mV) 이하로 떨어지면 NO3-는 서서히 감소하고 NO2-의 비율이 증가한다. 위와 같은 pH와 Eh 변화로 발생한 NO2-는 불안정한 물질로 산화물과 반응하여 매우 강력한 산화력을 가진 NO2 (g)로 전환돼 질소 양분의 손실을 일으킬 뿐만 아니라 식물에 타는 듯한 해를 가한다. 또한 인산은 pH의 영향을 받아 pH가 낮으면 AlPO4, taranakite형태로 침전되고 pH가 높아져서 HPO42-가 되면 Ca, Mg, Fe와 결합해 침전됨으로써 식물이 이용할 수 없는 형태가 된다. 이외에도 S, Fe, K, Na, Al과 많은 미량원소, 중금속의 행동은 pH와 Eh의 영향을 받으며 이를 적정범위로 유지하는 것은 토양 양분 관리 측면에서도 매우 중요하게 여겨진다 (Hudsson, 2013). RDA (2014)에서는 대부분의 작물이 자라는 데 적절한 pH는 6-7이며 Eh는 pH 7일떄 +480 mV 이상으로 유지해야 한다고 보고하였다.
주로 토양에서는 석회소요량을 측정해 석회를 투입함으로써 pH를 올리는 방법이 사용된다. 국내에서는 농촌진흥청에서 개발한 ORD법을 사용하는데 이는 토양 교질에 흡착된 H+와 Al3+를 K로 치환하고 석회포화용액에서 해리된 OH-를 이용해 중화하는 방법이다. 이외에도 산성토양 교정에 Adams-Evans법, Ca 함량이 높은 토양에선 Shoemaker 법 등이 쓰인다 (NAAS, 2010). 석회소요량의 측정은 포장준비단계에서 적용이 가능한 방법이며, 석회는 용해도가 낮아 잘 녹지 않고 점토교질이 아닌 유기물의 pH 교정에는 효과가 없다. Eh는 토양 건조, 경운이나 담수에 의해 조절이 가능한데 이 역시 작물을 재배하는 중에는 적용이 어려운 실정이다. 한편 Dorau (2017)는 Mn 3가와 4가를 코팅한 Mn-oxide-coated redox bar를 제작해 토양 Eh와 Fe와 Mn의 화학종 변화를 살펴보는 연구를 수행하였는데 Mn은 Fe과 함께 토양의 산화환원 연구에 많이 쓰이는 원소이다. Mn 산화물은 메탄, 암모니아, 수소와 같이 환원된 가스의 과잉을 막아주는 유일한 electron sink로써 작용하기도 한다 (Sparks, 1999). Mn +7가 화합물인 KMnO4 역시 electron sink의 역할을 하여 토양 Eh를 교정하는 데 사용할 수 있을 것으로 예상하였다. 이에 본 연구는 미숙유기물 투입 경험이 있는 포장에 pH를 높이기 위한 강염기 KOH와 Eh를 높이기 위한 산화제 KMnO4를 작물 재배 중에 처리하여 pH와 Eh 변화를 살펴보고 토양 용액을 분석하여 넣어준 K와 Mn의 토양 존재 형태를 살펴보았다.
Materials and Methods
시험포장 토양
본 시험은 전라북도 익산시 소재의 멜론 시설재배농가 (Field A)와 경기도 안산시 소재의 방울토마토 시설재배농가 (Field B)에서 2차례 진행되었다. 두 농가는 개별 관행에 따라 매년 미숙퇴비, 볏짚 등을 토양에 넣고 갈아 주었으며 이의 결과로 잎이 타는 듯 노랗게 변하는 피해를 경험한 농가들이다. Field A의 토양은 pH 5 부근으로 산성이었으며 토양 산화환원전위 (Eh)는 483 mV로 적정기준치 이하로 조사되었고 부분적으로 350 mV 까지 떨어진 곳도 있었다 (Table 1). 또한 비닐하우스의 천장 비닐 및 엽면에서 아질산 (NO2-)이온과 질산 (NO3-) 이온이 검출됨에 따라 토양으로부터 아질산 (NO2) 가스가 방출되는 것으로 판단되었다. Field B의 토양도 pH 5 이하인 산성토양이었으며 산화환원전위는 551 mV로 조사되었다. 시험포장의 시비는 농가 관행에 따라 이루어졌으며 Field A은 고랑관개, Field B는 점적관개를 통해 물을 공급하였다.
Table 1. Chemical properties of examined soil at preliminary stage.
| Field | pH | Eh | EC | OM | Av. P2O5 | Exch. cation (cmolc kg-1) | CEC | |||
| (1:5) | (mV) | (dS m-1) | (g kg-1) | (mg kg-1) | K | Ca | Mg | Na | (cmolc kg-1) | |
| A | 5.2 | 483 | 6.7 | 20 | 951 | 1.0 | 6.4 | 3.1 | 1.8 | 10.4 |
| B | 5.3 | 551 | 1.1 | 34 | 650 | 0.5 | 5.6 | 1.6 | 0.1 | 12.5 |
토양 처리 방법
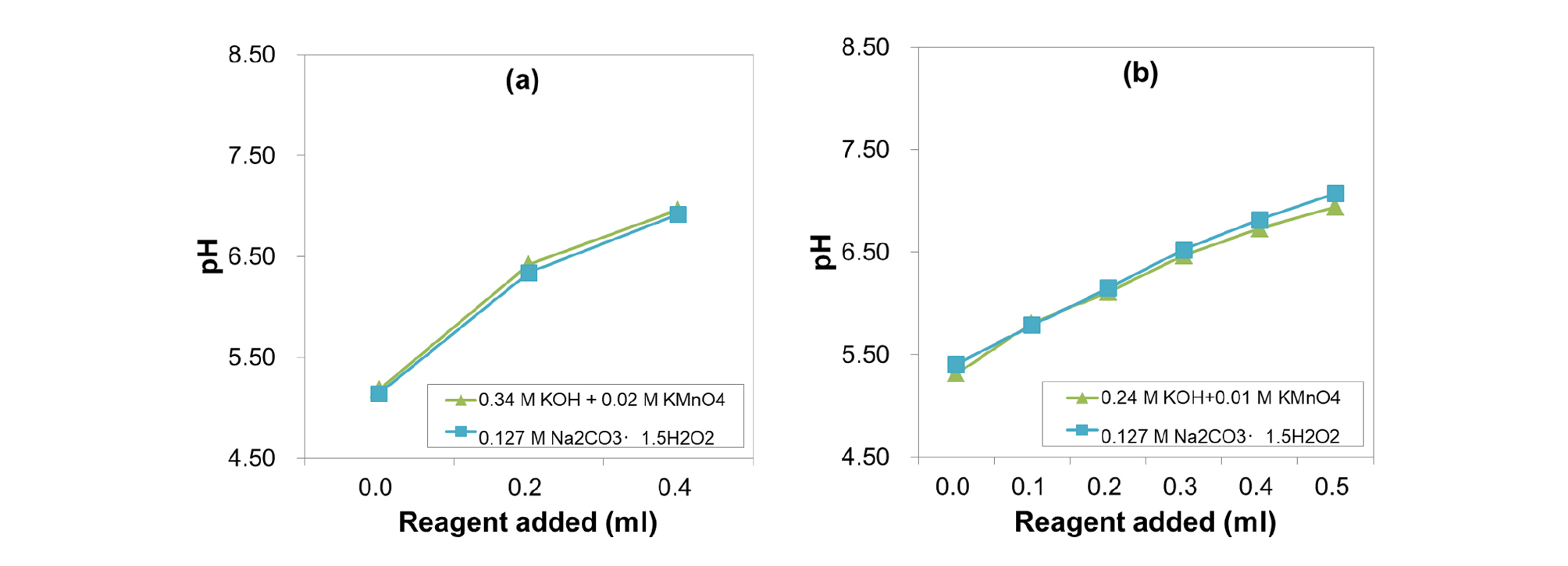
토양에 처리한 KOH와 KMnO4의 양은 적정실험을 통해 결정하였다. 현지 토양 5 cm3을 취해 증류수 25 ml을 가하고 진탕한 후, KOH-KMnO4 혼합용액을 일정 부피씩 가해 최종적으로 pH 6.5 부근이 되는 양을 기준으로 하였다. 기준처리량 (1배)은 Field A의 경우 1 m2당 76.2 g KOH와 11.7 g KMnO4, Field B는 80.4 g KOH와 10.4 g KMnO4 로 증류수에 함께 녹여 처리하였으며 처리수준은 0배 (대조구), 0.5배, 1배, 2배 (Field A) ~ 1.5배 (Field B)로 조성하였다.
| $$KOH\;\text{반쪽반응식: }KOH^0+H^+\leftrightarrow K^++H_2O\;\log\;K^0\;14.50$$ | (Eq. 1) |
| $$MnO_4^-\;\text{반쪽반응식: }MnO_4^-+8H^++5e^-\leftrightarrow Mn^{2+}+4H_2O\;\log\;K^0\;127.71$$ | (Eq. 2) |
또한 토양산도와 산화환원전위를 함께 교정할 능력이 있다고 여겨지는 또 다른 처리제로서 과탄산소다 (SP, Na2CO3〮·1.5H2O2)의 효과도 함께 조사하였다. 과탄산소다는 고체시약 상태로 과산화수소 (H2O2)를 가지고 물과 반응해 H2O2를 내어놓으며 pH는 10-11인 염기성 물질이다 (MnKillop and Sanderson, 1995). 과탄산소다도 다른 처리제와 마찬가지로 적정시험을 통해 처리량을 결정하였으며 Field A 토양은 80 g m-2, Field B 토양은 120 g m-2 가 필요하였다. 토양처리는 KOH+KMnO4, SP 모두 Field A 4월 25일, Field B 8월 13일경에 실시하였다.
토양화학성 분석
시험토양의 화학성 분석은 국립농업과학원 토양화학분석법에 준하여 실시하였다 (NAS, 2010). pH와 EC는 토양 5 g에 증류수를 1:5 (w/v)로 가하여 30분간 진탕 후 측정하였다. 토양유기물 함량은 Tyurin법을 사용하였으며 유효인산은 Lancaster법으로 비색계 (U-3900H, Hitachi)를 이용해 측정하였다. 치환성 양이온은 1M NH4OAc (pH 7.0) 용액으로 추출한 용액을 ICP-OES (Integra XL, GBC)로 분석하였다. 토양 중 수용성 K, Mn은 토양 5 g에 증류수 25 ml을 가하고 30분간 진탕한 후 여과하여 치환성 양이온과 동일한 장비를 사용해 분석하였다. 토양의 양이온치환용량 (CEC)는 1 M NH4OAc (pH 7)로 포화시킨 토양 5 g을 켈달증류한 후 0.1 N H2SO4로 적정하였다. 현장에서의 토양 산화환원전위 (Eh)는 ISO 11271 방법 (KS M ISO 11271, 2001)으로 측정하였다.
토양 삼투압 계산
삼투압은 π = iCRT 로 구하였다. C는 용액의 몰농도 (Morarity, mol L-1)이며 i는 Van't Hoff factor로 물질이 용해돼 개별로 존재하는 이온종 수이고 R은 기체상수 (0.082 L〮atm mol-1 K-1), T는 절대온도 (K)이다. 토양의 삼투압 계산시, 토양의 무기염 이온종 수는 보통 2-3 (예, KCl이나 K2SO4)이므로 i값은 2.5를 사용하였고(RDA, 2014), 토양용액의 몰농도는 Griffin and Jurinak (1973)이 보고한 EC와 이온강도 관계식 μ = 0.013EC를 사용해 구하였다.
Results and Discussion
토양 pH 변화
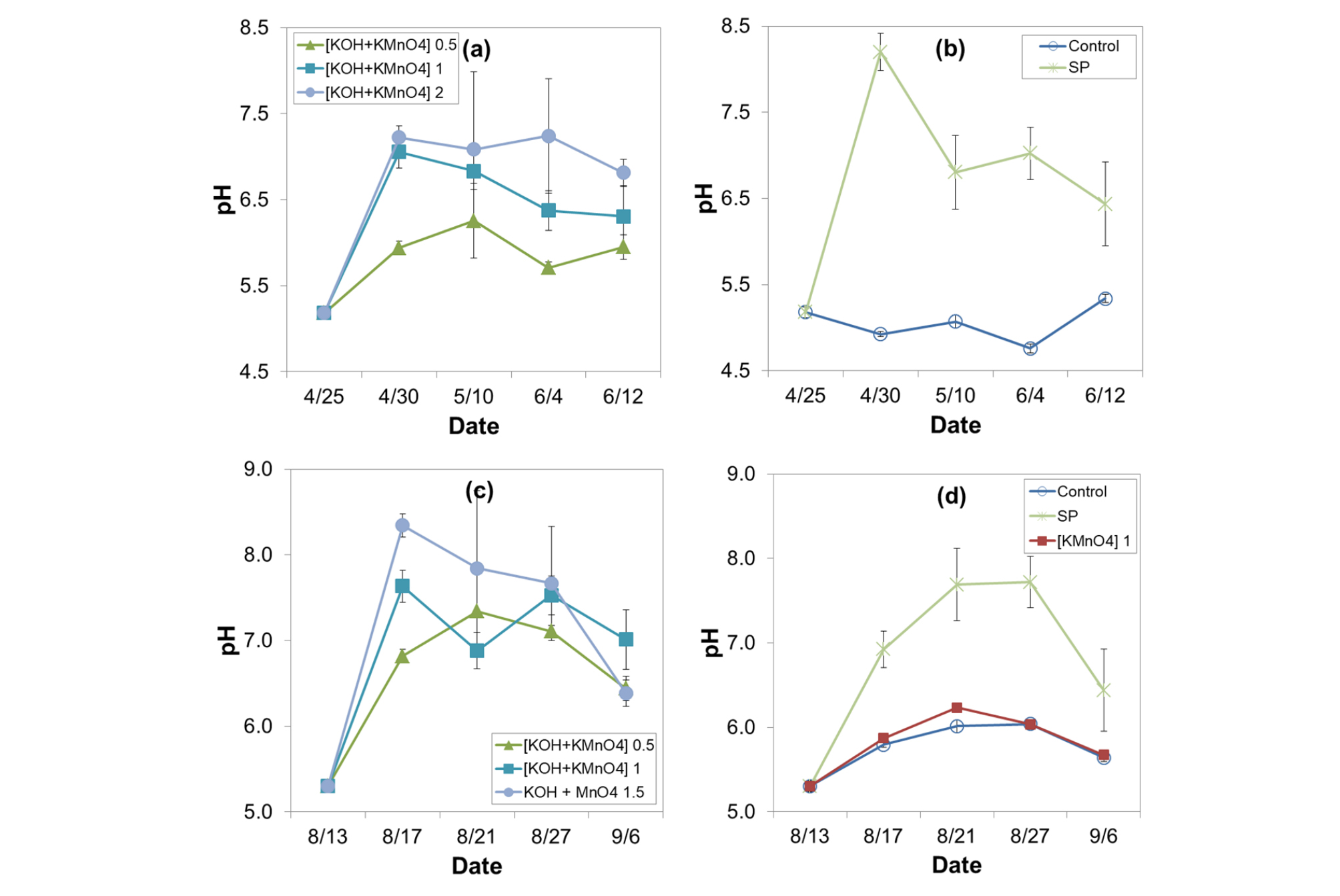
Field A와 Field B의 토양 pH 교정을 위해서 KOH를 투입하고 Eh 교정을 위해 KMnO4를 함께 사용하였다. KOH는 용해도가 높아 석회에 비해 처리효과가 빠르게 나타나고 K+ 양이 늘어남에 따라 KMnO4의 해리를 도울 것으로 판단되었다. 자연상태 토양 5 ml에 대한 처리제 (KOH와 KMnO4, SP)의 적정실험 결과는 Fig. 1과 같았다. Field B에 넣어준 시약의 농도가 Field A에 비해 약간 낮은 수준이었지만 시험전 토양의 pH가 비슷함에 따라, pH 6.5에 도달하기 위해 포장 면적당 필요한 시약의 양은 Field A의 경우 1 m2당 76.2 g KOH, Field B는 80.4 g KOH로 비슷하였다. 적정그래프의 직선여부는 토양 완충력에 따른 차이 (Kim et al., 2004)로 생각되었다.
포장에 KOH와 KMnO4를 처리한 후의 경시적 변화는 Fig. 2와 같이 조사되었다. 처리 5일 후 Field A와 B의 대조구 대비 pH 증가분 (ΔpH)은 0.5배 1.0, 1배 1.8-2.1, 2배 2.3-2.5인 것으로 나타났다. Field A 1배와 2배 처리구의 pH는 7.1과 7.2로 작물 생육 적정 범위 내인 것으로 확인되었으며 조사기간 후반까지 지속적으로 적정범위인 6-7을 유지하였다 (Fig. 2a). Field B 의 처리 5일 후 (8월 17일) pH는 6.8-8.3으로 높은 수준을 보였는데 이는 대조구의 pH도 0.5 가량 증가했기 때문이다 (Fig. 2c, 2d). 처리 불균일 등의 이유로 이때의 pH 변동 폭은 상대적으로 크게 나타났으며 시간이 지난 후에는 처음 목적으로 했던 pH 6-7부근이 되었다.
SP 투입 5일후 Field A의 pH는 8.2로 크게 증가하였으나 이후 낮아져 6월 12일경에는 6.4로 목표치인 6.5에 도달하였다 (Fig. 2b). 반면 Field B는 5일후 pH는 A보다는 낮은 6.9로 나타났으며 Field A와 달리 조사기간 중반까지 증가하는 경향을 보이다가 조사 말에 pH 6.4로 감소하였다.
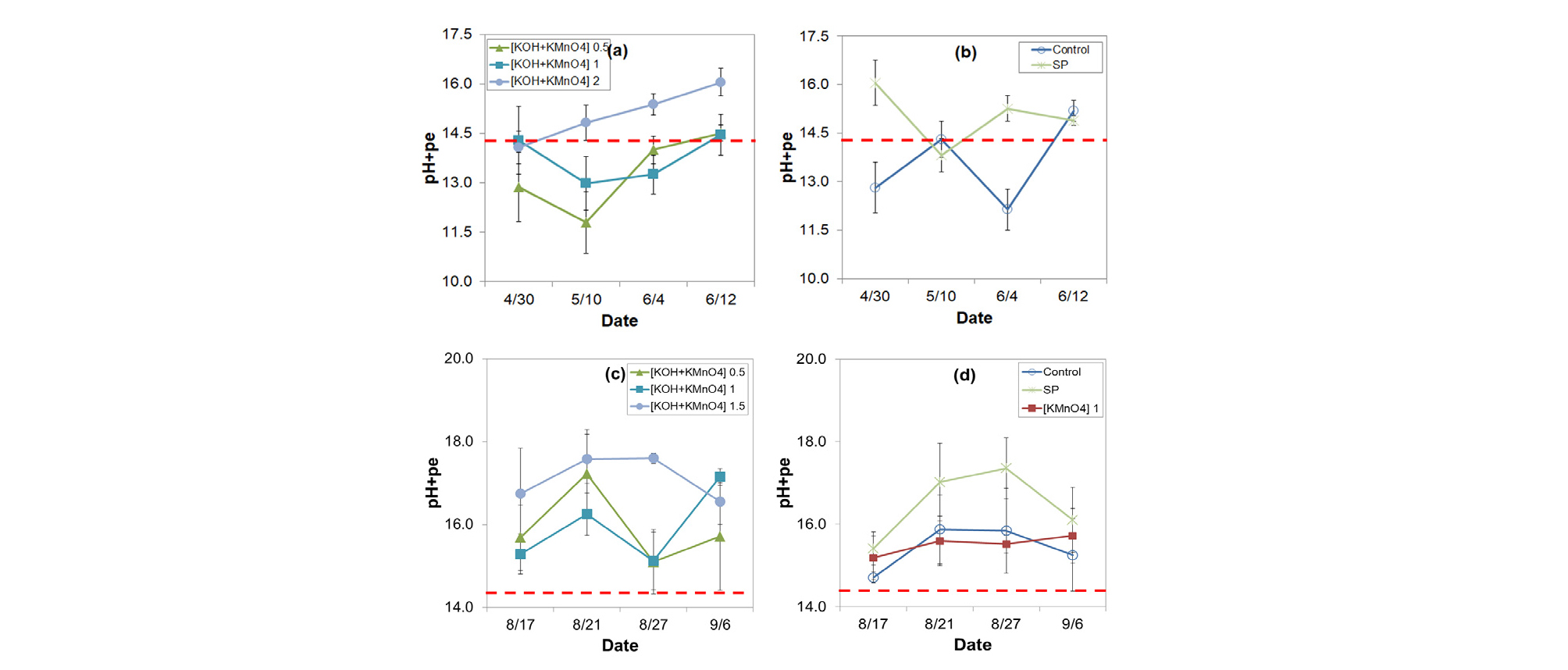
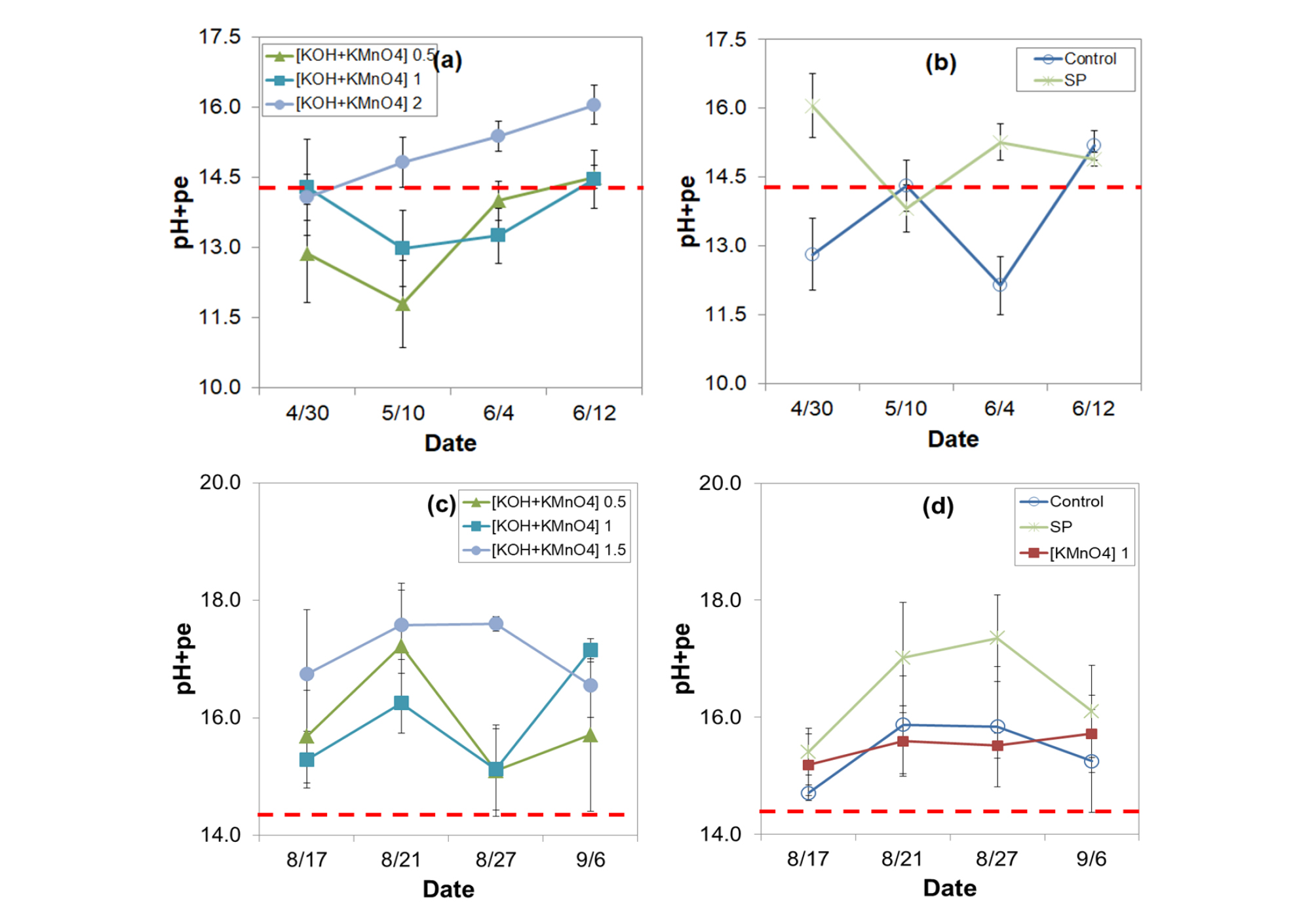
시험기간 중 토양 pH+pe 변화
pH와 Eh는 질산태 질소 (NO3--N)가 아질산태 질소 (NO2--N)로 바뀌는 화학 반응 (NO3- + 2H+ + 2e- ↔ NO2- + H2O, log K0 14.32)에 관여하며 그 조건은 pH + pe ≤ 14.32 일 때이다 (Lindsay, 1979; Kim, 2012; RDA, 2014). 토양의 pH와 pe의 개별적인 변화에도 영향을 받지만 pH+pe 자체로 이와 같은 조건이 형성될 수 있다 (Sparks, 1999). 위와 같은 이유로 Fig. 3에서는 KOH+ KMnO4 처리에 따른 pH+pe 값 변화를 살펴보았다. Field A의 조사기간 중 pH+pe 값은 전반적으로 변동이 큰 것으로 나타났으며, KOH+KMnO4 2배 처리구를 제외하고는 기준치인 14.32를 넘지 않는 것으로 조사되었다. 이는 Field A가 고랑관개를 실시함으로써 토양 환원이 쉽게 이루어지는 조건이 형성되기 때문으로 여겨졌다 (Fig. 3a, 3b). 때문에 고랑관개를 하는 농가에서는 KMnO4 처리량을 늘리거나 관개방법을 바꿔야 NO2(g) 피해를 막을 수 있을 것으로 생각되었다. 반면 Field B에서는 KOH+KMnO4 처리 5일 후 (8월 17일) pH+pe값이 모두 15이상으로 조사되었다 (Fig. 3c, 3d). KOH+KMnO4 1배 처리구와 KMnO4만 단일로 1배 처리한 처리구를 비교하면 토양산화환원전위 (Eh)는 KOH+KMnO4 1배에서는 436 mV, KMnO4 1배에서는 540 mV로 KMnO4 단독처리구가 더 높았으나 pH+pe 값은 KOH 혼합 처리구에서 더 높은 것으로 나타났다. 이는 KOH에 의한 토양 pH 증가 때문으로 보이며, Eh 적정 범위 유지는 토양 pH 관리도 반드시 수반되어야 손쉽게 할 수 있을 것으로 생각되었다.
SP 처리구의 조사기간 중 pH+pe값 변화는 Field A 13.8-16.1과 Field B 15.4-17.4로 모두 14.32이상이었고 KOH+KMnO4 1배와 비슷하거나 더 높았다. 이와 같은 결과로부터 과탄산소다는 단독 처리만으로도 PH와 Eh 교정이 동시에 가능한 토양 처리제로서 사용할 수 있는 처리제로 여겨진다.
토양 중 K와 Mn의 존재 형태와 양
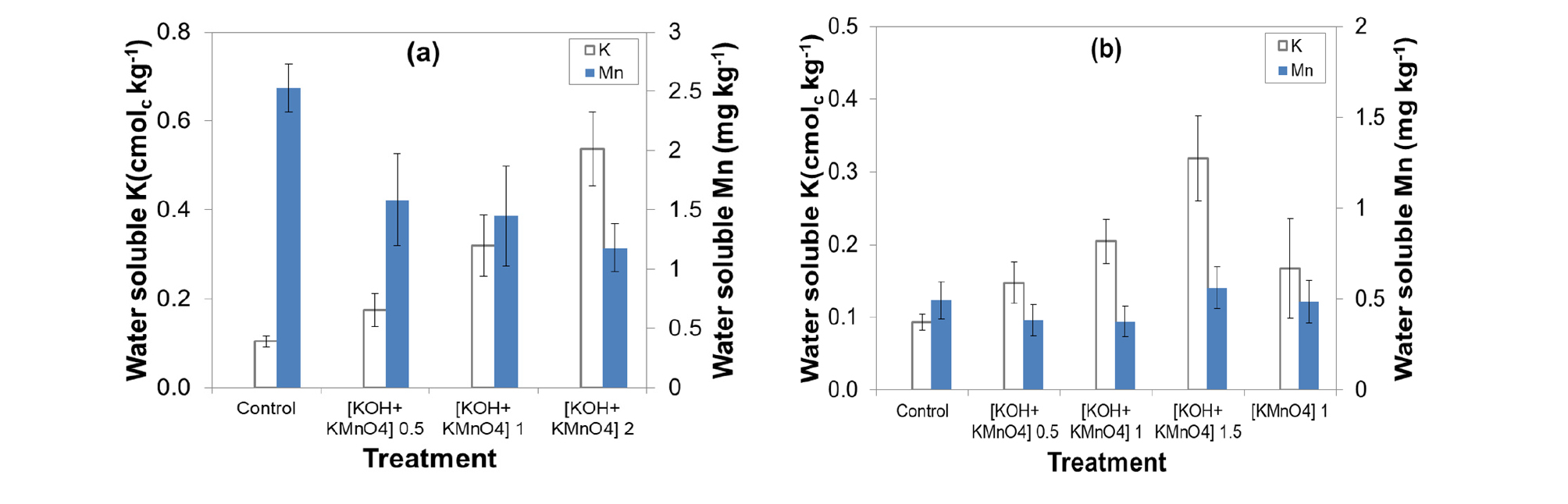
토양처리 후 토양 중 수용성 K 함량은 처리량이 늘어남에 따라 증가하는 경향이 나타났다 (Fig. 4a). 투입된 K의 양 (1배)은 Field A 1.4 cmolc kg-1, Field B 1.5 cmolc kg-1 로 일반 칼리비료 투입량보다 많은 양이며 특히 KOH+KMnO4 2배 처리구의 수용성 K는 0.54 cmolc kg-1 로 조사되어 높은 수준으로 판단되었다. RDA (2006)에 의하면 우리나라 토양의 양이온치환용량 (CEC)는 사양토 8 cmolc kg-1, 식양토 12 cmol kg-1인데, 시험 전 토양의 CEC는 Field A 10.4 cmolc kg-1, Field B 12.5 cmolc kg-1 이었다. 치환성 양이온 (K, Ca, Mg, Na) 함량의 합과 1배 처리량을 합산하면 Field A 13.7 cmolc kg-1과 Field B 9.3 cmolc kg-1으로 계산된다. 산성토양의 CEC는 실제 CEC보다 높게 측정되고 (NAAS, 2010) 토양에는 치환성 양이온 외에도 NH4+ 등 양이온이 존재하므로 실제 CEC는 포화수준 이상으로 여겨지므로 토양 pH 변화는 여분의 K에 의해 알칼리로 나타난 것으로 보였다.
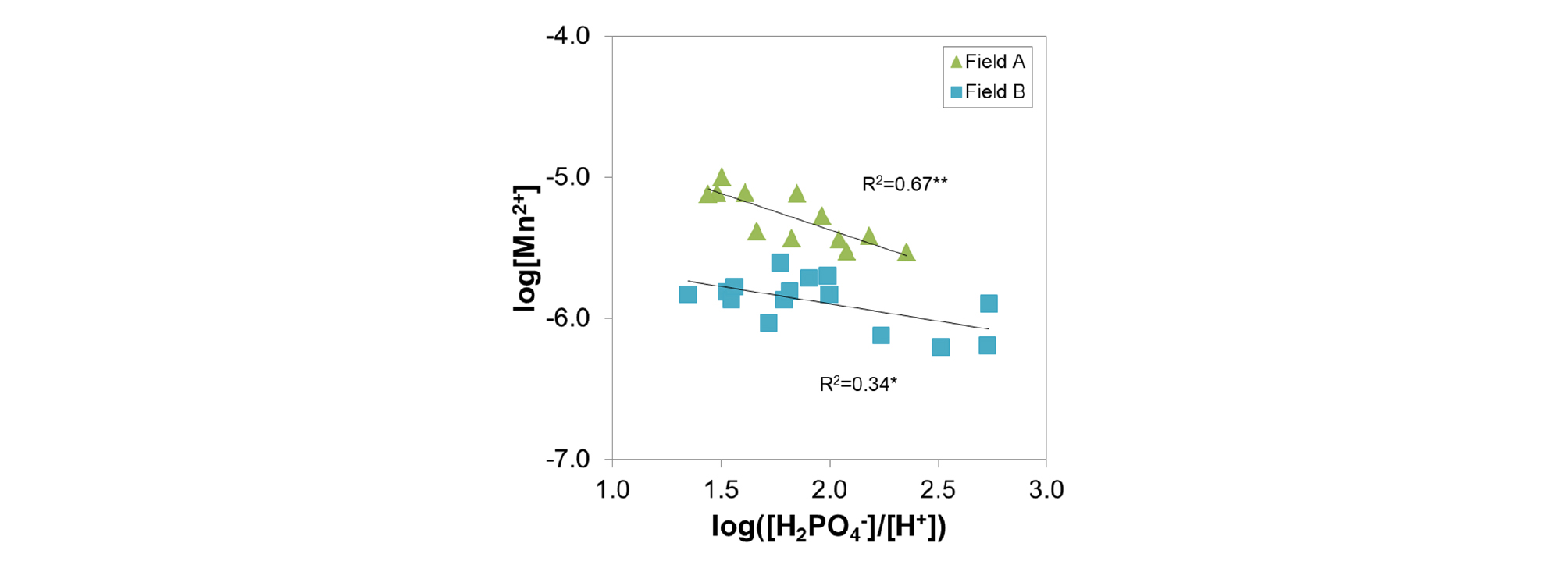
수용성 Mn 함량은 KOH+KMnO4 처리량이 많아질수록 낮아지는 경향이 나타났으며 Field A는 2.53-1.18 mg kg-1이었고 Field B는 Field A보다 낮은 0.49-0.56 mg kg-1로 조사되었다 (Fig. 4). Kim et al. (2002)의 모델을 이용해 시험포장 토양용액 중 이온쌍 (ion pair) 농도를 계산하여 Mn2+와 H2PO4-, H+의 관계를 살펴본 결과는 Fig. 5와 같다. Mn2+ 이온은 H2PO4- 이온과 반응하여 MnHPO4 (c)로 침전되는데 [MnHPO4 (c) + H+ ↔ Mn2+ + H2PO4-, log K0 -5.74] (Lindsay, 1979) 이때 투입된 Mn2+의 양이 많을수록, 비교적 pH가 높아 H2PO4-로 존재하는 인산이 많을수록 (7.2<pH<12.35에서 50%이상 존재) 생성되는 MnHPO4 (c)의 양은 더 늘어난다. 반면, 침전이 일어날수록 H+도 함께 방출되는데 Mn 처리 후 pH가 낮아지는 이유도 이에 의한 것으로 생각된다. KOH를 함께 처리한 처리구에서는 OH-가 토양에서 중화반응을 일으키며 H+를 소모하기 때문에 침전반응이 더 잘 일어날 것으로 보이며 상대적으로 측정된 수용성 Mn 양이 더 많은 Field A에서 이러한 경향이 더 잘 드러난 것으로 보인다. 그러므로 KMnO4를 토양에 투입한 후에는 K2HPO4이나 KH2PO4 형태의 인산을 넣어서 작물 생육에 필요한 인산을 공급하고 Mn 과잉피해를 막을 수 있을 것으로 여겨진다.
토양 삼투압과 식물 고사
KOH와 KMnO4 처리 후 3일 이내에 과량 처리구 (1.5배와 2배)에서는 식물체가 고사하는 현상이 발생하였다. 식물 잎의 삼투압 범위는 -5 ~ -70 atm으로 알려져 있고 수분의 과부족이 없는 곳에서 사는 중생식물 (mesophyte)은 -10 ~ -20 atm, 염생식물 (halophyte)은 -30 ~ -40 atm 이다 (Jefferies, 1981; Campbell and Norman, 1998). 식물이 원활히 물을 흡수하기 위해서는 토양 용액 삼투압이 절대값 5-7 atm 이하로 유지돼야 좋을 것으로 보인다 (RDA, 2014). 토양과 처리한 시약들의 토양 중 삼투압을 계산했을 때 (Table 2), Field A 토양은 시험 전부터 삼투압이 5.3 atm으로 높은 수준이었으며 2배 처리시 토양의 삼투압은 8.8 atm까지 올라갈 것으로 여겨졌다. 1배 처리구도 삼투압이 7 atm 부근으로 올라가는 만큼 고사하는 멜론 식물체가 2-3주 발견되기도 하였다. Field B의 시험 전 토양 삼투압은 0.9 atm이었고 1.5배 처리시에도 3.7 atm으로 Field A에 비해서는 상대적으로 낮은 수준이었으나 고사하는 현상이 나타났는데 이는 식물 종의 차이 때문일 것으로 생각되었다.
Table 2. Osmotic pressure (π = iCRT) of soils and reagent added in soils.
†Calculated in soil water content 40% (w/w).
Conclusion
pH와 pe를 적정범위 (pH + pe ≥ 14.32) 이상으로 올리기 위해 KOH와 KMnO4, 과탄산소다를 사용하였다. pH는 처리 불균일에 의해 부분적으로 높은 곳도 있었으나 시험 전 pH 5 부근이었던 것에 반해 시험 종료까지 pH 6 이상을 유지하였다. pH+pe 값은 점적관개시 모든 처리구에서 pH나 pe 증가로 15이상으로 교정이 가능하였고 과탄산소다도 동일하였다. 이에 반해 환원조건 형성이 쉬운 고랑관개시에는 KOH+KMnO4, 과탄산소다 모두 과량의 처리가 필요한 것으로 확인되었다. 토양양분의 측면에서 볼 때, 토양 CEC를 벗어난 K는 강염기로 작용하여 pH를 높이므로 KOH+KMnO4 처리 전에는 반드시 시험토양의 CEC 측정과 적정시험이 수반되어야 할 것으로 보인다. Mn2+는 토양 중 인산과 침전반응을 일으키므로 작물 생육에 필요한 인산을 공급하고 Mn 과잉을 막기 위해서는 인산 투입이 도움이 될 것으로 판단된다. 또한 작물의 생육을 위해서 처리량을 결정할 때에는 식물 삼투압을 고려해 고사현상이 발생하지 않도록 해야 할 것으로 생각된다.